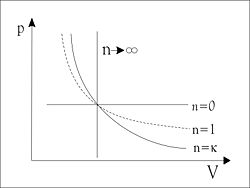
Polytrope Zustandsänderung
In der Thermodynamik wird eine Zustandsänderung eines Systems, in der für Druck und spezifisches Volumen die Gleichung gilt, als polytrop bezeichnet. Der Exponent wird Polytropenexponent genannt. Bei technischen Vorgängen kann der Polytropenexponent als konstant angesehen werden.[1] Eine Polytrope nimmt im p-v-Diagramm die Form einer Potenzfunktion mit negativer Steigung an.
Sonderfälle der polytropen Zustandsänderung sind:

- : isobar
- : isotherm
- : isochor
- : isentrop oder auch adiabat-reversibel
Die einem Gas während dieser Zustandsänderung zugeführte Wärme ist gegeben durch:[2]
Dabei bezeichnet die Masse, und Anfangs- und Endtemperatur des Prozesses. Die Polytropie zeichnet sich durch eine feste Wärmekapazität aus, welche sich aus , und ergibt.
Man spricht auch von polytroper Zustandsgleichung:
mit dem Druck p, der Dichte , der Polytropenkonstante K und dem Polytropenindex m in . Sie findet zum Beispiel Anwendung in der Astrophysik (Lane-Emden-Gleichung).
Ideale Gase
Für ideale Gase, bei isentropen Zustandsänderungen, gelten außerdem folgende Beziehungen:
- bzw.
mit
- : absolute Temperatur
- : Druck
- : Volumen.
- : Druck
Bei der isentropen Zustandsänderung eines idealen Gases gilt . Mit der isobaren Wärmekapazität und der isochoren Wärmekapazität . Bei zweiatomigen Gasen kann (beispielsweise Luft als Gasgemisch) und bei einatomigen Gasen (Edelgasen) angesetzt werden.
Literatur
Einzelnachweise
- ↑ Fran Bosniakovic, "Technische Thermodynamik", 7. Auflage, Steinkopf-Verlag Darmstadt; Kapitel 4.5 "Polytrope Zustandsänderung"
- ↑ Peter Stephan u. a.: Thermodynamik. Grundlagen und technische Anwendungen, Bd. 1: Einstoffsysteme. 18. Aufl. Springer, Berlin 2013, S. 115, ISBN 3-642-30097-9.