Platin(VI)-fluorid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
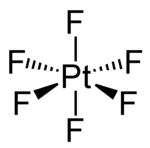 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Platin(VI)-fluorid | |||||||||||||||
| Andere Namen | Platinhexafluorid | |||||||||||||||
| Summenformel | PtF6 | |||||||||||||||
| Kurzbeschreibung | dunkelroter kristalliner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 309,07 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | 5,21 g·cm−3 (−140 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | 69,1 °C[1] | |||||||||||||||
| Löslichkeit | reagiert heftig mit Wasser[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Platin(VI)-fluorid oder Platinhexafluorid (PtF6) ist eine chemische Verbindung der Elemente Platin und Fluor. Es handelt sich um ein extrem starkes Oxidationsmittel, das in der Lage ist, molekularen Sauerstoff oder Xenon zu oxidieren. Dabei wird Platin(VI) selbst zu Platin(V) reduziert.
Geschichte
In der Stoffchemie der Edelgase hat es in den 1960er Jahren eine bedeutende Rolle gespielt, da es mit PtF6 erstmals gelang, eine Edelgasverbindung darzustellen. Dem amerikanischen Chemiker Neil Bartlett gelang es 1962 mit PtF6, das Disauerstoff-Molekül O2 zu oxidieren:
Er stellte fest, dass die erste Ionisierungsenergie von O2 der des Xenon ähnlich ist und dass das Dioxygenyl-Kation (O2)+ in etwa die gleiche Größe wie das Xe+-ion hat. So kam er zur Erkenntnis, dass sich auch Xe oxidieren lassen müsse:
So wurde die erste Edelgasverbindung synthetisiert und die Annahme widerlegt, Edelgase gingen keine Verbindungen ein.
Darstellung
- Disproportionierung von PtF5 ab 130 °C:[5]
Eigenschaften
Platinhexafluorid ist ein dunkelroter kristalliner Feststoff, der bei 61,3 °C schmilzt und bei 69,1 °C siedet.[1] Sein Gas ist braunrot und bis 200 °C thermisch stabil.[6] Er kristallisiert im orthorhombischen Kristallsystem (gemessen bei −140 °C) in der Raumgruppe Pnma (Raumgruppen-Nr. 62) mit den Gitterparametern a = 937,4 pm, b = 852,7 pm und c = 493,3 pm und vier Formeleinheiten pro Elementarzelle mit einer berechneten Dichte von 5,21 g·cm−3.[2]
Einzelnachweise
- ↑ a b c d David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, S. 4-81.
- ↑ a b T. Drews, J. Supeł, A. Hagenbach, K. Seppelt: "Solid State Molecular Structures of Transition Metal Hexafluorides", in: Inorganic Chemistry, 2006, 45 (9), S. 3782–3788; doi:10.1021/ic052029f; PMID 16634614.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1728.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6.
- ↑ Georg Brauer, unter Mitarbeit von Marianne Baudler u. a. (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I. Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 278.
Literatur
- B. Weinstock, H. H. Claassen, J. G. Malm: Platinum Hexafluoride. In: Journal of the American Chemical Society, 1957, 79, S. 5832–5832; doi:10.1021/ja01578a073.
- Janiak, Klapötke, Meyer: Moderne Anorganische Chemie, de Gruyter, Berlin New York 1999, S. 40–41.
Auf dieser Seite verwendete Medien
Platin(VI)-fluorid; Platinhexafluorid
