Plasmalogene

Plasmalogene sind Etherlipide, die strukturell den Phosphatidylcholinen bzw. Phosphatidylethanolaminen ähneln. Der Unterschied ist, dass am endständigen Kohlenstoff-Atom des Glycerins anstelle eines Fettsäure-Esters ein Enolether vorhanden ist. Die zweite, als Ester gebundene Fettsäure ist zumeist mehrfach ungesättigt. Über 10 % der Phospholipide des Gehirns und der Muskeln gehören zur Gruppe der Plasmalogene. Da ein Zusammenhang der Plasmalogene mit verschiedenen Neuropathologien zu bestehen scheint, sind sie Gegenstand intensiver Forschung.
Sie wurden von Robert Feulgen entdeckt.
Funktionen
Plasmalogene kommen in vielen menschlichen Geweben vor, insbesondere in größeren Mengen im Nerven-, Immun- und Herzkreislaufsystem. Gewebespezifisch lässt sich unterscheiden, dass im menschlichen Herz vermehrt Plasmalogene mit Cholin als Kopfgruppe (sogenannte Phosphatidylcholin-Plasmalogene) vorkommen, während in den Myelinscheiden des Nervensystems vor allem Phosphatidylethanolamine mit Ethanolamin als Kopfgruppe zu finden sind.
Obwohl die Funktionen der Plasmalogene noch nicht vollständig aufgeklärt sind, konnte gezeigt werden, dass sie Säugerzellen gegen Oxidationsschäden schützen. Weiter wird vermutet, dass sie eine Rolle in der Signaltransduktion spielen.
Biosynthese
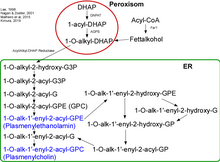
Die Biosynthese der Plasmalogene findet in den Peroxisomen und im endoplasmatischen Retikulum (ER) statt. Zu Beginn entsteht ein Komplex aus den Enzymen GNPAT (Glycerolphosphat-Acyltransferase) und AGPS (Alkyl-Glycerolphosphat-Synthase) an der luminalen Seite der peroxisomalen Membran.[1] Es wurde gezeigt, dass bei fehlen z. B. der AGPS das kooperierende Enzym GNPAT einen Aktivitätsverlust erleidet.[2][3] Der erste Schritt der Synthese wird von GNPAT eingeleitet. Es acyliert DHAP (Dihydroxyacetonphosphat) an der sn-1-Position. Dann tauscht die AGPS den Acylrest mit einem Alkylrest aus.[4][5] Das entstandene 1-Alkyl-DHAP wird zu 1-O-Alkyl-2-Hydroxy-sn-Glycerophosphat (GPA) reduziert. Diese Reaktion wird durch eine Acyl/Alkyl-DHAP-Reductase katalysiert, die am ER und an der peroxisomalen Membran lokalisiert ist.
Alle weiteren Modifikationen finden nun im ER statt. Zuerst wird hier ein Acyl-Rest an die sn-2-Position durch eine Alkyl/Acyl-GPA-Acyltransferase gehängt, wobei die Phosphatgruppe durch eine Phosphatase entfernt wird. Hierbei entsteht 1-O-Alkyl-2-Acyl-sn-Glycerol. Eine Phosphotransferase formiert nun mit CDP-Ethanolamin 1-O-Alkyl-2-Acyl-sn-GPEtn. Nach Dehydration an der 1- und 2-Position der Alkylgruppe durch ein Elektronentransportsystem und eine Plasmenylethanolamin-Desaturase wird nun endlich die PL-typische Vinyl-Etherbindung geformt. Plasmenylcholin entsteht aus 1-O-Alkyl-2-Acyl-sn-Glycerol mit Hilfe der Cholin-Phosphotransferase.
Da es keine Plasmenylcholin-Desaturase gibt, können Cholin-PLs nur durch einen Umweg entstehen. Dabei werden Ethanolamin-PLs zu 1-O-(1Z-Alkenyl)-2-Acyl-sn-Glycerol hydrolysiert und durch das Enzym Cholin-Phosphotransferase mit CDP-Cholin so modifiziert, sodass Cholin-PLs entstehen.[6][7]
Pathologien
Das Zellweger-Syndrom ist u. a. charakterisiert durch einen Plasmalogenmangel, da die Peroxisomen fast keine Enzyme mehr beinhalten und abgebaut werden. So können sie die Plasmalogene nicht mehr synthetisieren.[8]
Ein reduzierter Gehalt von Plasmalogenen im Gehirn wurden assoziiert mit der Alzheimer-Krankheit,[9] der X-linked Adrenoleukodystrophie,[10] und dem Down-Syndrom.[11]
Literatur
- Nagan N, Zoeller RA: Plasmalogens: biosynthesis and functions. In: Prog. Lipid Res. 40. Jahrgang, Nr. 3, Mai 2001, S. 199–229, PMID 11275267.
- de Vet EC, Ijlst L, Oostheim W, et al.: Ether lipid biosynthesis: alkyl-dihydroxyacetonephosphate synthase protein deficiency leads to reduced dihydroxyacetonephosphate acyltransferase activities. In: J. Lipid Res. 40. Jahrgang, Nr. 11, November 1999, S. 1998–2003, PMID 10553003 (jlr.org).
Weblinks
- D'Eustachio / reactome: Plasmalogen biosynthesis
Einzelnachweise
- ↑ P. Brites, H. R. Waterham, R.J. Wanders, Functions and biosynthesis of plasmalogens in health and disease, Biochim. Biophys. Acta 1636 (2004) 219–231.
- ↑ J. Biermann, W. W. Just, R. J. Wanders, H. Van Den Bosch, Alkyl-dihydroxyacetone phosphate synthase and dihydroxyacetone phosphate acyltransferase form a protein complex in peroxisomes, Eur. J. Biochem. 261 (1999) 492–499.
- ↑ D. Hardeman, H. van den Bosch, Topography of ether phospholipid biosynthesis, Biochim. Biophys. Acta 1006 (1989) 1–8.
- ↑ A. J. Brown, F. Snyder, Alkyldihydroxyacetone-P synthase. Solubilization, partial purification, new assay method, and evidence for a ping-pong mechanism, J. Biol. Chem. 257 (1982) 8835–8839.
- ↑ P. F. James, A.C. Lake, A. K. Hajra, L. K. Larkins, M. Robinson, F. G. Buchanan, R. A Zoeller, An animal cell mutant with a deficiency in acyl/alkyl-dihydroxyacetone-phosphate reductase activity. Effects on the biosynthesis of ether-linked and diacylglycerolipids, J. Biol. Chem. 272 (1997) 23540–23546.
- ↑ T. C. Lee, Biosynthesis and possible biological functions of plasmalogens, Biochim. Biophys. Acta 1394 (1998) 129–145.
- ↑ N. E. Braverman, A. B. Moser, Functions of plasmalogen lipids in health and disease, Biochim. Biophys. Acta (2012), doi:10.1016/j.bbadis.2012.05.008.
- ↑ R. Wanders, H. Waterham: Peroxisomal disorders: the single peroxisomal enzyme deficiencies. In: Biochimica et Biophysica Acta (2006) - Molecular Cell Research Band 1763, S. 1707. doi:10.1016/j.bbamcr.2006.08.010.
- ↑ M. O. W. Grimm, J. Kuchenbecker, T. L. Rothhaar, S. Grösgen, B. Hundsdörfer, V. K. Burg, P. Friess, U. Müller, H. S. Grimm, M. Riemenschneider, T. Hartmann: Plasmalogen synthesis is regulated via alkyl-dihydroxyacetonephosphate-synthase by amyloid precursor protein processing and is affected in Alzheimer's disease. In: Journal of Neurochemistry (2011), Band 116, Nr. 5, S. 916–925. doi:10.1111/j.1471-4159.2010.07070.x. PMID 21214572.
- ↑ M. Khan, J. Singh, I. Singh: Plasmalogen deficiency in cerebral adrenoleukodystrophy and its modulation by lovastatin. In: Journal of Neurochemistry (2008), Band 106, Nr. 4, doi:10.1111/j.1471-4159.2008.05513.x. PMC 2575097 (freier Volltext). PMID 18540993.
- ↑ E. J. Murphy, M. B. Schapiro, S. I. Rapoport, H. U. Shetty: Phospholipid composition and levels are altered in Down syndrome brain. In: Brain Research (2000), Band 867, Nr. 1–2, S. 9–18. doi:10.1016/S0006-8993(00)02205-8. PMID 10837793.
Auf dieser Seite verwendete Medien
Autor/Urheber: Phaeton68, Lizenz: CC BY-SA 4.0
Plasmalogen Synthese-alle Schritte in deutsch
Beispielstruktur eines Plasmalogen

