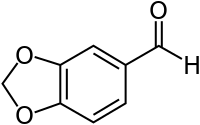
Piperonal
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Piperonal | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C8H6O3 | ||||||||||||||||||
| Kurzbeschreibung | farbloser Feststoff mit blumigem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 150,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest[2] | ||||||||||||||||||
| Dichte | 1,337 ± 0,06 g·cm−3[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | 264 °C[4] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Piperonal ist ein Aromastoff mit Vanille- und Mandelgeruch. Piperonal wird wegen seines an Heliotrop erinnernden Geruchs auch als Heliotropin bezeichnet.
Der Name Piperonal stammt von der erstmaligen Synthese, welche von dem Pfefferinhaltsstoff Piperin („Piperyl-Piperidin“) ausging. Die durch Zerfall von Piperin entstandene Piperinsäure ergab nach einer Umsetzung mit Kaliumpermanganat in alkalischer Lösung Piperonal.
Vorkommen

Piperonal kommt in geringen Mengen in den Blütenölen von Echtem Mädesüß (Filipendula ulmaria) und der Gewöhnlichen Robinie (Robinia pseudoacacia) vor. Daneben kann es im Öl des Kampferbaum, in Pfeffer, den Blüten der Tuberose, in der Amerikanischen Heidelbeere, in der Gewürzvanille und den Blüten der Duftveilchen nachgewiesen werden.[5]
Gewinnung und Darstellung
Erste Forschungsarbeiten gehen auf Carl Liebermann am Berliner Gewerbeinstitut zurück. Es gibt mehrere Möglichkeiten zur Darstellung von Piperonal. Die übliche Herstellung ist die Isomerisierung des Naturstoffs Safrol zu Isosafrol und anschließende Oxidation zu Piperonal mit Kaliumpermanganat, Kaliumdichromat oder Ozon. Eine ältere Methode ist die Umsetzung von Protocatechualdehyd und Methyleniodid mit Kaliumhydroxid.
Die Frage, ob die Gewinnung von Piperonal tatsächlich in größerem Maßstab aus natürlichen Stoffen möglich ist oder ob es sich dabei um eine Synthese handelt, wurde in einem Rechtsstreit zwischen dem Schokoladenhersteller Ritter Sport und der Stiftung Warentest öffentlich diskutiert.[6] Das Münchner Landgericht hat im Januar 2014 eine einstweilige Verfügung gegen die Stiftung Warentest bestätigt, der zufolge diese nicht mehr behaupten darf, das von Ritter Sport verwendete Piperonal sei falsch als „natürliches Aroma“ deklariert worden. Wie das von dem Unternehmen Symrise gelieferte Piperonal tatsächlich hergestellt wurde, geht aus dem Urteil, das die Stiftung Warentest anfocht, nicht hervor.[7][8] Nach einer später erfolgten Darstellung nutzt das Unternehmen das aus dem Sassafrasbaum (Sassafras albidum) extrahierte und angereicherte Safrol als Vorstufe einer biochemischen Umwandlung zur Herstellung von Piperonal, von dem Ritter Sport im Jahr sechs Kilogramm bezieht.[9][10] Im September 2014 bestätigte das Oberlandesgericht München das Urteil und wies den Widerspruch der Stiftung Warentest endgültig ab.[11]
Eigenschaften
Piperonal bildet meist farblose, gut ausgebildete Kristalle, die sich unter dem Einfluss von Licht, großer Hitze oder im Kontakt mit Eisen, z. B. Blechdosen, braun färben. Der Stoff ist in Ethanol und in Diethylether leicht löslich, in Wasser sehr schwer (zu etwa 0,5 %), in Glycerin so gut wie gar nicht.
Nachweis
Der sichere Nachweis und die Quantifizierung von Piperonal wird nach adäquater Probenvorbereitung durch die Kopplung der Gaschromatographie mit der Massenspektrometrie ermöglicht.[12] Für den Nachweis des Piperonals in Vanilleschoten-Extrakten kommt auch die RP-HPLC zum Einsatz.[13]
Verwendung
Piperonal wird aufgrund des angenehmen Heliotropgeruches als Parfüm- und Kosmetikabestandteil sowie zum Aromatisieren von Seifen und Waschmitteln verwendet. In der Lebensmittelindustrie findet es als Aromastoff Verwendung.[14] Daneben ist es ein Ausgangsstoff in der Synthese von Tadalafil.[15] Auch manchen Tabakerzeugnissen wird es zugesetzt.[16]
Piperonal wird in Anhang I zum Übereinkommen der Vereinten Nationen gegen den unerlaubten Verkehr mit Suchtstoffen und psychotropen Stoffen von 1988 als Vorläuferstoff aufgeführt. Es wird in der illegalen Drogenproduktion für die Herstellung von MDA und MDMA benutzt.[17]
Rechtsstatus
Piperonal fällt unter die Kategorie 1 des Grundstoffüberwachungsgesetzes als direkter Vorläufer von Betäubungsmittel. Damit ist der Handel, Herstellung, die Ein- und Ausfuhr genehmigungs- und meldepflichtig.[18]
Einzelnachweise
- ↑ Eintrag zu HELIOTROPINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. Mai 2021.
- ↑ a b c d Eintrag zu Piperonal in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Eintrag Heliotropin bei thegoodscentscompany, abgerufen am 27. Januar 2018.
- ↑ a b c d e f Datenblatt Piperonal purum bei Sigma-Aldrich, abgerufen am 20. Oktober 2016 (PDF).
- ↑ PIPERONAL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 25. Juli 2023.
- ↑ Süddeutsche Zeitung: Schokolade, bittersüß, 20. Dezember 2013, abgerufen: 14. Januar 2014.
- ↑ Spiegel Online: Schokoladenstreit: Ritter Sport siegt gegen Stiftung Warentest, 13. Januar 2014, abgerufen: 13. Januar 2014.
- ↑ taz Online: Stiftung Warentest vs. Ritter Sport; Quadratisch, praktisch, erfolgreich, 13. Januar 2014, abgerufen: 13. Januar 2014.
- ↑ Aromaherstellung: Quadratisch, praktisch, unnatürlich? In: transkript 1-2 2014; S. 10.
- ↑ Klaus Roth: Quadratisch, praktisch, natürlich? Ritter‐Sport contra Stiftung Warentest. In: Chemie in unserer Zeit. Band 49, Nr. 5, 2015, S. 336–344, doi:10.1002/ciuz.201500722.
- ↑ ZEIT Online: Stiftung Warentest verliert endgültig gegen Ritter Sport, 9. September 2014, abgerufen: 9. September 2014.
- ↑ Stanfill SB, Ashley DL: Quantitation of flavor-related alkenylbenzenes in tobacco smoke particulate by selected ion monitoring gas chromatography-mass spectrometry., J Agric Food Chem. 2000 Apr;48(4):1298-306, PMID 10775389.
- ↑ Sinha AK, Verma SC, Sharma UK: Development and validation of an RP-HPLC method for quantitative determination of vanillin and related phenolic compounds in Vanilla planifolia. In: J Sep Sci. 2007 Jan;30(1):15-20, PMID 17313136.
- ↑ Schokolade: Tester bleiben bei Urteil für Ritter Sport. Stiftung Warentest, 25. November 2013, archiviert vom (nicht mehr online verfügbar) am 3. Dezember 2013; abgerufen am 26. November 2013.
- ↑ Gilla, G.; Anumula, R.R.; Aalla, S.; Vurimidi, H.; Ghanta, M.R.: Synthesis and characterization of related substances and metabolite of tadalafil, a PDE-5 inhibitor. Org Commun 2013; 6(1):12-22
- ↑ BMEL: Datenbank Tabakzusatzstoffe, abgerufen am 27. Januar 2018.
- ↑ Justin Cormick, James F. Carter, Timothy Currie, Carney Matheson, Sarah L. Cresswell: A survey of novel MDA and MDMA precursors by isotope ratio mass spectrometry. In: Forensic Chemistry. Band 24, 2021, S. 100341, doi:10.1016/j.forc.2021.100341.
- ↑ Verordnung (EU) Nr. 111/2005 zur Festlegung von Vorschriften für die Überwachung des Handels mit Drogenaustauschstoffen zwischen der Gemeinschaft und Drittländern, abgerufen am 23. Dezember 2024
Auf dieser Seite verwendete Medien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Struktur von Piperonal
Autor/Urheber: Michael Doss from Santa Ana, CA, USA, Lizenz: CC BY-SA 2.0
Vanilla planifolia




