Pinan (chemische Verbindung)
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Strukturformel ohne eindeutige Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Pinan | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C10H18 | ||||||||||||||||||
| Kurzbeschreibung | farblose Flüssigkeit[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 138,26 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | flüssig | ||||||||||||||||||
| Dichte | 0,86 g·cm−3[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | 168 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | nahezu unlöslich in Wasser[4] | ||||||||||||||||||
| Brechungsindex | 1,4624[5] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Pinan (Betonung auf der zweiten Silbe: Pinan) ist eine organisch-chemische Verbindung, die zur Gruppe der bicyclischen Kohlenwasserstoffe und der Monoterpene zählt. Es ist eine farblose, ölige Flüssigkeit mit charakteristischem, terpentinartigem Geruch.
Vorkommen
Neben anderen Kohlenwasserstoffen kommt Pinan in pflanzlichen Ölen vor, z. B. fand man einen Gehalt von bis zu 15,8 % Pinan in einem durch Wasserdampfdestillation aus der argentinischen Heilpflanze Mutisia friesiana gewonnenen Extrakt.[6]
Herstellung
Pinan kann durch katalytische Hydrierung mit Wasserstoff an Platin-, Palladium- oder Nickelkatalysatoren oder komplexer Eisenkatalysatoren[7] aus Pinen hergestellt werden. Dabei entsteht ein Gemisch aus exo- und endo-Pinan (auch cis- und trans-Pinan genannt), wobei ersteres im deutlichen Überschuss gebildet wird.
Wird bei der Verwendung komplexer Eisen(II)-Katalysatoren[7] als Ausgangssubstanz ein Gemisch aus α- und β-Pinen eingesetzt, so reagiert interessanterweise nur das β-Isomere.
Eigenschaften
Pinan ist ein Vertreter der Monoterpene, einer chemischen Substanzklasse von Kohlenwasserstoffen mit der Summenformel C10H18. Somit ist es auch ein Isomer vieler anderer Monoterpene, z. B. dem Camphan. Das Grundgerüst besteht aus einem Kohlenstoff-Sechsring (siehe: Cyclohexan) mit einer „Verbrückung“, die ein Kohlenstoffatom enthält. Dieses Gerüst trägt im Pinan noch drei Methylgruppen, davon zwei an der „Brücke“.
Stereoisomere
Durch die beschriebene Anordnung des Moleküls ist es chiral und enthält drei Chiralitätszentren. Theoretisch wären somit acht Stereoisomere möglich, da jedoch aus räumlichen Gründen die Konfigurationen der Verknüpfungsatome der „Brücke“ (1 und 5) voneinander abhängen, gibt es nur vier Stereoisomere.

Erläuterung zur Abbildung: In den Bildern ist die dem systematischen Namen des Pinans zugrundegelegte Nummerierung der Gerüstatome in schwarzen Ziffern notiert. Die beiden gelb unterlegten Pinane sind zueinander enantiomer (spiegelbildlich), dasselbe gilt für die beiden Strukturen auf weißem Bildhintergrund. Die oben im Text erwähnte „Brücke“ ist grün gekennzeichnet. Steht die Methylgruppe (an C-Atom 2) auf derselben Seite (blau) des 6-Rings wie die Brücke, so spricht man hier von einer cis- oder exo-Konfiguration. Steht die Methylgruppe auf der der Brücke abgewandten Seite (rot) des 6-Ringes, so liegt ein trans- oder endo-Pinan vor. Die Angaben (+) und (−) in den alternativen Bezeichnungen beziehen sich auf das Vorzeichen des Drehwerts der Verbindungen. Die Zahlenfolgen in eckigen Klammern sind die CAS-Registriernummern der reinen, einzelnen Stereoisomere.
Chemische Eigenschaften
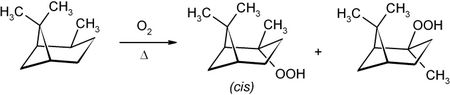
Als Kohlenwasserstoff ist Pinan gegenüber vielen milden Reaktionsbedingungen inert, jedoch kann es bei erhöhter Temperatur (ca. 100 °C) in Gegenwart von Sauerstoff zum Pinan-2-Hydroperoxid oxidiert werden, wobei über einen radikalischen Mechanismus sowohl aus dem cis- als auch aus dem trans-Pinan überwiegend das cis-Hydroperoxid gebildet wird.[8][9]
Verwendung
In der organischen Synthesechemie wird Pinan gelegentlich als Ausgangsmaterial für Synthesen von Stoffen mit Terpen-Grundgerüsten benutzt. Wenn bei der zuvor erwähnten Oxidation mit Sauerstoff von stereoisomerenreinem Pinan ausgegangen wird, kann das erhaltene Hydroperoxid als chirales Oxidationsmittel zur stereoselektiven Oxidation anderer Substanzen verwendet werden.
Einzelnachweise
- ↑ Eintrag zu TRIMETHYLBICYCLOHEPTANE in der CosIng-Datenbank der EU-Kommission, abgerufen am 17. September 2021.
- ↑ a b c d e f g Datenblatt Pinan bei Merck, abgerufen am 20. April 2011.
- ↑ Eintrag zu Pinan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. November 2014.
- ↑ Datenblatt Pinan bei Acros, abgerufen am 20. Februar 2010.
- ↑ R. T. O’Connor, L. A. Goldblatt: Correlation of Ultraviolet and Infrared Spectra of Terpene Hydrocarbons, in: Anal. Chem., 1954, 26, S. 1726–1737; doi:10.1021/ac60095a014.
- ↑ C. I. Viturro, J. De la Fuente: Proceedings of the 12th National Symposium of Organic Chemistry (XII SINAQO), Los Cocos, Cordoba, Argentina, 14-17 November 1999 In: Molecules, 2000, 5, S. 568–570 (PDF-Datei; 1,85 MB).
- ↑ a b T. P. Sieber: Entwicklung neuer homogener Eisenhydrierkatalysatoren mit Diazadien- oder Diazatrienliganden, Dissertation Zürich 2000, S. 103, 104 und 219 (PDF; 2,9 MB).
- ↑ G. S. Fisher, J. S. Stinson, L. A. Goldblatt, J. Am. Chem. Soc., 1953, 75, S. 3675–3678.
- ↑ G. A. Schmidt, G. S. Fisher, J. Am. Chem. Soc., 1959, 81, S. 445–448.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Catalytic hydrogenation of alpha-pinene
Formation of Pinanehydroperoxide by reaction of Pinane with oxygen
Struktur von Pinan
Stereoisomers of pinane
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances