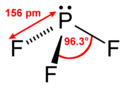Phosphor(III)-fluorid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Phosphor(III)-fluorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | PF3 | ||||||||||||||||||
| Kurzbeschreibung | farbloses Gas mit stechendem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 87,97 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | gasförmig | ||||||||||||||||||
| Dichte | 3,96 g·l−1 (0 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | −95,2 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | mit Wasser Hydrolyse[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | nicht festgelegt[1] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Phosphor(III)-fluorid ist ein giftiges, in geringen Konzentrationen geruchloses, farbloses Gas. In Wasser hydrolysiert es langsam, in Alkalien schnell zu Phosphonsäure bzw. Phosphonaten. Mit vielen Übergangsmetallen bildet es stabile Komplexe. In seinen Eigenschaften als Ligand ähnelt es dem Kohlenstoffmonoxid.
Gewinnung und Darstellung
Phosphortrifluorid wird gewöhnlich durch Halogenaustausch aus Phosphortrichlorid mittels Fluorwasserstoff, Arsen(III)-fluorid, Calciumfluorid oder Zinkfluorid hergestellt.
Eigenschaften
Physikalische Eigenschaften

Das Molekül ist trigonal-pyramidal gebaut und verfügt über einen P-F-Bindungswinkel von 96°. Die Phosphor-Fluor-Bindung ist 156 pm lang, die Bindungsenthalpie beträgt bei Standardbedingungen 499 kJ/mol. Komplexgebundenes Phosphor(III)-fluorid zeigt im Infrarotspektrum symmetrische und asymmetrische P-F-Streckschwingungen bei einer Wellenzahl von etwa 800 cm−1 und P-F-Kippschwingungen bei etwa 500 cm−1.[3] Das Phosphoratom gibt bei der Kernresonanzspektroskopie bei einer chemischen Verschiebung von 97 ppm ein Signal.
| thermodynamische Eigenschaften | |
| Eigenschaft | Wert |
|---|---|
| ΔfH0g | −919 kJ/mol |
| ΔfG0g | −898 kJ/mol |
| S0g | 273 J/(mol·K) |
| Cp0g | 59 J/(mol·K) |
| p | 3,4 · 10−30 C·m |
Chemische Eigenschaften
Phosphor(III)-fluorid hydrolysiert in Wasser langsam, in Alkalien schnell zu Phosphonsäure und Fluorwasserstoffsäure bzw. Phosphonaten und Fluoriden. Im Vergleich zu Phosphortrichlorid hydrolysiert Phosphortrifluorid aber langsamer. Phosphortrifluorid ist eine sehr schwache Lewis-Säure aber eine sehr starke Lewis-Base. Als solche bildet es mit vielen Lewis-Säuren stabile Komplexe.
Phosphor(III)-fluorid ist ein schwacher σ-Donator, aber ein starker π-Akzeptor.[4] Bei vielen Metallcarbonylen ist es in der Lage, den Kohlenstoffmonoxid-Liganden zum Teil oder ganz zu verdrängen und zu ersetzen.[5] Es bildet außerdem Komplexe wie Pd(PF3)4, deren Metallcarbonylanalogon nicht bekannt ist. Mit Nickelmetall reagiert es unter Bildung von Ni(PF3)4.[6]
Verwendung
Großtechnisch findet Phosphortrifluorid keine Verwendung, in der Forschung findet es aber in der organischen Synthese und zur Herstellung von Komplexen Verwendung.
Biologische Bedeutung
Phosphor(III)-fluorid ist für den Menschen stark giftig, da es wie Kohlenstoffmonoxid stark an Hämoglobin bindet und somit die Sauerstoffatmung verhindert.
Literatur
- CRC Handbook of Chemistry and Physics. 60th Edition. CRC Press, 1980.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- G.H. Aylward, T.J.V. Findlay: Datensammlung Chemie in SI-Einheiten. 3. Auflage. Wiley-VCH, 1999.
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu Phosphortrifluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- ↑ A. A. Williams: Phosphorous(III) fluoride. In: Therald Moeller (Hrsg.): Inorganic Syntheses. Band 5. McGraw-Hill, Inc., 1957, S. 95–97 (englisch).
- ↑ G. Blyholder, R. Sheets: Metal surface interaction with Pi-acceptor molecules: PF3 adsorption. In: Journal of Colloid and Interface Science. 46, 1974, S. 380–387, doi:10.1016/0021-9797(74)90047-2.
- ↑ Mariusz P. Mitoraj, Artur Michalak: σ-Donor and π-Acceptor Properties of Phosphorus Ligands: An Insight from the Natural Orbitals for Chemical Valence. In: Inorganic Chemistry. 49, 2010, S. 578–582, doi:10.1021/ic901736n.
- ↑ Ronald J. Clark: Phosphorus Trifluoride Substitution Compounds of Iron Pentacarbonyl. In: Inorganic Chemistry. 3, 1964, S. 1395–1398, doi:10.1021/ic50020a011.
- ↑ Geoffrey Wilkinson: The Preparation and Properties of Tetrakistribromophosphine Nickel and Tetrakistrifluorophosphine Nickel. In: Journal of the American Chemical Society. 73, 1951, S. 5501–5502, doi:10.1021/ja01155a566.
Auf dieser Seite verwendete Medien
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Phosphor(III)-fluorid; Phosphortrifluorid; Trifluorphosphan
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for gases under pressure