Phenylephrin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
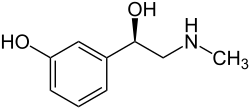 | ||||||||||||||||||||||
| Strukturformel von (R)-Phenylephrin | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Phenylephrin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C9H13NO2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 167,21 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt |
| |||||||||||||||||||||
| pKS-Wert | 8,9; 10,1[1] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Phenylephrin gehört zu den direkt wirkenden Sympathomimetika mit teilweise indirekter Wirkung. Es wirkt als Agonist am α1-Adrenozeptor. Phenylephrin ist bis auf eine fehlende 4-Hydroxygruppe strukturgleich mit Adrenalin und wird in Europa hauptsächlich als lokaler Vasokonstriktor verwendet, z. B. als Wirkstoff von Nasentropfen zum Abschwellen der Schleimhäute im Naseninneren. In Augentropfen wirkt es als Mydriatikum, führt also zu einer Weitstellung der Pupillen. International wird Phenylephrin – u. a. im Rahmen der Geburtshilfe – auch als Vasopressor verwendet.[4][5] In Medikamenten wird das Hydrochlorid und das Tartrat verwendet.[1] Die Wirkung ist am ehesten mit der von Noradrenalin vergleichbar.
Pharmakokinetik
Nach Gabe von Tritium-markiertem (3H-Phenylephrin), per Infusion oder oral bei Menschen, ergab eine Analyse mittels Ionenaustausch- und Dünnschichtchromatographie eine Ausscheidung von 86 (i.v.) bzw. 80 (p.o.) Prozent der verabreichten Aktivität im Urin; womit eine vollständige enterale Aufnahme angenommen wird. Der Unterschied in der Menge des freien 3H-Phenylephrin im Serum von 16 % der verabreichten Menge bei der intravenösen Applikation gegenüber 2,6 % bei der oralen lässt auf eine verminderte Bioverfügbarkeit der Substanz schließen. Die biologische Halbwertszeit von zwei bis drei Stunden, wie auch die Clearance von 2 L/h, ist mit strukturell verwandten Aminen vergleichbar.
Die Verstoffwechslung zu phenolischen Konjugaten nach oraler Aufnahme bzw. m-Hydroxymandelsäure nach intravenöser Injektion zeigen, dass m-hydroxylierte Amine im first-pass-Metabolismus vorwiegend konjugiert werden.[6]
Eine Studie des Herstellers Schering-Plough bestätigte die langjährige Annahme von Personen in der Pharmakologie, dass der Wirkstoff, wenn er über den Mund aufgenommen wird, daher nicht wirksam ist.[7] Dennoch werden die entsprechenden Produkte weiterhin hergestellt und verkauft. Im November 2024 schlug die Food and Drug Administration (FDA) vor, Phenylephrin zum Schlucken aus freiverkäuflichen Produkten zu entfernen und eröffnete dazu eine entsprechende Vernehmlassung.[8]
Handelsnamen
- Nasenspray für Kinder (CH)
- Neosynephrin (A, D)
- Rexophtal N UD (CH)
- Thalia (A)
- Vibrocil (A, CH)
- Visadron (D, A)
- Metaoxedrin (DK)
- Mesatonum
- Biorphen (A)
Weblinks
- 3D-Struktur von Phenylephrin. Wikimedia Commons
- Eintrag zu Phenylephrin bei Vetpharm, abgerufen am 11. August 2012.
Einzelnachweise
- ↑ a b c d e Eintrag zu Phenylephrin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 23. Juli 2019.
- ↑ a b Datenblatt (R)-(−)-Phenylephrine hydrochloride bei Sigma-Aldrich, abgerufen am 19. April 2011 (PDF).
- ↑ Eintrag Phenylephrine beim Europäisches Direktorat für die Qualität von Arzneimitteln (EDQM), abgerufen am 21. Juni 2008.
- ↑ D. W. Cooper, P. Mowbray: Advantages of using a prophylactic phenylephrine infusion during spinal anaesthesia for caesarean section. In: International Journal of Obstetric Anesthesia, Band 13, Nr. 2, 2004, S. 124–125, PMID 15321421, doi:10.1016/j.ijoa.2003.11.001.
- ↑ W. D. Ngan Kee, K. S. Khaw, F. F. Ng: Comparison of phenylephrine infusion regimens for maintaining maternal blood pressure during spinal anaesthesia for Caesarean section. In: British Journal of Anaesthesia, Band 92, Nr. 4, April 2004, S. 469–474, PMID 14977792, doi:10.1093/bja/aeh088.
- ↑ J. H. Hengstmann, J. Goronzy: Pharmacokinetics of 3H-phenylephrine in man. In: European Journal of Clinical Pharmacology, Band 21, Nr. 4, 1982, S. 335–341, PMID 7056280, doi:10.1007/BF00637623.
- ↑ We’ve Known for 20 Years This Cold Medicine Doesn’t Work Artikel in der New York Times vom 29. September 2023. Abgerufen am 30. September 2023.
- ↑ Martina Frei: US-Behörde will unwirksame Mittel streichen: Eine Première! In: Infosperber. 27. April 2025, abgerufen am 29. April 2025.
Auf dieser Seite verwendete Medien
Strukturformel von Phenylephrin
