Phenolphthalein
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Phenolphthalein | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C20H14O4 | |||||||||||||||||||||
| Kurzbeschreibung | weißer bis blassgelber, kristalliner, geschmacks- und geruchsfreier Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | A06AB04 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 318,31 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest[1] | |||||||||||||||||||||
| Dichte | 1,30 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert | 9,7 (25 °C)[3] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Zulassungsverfahren unter REACH | besonders besorgniserregend: krebserzeugend (CMR)[5] | |||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Phenolphthalein ist einer der bekanntesten pH-Indikatoren und wurde erstmals 1871 von Adolf von Baeyer dargestellt.[7] Der Name setzt sich aus Phenol und Phthalsäureanhydrid zusammen. Phenolphthalein ist ein Triphenylmethinfarbstoff (veraltete Bezeichnung Triphenylmethanfarbstoff) und bildet die Basisverbindung der Familie der Phthaleine. Das entsprechende Sulfonphthalein ist das Phenolrot.
Bei einem pH-Wert von kleiner als 0 ist eine wässrige Phenolphthalein-Lösung rot-orange, bei einem pH-Wert von 0 bis etwa 8,2 farblos. Bei höherem pH-Wert färbt die Lösung sich rosa-violett, wobei sie bei einem pH-Wert von etwa 13 wieder farblos wird.
Darstellung
In einer Friedel-Crafts-Acylierung werden zwei Äquivalente Phenol und ein Äquivalent Phthalsäureanhydrid in Gegenwart geringer Mengen konzentrierter Schwefelsäure oder Zinkchlorid umgesetzt:

Eigenschaften
Phenolphthalein ist ein weißes kristallines Pulver und in Wasser praktisch nicht löslich. Es findet meist in 1%iger alkoholischer Lösung Verwendung. Es ist selbst eine schwache Säure.
Phenolphthalein besitzt einen pKs-Wert von 9,7. Wenn man den Umschlagsbereich festlegt bei einem Indikatorsäure/-base-Verhältnis von 1:10 bis 10:1, erhält man nach der Henderson-Hasselbalch-Gleichung einen Umschlagbereich von pH = pKs ± 1 (8,7 bis 10,7). Bei einem pH-Wert von kleiner als 0 ist eine wässrige Phenolphthalein-Lösung rot-orange, bei einem pH-Wert von 0 bis etwa 8,2 farblos, bei höherem pH-Wert färbt die Lösung sich rosa-violett, im stark alkalischen Bereich – bei einem pH-Wert nahe 13 –, wird sie wieder farblos. Es ist daher beispielsweise bei der Titration basischer Lösungen gut als Indikator geeignet.
Struktur und Farbumschlag
In Abhängigkeit vom pH-Wert der Lösung ändert das Phenolphthalein seine Struktur und damit seine Farbe.
| Spezies | H3In+ | H2In | In2− | In(OH)3− |
|---|---|---|---|---|
| Struktur | 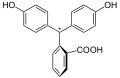 |  |  |  |
| pH | < 0 | 0 bis 8,2 | 8,2 bis 12,0 | > 12,0 |
| Farbe | rot | farblos | rosa-violett | farblos |
 |  |

Im pH-Bereich bis etwa 7,5 liegt es in seiner farblosen, ungeladenen Grundform vor (H2In 1). In stärker basischer Lösung werden die Protonen an den beiden Hydroxygruppen abgespalten. In einer resultierenden mesomeren Grenzstruktur ist ein chinoides System als Chromophor vorhanden (In2− 2). Das ist die farbige Struktur des Indikators. In sehr stark basischer Umgebung lagert sich am zentralen Kohlenstoffatom eine OH-Gruppe an, wodurch das Erreichen der Chromophorstruktur unmöglich wird (In(OH)3− 3). In stark saurer Lösung wird Phenolphthalein wieder farbig. Der Lactonring wird durch das H+ gespalten. Dabei bildet sich eine positive Ladung am zentralen Kohlenstoffatom, das damit sp2-hybridisiert ist und somit wieder durch die mesomere Grenzform stabilisiert wird (4).

Betrachtet man die Reaktionsgleichung der Reaktion (A) nach (B), so wird anhand des Massenwirkungsgesetzes deutlich, warum der Farbumschlag so schnell erfolgt:
Es gilt (Ks konstant, wobei die quasi konstante Konzentration des Wassers in Ks einbezogen ist):
Die Konzentration der H3O+-Ionen liegt in einer anderen Größenordnung. Für saure Lösungen ist sie hoch, das Gleichgewicht liegt auf der Seite von (A). Sobald aber die Konzentration von H3O+ sehr klein wird beziehungsweise die Konzentration von OH− groß wird, muss sich wegen der Konstanz des Terms die Konzentration von (B) massiv erhöhen. Weil (B) aus (A) entsteht, wird die Konzentration von (A) extrem viel kleiner – der Farbumschlag erfolgt sehr schnell.
Weitere Verwendung
Zum zuverlässigen qualitativen und quantitativen Nachweis von Phenolphthalein bei forensischen Fragestellungen kommt die Kopplung der HPLC mit der Massenspektrometrie zum Einsatz. Die Nachweisgrenze für dieses Verfahren wird mit 1,66 pg/L angegeben und kommt unter anderem auch zum Einsatz, um die Substanz auch in angeblich rein pflanzlichen Schlankheitsmitteln zu identifizieren.[8]
Reduziertes Phenolphthalein wird im Kastle-Meyer-Test zum Nachweis von Blutspuren in der Forensik verwendet.
Bis zur Entdeckung einer möglicherweise karzinogenen Wirkung wurde Phenolphthalein mehr als hundert Jahre lang als Abführmittel verwendet. Die kleinen Mengen, die beim Einsatz als Indikator verwendet werden, sind jedoch nicht gefährlich. Im Bauwesen wird Phenolphthalein-Lösung zur Visualisierung der Carbonatisierungstiefe an Beton und zur Feststellung der Überarbeitbarkeit von neu verputzten Flächen (Fläche mit einem pH-Wert von kleiner 8,5) verwendet.
Die ersten Röntgenuntersuchungen der Gallenblase wurden mit dem 1922 von dem in Chemie ausgebildeten Chirurgen Evarts A. Graham und Warren H. Cole eingeführten, relativ toxischen Tetraiod-Phenolphthalein durchgeführt.[9]
Weblinks
Einzelnachweise
- ↑ a b c Eintrag zu Phenolphthalein. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. November 2014.
- ↑ a b c d e Eintrag zu Phenolphthalein in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ O’Neil, M.J. (ed.). The Merck Index - An Encyclopedia of Chemicals, Drugs, and Biologicals. 13th Edition, Whitehouse Station, NJ: Merck and Co., Inc., 2001., S. 1300.
- ↑ Eintrag zu Phenolphthalein in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 16. Juli 2014.
- ↑ National Academy of Sciences, National Research Council, Chemical-Biological Coordination Center, Review. 5(25), 1953.
- ↑ The New Encyclopæedia Britannica; Micropæedia Vol. VII; 15th Ed.; Encyclopedia Britannica, Inc. (1974).
- ↑ K. Sharma, S. P. Sharma, S. C. Lahiri: Detection and quantitation of trace phenolphthalein (in pharmaceutical preparations and in forensic exhibits) by liquid chromatography-tandem mass spectrometry, a sensitive and accurate method. In: J Forensic Sci. 58 Suppl 1, Jan 2013, S. S208–S214. PMID 23106487.
- ↑ Günter Skibbe: Gallenblase und Gallengänge. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 72–88, hier: S. 82.
Auf dieser Seite verwendete Medien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Autor/Urheber: DiplomBastler alias Torge Anders, Lizenz: CC BY-SA 3.0
Bild zur Prüfung der Farbdarstellung (Gammakorrektur der Farbkanäle) des Anzeigegeräts ("Bildschirm"). Eine Beschreibung, wie man das Bild verwendet, ist Hilfe:Farbdarstellung. Eine Beschreibung der Wirkungsweise des Bildes findet sich hier. Es existiert auch eine vektorisierte Version des Bildes, die jedoch, wie *alle* Vektorformate, *nicht* zur Kalibrierung geeignet ist. Näheres dazu siehe Vorlage_Diskussion:Hinweis_Farbdarstellung#Vektorgrafik_kann_hier_nicht_funktionieren. Bitte daher diese Raster-Version hier nicht durch eine Vektor-Version ersetzen.
Struktur von Phenolphthalein
A beaker containing a solution of phenolphthalein in concentrated sulfuric acid
Phenolphthalein in alkaline solution (pH 9), exhibiting a pink colour
indicator reactions of phenolphthaleine at different pH values
Formel von Phenolphthalein bei sehr niedrigem pH
Autor/Urheber: Felixgrünwald, Lizenz: CC BY-SA 3.0
Synthese von Phenolphthalein
Autor/Urheber: TobiasTannast, Lizenz: CC BY-SA 4.0
pH-Orgel von Phenolphthalein von pH -1 bis pH 15














