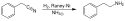Phenethylamin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Phenethylamin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C8H11N | |||||||||||||||||||||
| Kurzbeschreibung | farblose Flüssigkeit mit aminartigem Geruch[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 121,18 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | flüssig | |||||||||||||||||||||
| Dichte | 0,96 g·cm−3 (20 °C)[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | 200–202 °C[1] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit | schlecht in Wasser (4,3 g·l−1 bei 20 °C)[1] | |||||||||||||||||||||
| Brechungsindex | 1,5290 (25 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | 200 mg·kg−1 (LD50, Meerschweinchen, oral)[3] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Phenethylamin (auch β-Phenylethylamin (PEA) oder mit korrekter chemischer Bezeichnung 2-Phenylethylamin) ist ein Spurenamin. Es ist die Stammsubstanz der Stoffgruppe der Phenylethylamine und als Vorläufer der Benzylisochinolin-Alkaloide in Pflanzen weit verbreitet.
Vorkommen
Phenethylamin kommt im Bittermandelöl und in Kakaobohnen vor und wurde auch im Gehirn und im Harn nachgewiesen. Das biogene Amin Phenethylamin als Stammsubstanz der Katecholamine und vieler psychedelisch wirksamer Halluzinogene wird mit dem Entstehen von Lust- und Glücksempfindungen in Verbindung gebracht.[4]
Gewinnung und Darstellung
Phenethylamin ist eine natürliche Verbindung, die durch enzymatische Decarboxylierung aus der Aminosäure Phenylalanin biosynthetisiert wird.[4]
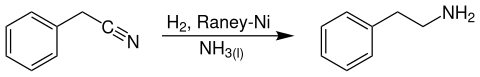
Technisch ist die Verbindung unter anderem durch katalytische Hydrierung von Benzylcyanid bei Temperaturen von 130 °C und Drücken von 140 bar an Raney-Nickel-Katalysatoren in flüssigem Ammoniak zugänglich.[5]
In einer weiteren möglichen Synthesevariante wird Benzaldehyd mit Nitromethan im Rahmen einer Henry-Reaktion zum Nitrostyrol kondensiert. Nach dessen Reduktion (Hydrierung) erhält man Phenethylamin.[4]
Chemie
Strukturbetrachtung
Homologe: Das nächsthöhere Seitenketten-Homologe ist das Amphetamin (-β-ethyl versus -isopropyl), weitere Homologe sind bekannt. Meskalin ist ein Beispiel für ein Phenylkern-Derivat (3,4,5-Trimethoxy-substituiert). Gleichzeitig Kern- und Seitenketten-substituiert ist beispielsweise das Noradrenalin. Zusammengefasst werden diese vielfältigen Strukturvarianten in der Stoffgruppe der Phenylethylamine dargestellt.
Wirkung
Oral aufgenommenes PEA hat bei Menschen erst in sehr hohen Dosen oder mit einem MAO-B-Inhibitor eine psychoaktive Wirkung. Sogar in Dosen von 1600 mg oral oder nasal und 50 mg intravenös zeigt sich kein Effekt.[6] Der Grund dafür mag darin liegen, dass PEA im menschlichen und tierischen Körper schnell abgebaut wird.[7] Die biologische Halbwertszeit bei oraler Aufnahme liegt bei fünf bis zehn Minuten.[8] Im Hirn hat Phenethylamin eine Halbwertszeit von etwa 30 Sekunden.[9] Im Menschen wird Phenethylamin durch die Phenylethanolamin-N-Methyltransferase (PNMT),[9][10] die Monoaminooxidase A (MAO-A),[11] die Monoaminooxidase B (MAO-B),[12] die Semicarbazid-sensitive Aminoxidasen (SSAOs),[13] die Flavin-enthaltende Monooxygenase 3 (FMO3),[14] und die Aralkylamin-N-acetyltransferase (AANAT, EC 2.3.1.87) verstoffwechselt.[15]
Patienten, die (zur Behandlung einer Depression oder eines Morbus Parkinson) einen Monoaminooxidase-Hemmer nehmen, sollten die Aufnahme von PEA meiden, da dies zu einem starken Blutdruckanstieg und Kopfschmerzen führen kann.[16]
Biologische Bedeutung
Einer Untersuchung des Departments of Cell Biology and Neurobiology an der Harvard Medical School[17] zufolge enthält der Urin einiger Raubsäuger erhöhte Mengen von Phenethylamin. Bestimmte Beutetiere (hier: Mäuse und Ratten) nehmen die Substanz olfaktorisch wahr und meiden mit Raubsäugerurin kontaminierte Bereiche.
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu Phenethylamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-34.
- ↑ National Technical Information Service, OTS0555348
- ↑ a b c Eintrag zu Phenethylamine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Juli 2019.
- ↑ J. C. Robinson Jr., H. R. Snyder: β-Phenylethylamin In: Organic Syntheses. 23, 1943, S. 71, doi:10.15227/orgsyn.023.0071 (PDF).
- ↑ Alexander Shulgin, Ann Shulgin: PIHKAL – A Chemical Love Story. Transform Press, ISBN 0-9630096-0-5, S. 815ff
- ↑ O. Suzuki, Y. Katsumata, M. Oya: Oxidation of beta-phenylethylamine by both types of monoamine oxidase: examination of enzymes in brain and liver mitochondria of eight species. In: Journal of neurochemistry Band 36, Nummer 3, März 1981, S. 1298–1301, PMID 7205271.
- ↑ H. E. Shannon, E. J. Cone, D. Yousefnejad: Physiologic effects and plasma kinetics of beta-phenylethylamine and its N-methyl homolog in the dog. In: The Journal of pharmacology and experimental therapeutics. Band 223, Nummer 1, Oktober 1982, S. 190–196, PMID 7120117.
- ↑ a b Lindemann L, Hoener MC: A renaissance in trace amines inspired by a novel GPCR family. In: Trends Pharmacol. Sci. 26. Jahrgang, Nr. 5, 2005, S. 274–281, doi:10.1016/j.tips.2005.03.007, PMID 15860375 (englisch).
- ↑ Robert G. Pendleton, George Gessner, John Sawyer: Studies on lung N-methyltransferases, a pharmacological approach. In: Naunyn-Schmiedeberg’s Archives of Pharmacology. 313. Jahrgang, Nr. 3, 1980, S. 263–8, doi:10.1007/BF00505743, PMID 7432557 (englisch).
- ↑ Suzuki O, Katsumata Y, Oya M: Oxidation of beta-phenylethylamine by both types of monoamine oxidase: examination of enzymes in brain and liver mitochondria of eight species. In: J. Neurochem. 36. Jahrgang, Nr. 3, 1981, S. 1298–301, doi:10.1111/j.1471-4159.1981.tb01734.x, PMID 7205271 (englisch).
- ↑ HY Yang, NH Neff: Beta-phenylethylamine: A specific substrate for type B monoamine oxidase of brain. In: The Journal of Pharmacology and Experimental Therapeutics. 187. Jahrgang, Nr. 2, 1973, S. 365–71, PMID 4748552 (englisch).
- ↑ S. Kaitaniemi, H. Elovaara, K. Grön, H. Kidron, J. Liukkonen, T. Salminen, M. Salmi, S. Jalkanen, K. Elima: The unique substrate specificity of human AOC2, a semicarbazide-sensitive amine oxidase. In: Cell. Mol. Life Sci. 66. Jahrgang, Nr. 16, 2009, S. 2743–2757, doi:10.1007/s00018-009-0076-5, PMID 19588076 (englisch): “The preferred in vitro substrates of AOC2 were found to be 2-phenylethylamine, tryptamine and p-tyramine instead of methylamine and benzylamine, the favored substrates of AOC3.”
- ↑ Krueger SK, Williams DE, Williams: Mammalian flavin-containing monooxygenases: structure/function, genetic polymorphisms and role in drug metabolism. In: Pharmacol. Ther. 106. Jahrgang, Nr. 3, Juni 2005, S. 357–387, doi:10.1016/j.pharmthera.2005.01.001, PMID 15922018, PMC 1828602 (freier Volltext) – (englisch): “The biogenic amines, phenethylamine and tyramine, are N-oxygenated by FMO to produce the N-hydroxy metabolite, followed by a rapid second oxygenation to produce the trans-oximes (Lin & Cashman, 1997a, 1997b). This stereoselective N-oxygenation to the trans-oxime is also seen in the FMO-dependent N-oxygenation of amphetamine (Cashman et al., 1999) … Interestingly, FMO2, which very efficiently N-oxygenates N-dodecylamine, is a poor catalyst of phenethylamine N-oxygenation. The most efficient human FMO in phenethylamine N-oxygenation is FMO3, the major FMO present in adult human liver; the Km is between 90 and 200 μM (Lin & Cashman, 1997b).”
- ↑ EC 2.3.1.87 – aralkylamine N-acetyltransferase. In: BRENDA. Technische Universität Braunschweig, Juli 2014, abgerufen am 10. November 2014 (englisch).
- ↑ Fachinformation von Jatrosom (Tranylcypromin), Stand März 2005.
- ↑ David M. Ferrero, Jamie K. Lemon, Daniela Fluegge, Stan L. Pashkovski, Wayne J. Korzan, Sandeep Robert Datta, Marc Spehr, Markus Fendt, and Stephen D. Liberles: Detection and avoidance of a carnivore odor by prey In: Proceedings of the National Academy of Sciences PNAS July 5, 2011 Vol. 108 No. 27 11235–11240.
Auf dieser Seite verwendete Medien
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Synthese von Phenethylamin durch katalytische Hydrierung von Benzylcyanid über Raney-Nickel in flüssigem Ammoniak
Struktur von Phenethylamin