Phenanthren
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Phenanthren | |||||||||||||||||||||
| Andere Namen | Tricyclo[8.4.0.02,7]tetradeca-1,3,5,7,9,11,13-heptaen | |||||||||||||||||||||
| Summenformel | C14H10 | |||||||||||||||||||||
| Kurzbeschreibung | farblose Tafeln oder Blättchen[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 178,23 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest[1] | |||||||||||||||||||||
| Dichte | 1,18 g·cm−3 (25 °C)[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | 340 °C[1] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Zulassungsverfahren unter REACH | besonders besorgniserregend: sehr persistent und sehr bioakkumulativ (vPvB)[5] | |||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Phenanthren (zusammengesetzt aus Phenyl und Anthracen) ist ein farbloser bis gelblicher, kristalliner Feststoff. Es ist ein polycyclischer aromatischer Kohlenwasserstoff, enthält drei anellierte Benzolringe und gehört zur Stoffgruppe der Phene. Der aromatische Charakter ist im Vergleich zum isomeren Anthracen etwas stärker ausgeprägt, was sich an einer höheren Delokalisierungsenergie von 387 kJ/mol im Vergleich zu 351,5 kJ/mol für Anthracen zeigt.[6] Phenanthren findet sich in der Fraktion des Anthracens im Steinkohlenteer, woraus es im Wesentlichen gewonnen wird. Ein Derivat des Phenanthren, das Steran, ist Grundgerüst für die Steroide. Phenanthren wird für die Synthese von Farbstoffen verwendet.
Vorkommen
Natürlich kommt Phenanthren in Form des sehr seltenen Minerals Ravatit vor.[7]
Geschichte
Die Verbindung wurde erstmals 1873 unabhängig voneinander durch die deutschen Chemiker Rudolph Fittig und Eugen Ostermeyer sowie von Carl Graebe aus dem Steinkohlenteer gewonnen.[8][9] Eine erste Synthese wurde 1896 durch den deutschen Chemiker Robert Pschorr beschrieben. Bei der Pschorrschen Phenanthrensynthese werden Nitrobenzaldehyd und Phenylessigsäure umgesetzt.[10][11]
Synthese
Eine Synthese von Phenanthren wurde 1932 vom englischen Chemiker Robert Downs Haworth (1898–1990) vorgestellt und ist demnach auch als Haworth-Synthese bekannt.[12]
Die nachfolgenden Syntheseschritte werden in der Literatur[13][14] beschrieben:

Im ersten Schritt wird Naphthalin 1 mittels Friedel-Crafts-Acylierung durch Bernsteinsäureanhydrid 2 acyliert. Die dabei entstehende Ketosäure 3 wird anschließend durch eine Clemmensen-Reduktion mit Zinkamalgam und Salzsäure reduziert, sodass das Naphthalin-Derivat 4 gebildet wird. Durch Zugabe von Schwefelsäure kommt es dann zur Abspaltung von Wasser. Durch darauffolgende interne Elektronenumlagerungen, die zur Abspaltung eines Protons führen, entsteht das Keton 5. Dann folgt eine weitere Clemmensen-Reduktion, wobei der Kohlenwasserstoff 6 gebildet wird. Die Dehydrierung mit Selen im letzten Schritt liefert Phenanthren 7.
Eigenschaften
Mesomerie und Aromatizität
Phenanthren besitzt aufgrund des relativ großen delokalisierten Elektronensystems einen ausgeprägten aromatischen Charakter. Folglich lassen sich fünf gleichwertige mesomere Grenzstrukturen formulieren:

Physikalische Eigenschaften
Die farblosen bis gelblichen Kristalle sind geruchlos und fluoreszieren, wenn sie in Benzol gelöst werden. Hochreines Phenanthren schmilzt bei 98,5 °C.[2] Die Schmelzenthalpie beträgt 18,13 kJ/mol.[2] Bei 72,8 °C wird ein Phasenübergang höherer Ordnung beobachtet, wobei eine polymorphe Umwandlung einer Tieftemperatur- in eine Hochtemperaturkristallform stattfindet.[2][15] Der Siedepunkt liegt bei 340 °C.[1] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,51922, B = 2428,448 und C = −70.96 im Temperaturbereich von 373 K bis 423 K[16] bzw. mit A = 4,68940, B = 2673,320 und C = −40.7 im Temperaturbereich von 477 K bis 620 K.[17] In Wasser ist Phenanthren nahezu unlöslich (0,0011 g/l), in Tetrachlorkohlenstoff, Ether, Benzol, Toluol sowie weiteren unpolaren organischen Lösungsmitteln ist es gut löslich.
Der Flammpunkt der Schmelze beträgt 171 °C.[1] Die Zündtemperatur liegt oberhalb von 450 °C.[1]
Chemische Eigenschaften
Das chemische Verhalten ist durch die besondere Reaktivität in der 9- und 10-Stellung geprägt. So führt die Bromierung zum 9,10-Dibrom-9,10-dihydrophenanthren. Beim Erhitzen dieser Verbindung wird unter HBr-Abspaltung mit 9-Bromphenanthren wieder ein aromatisches System gebildet.[6]

Eine Reduktion mit Lithium führt zum 9,10-Dihydrophenanthren.[18] Die Oxidation mit Chrom-VI-oxid ergibt 9,10-Phenanthrenchinon.[6] Eine Nitrierung[19] oder Sulfonierung[20] erfolgt ebenfalls in der 9-Position.
Kommerziell erhältliches Phenanthren enthält Anthracen-Verunreinigungen. Durch eine photochemische Reaktion von Anthracen mit N,N-Dimethylanilin gelingt es, hochreines (99,8 %) Phenanthren zu erhalten. Bei dieser Reaktion bildet sich 9-(4-Dimethylaminophenyl)-9,10-dihydroanthracen, das durch Salzsäure entfernt wird.[21]
Nomenklatur
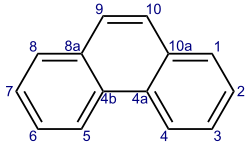
Nach der IUPAC-Nomenklatur gibt es für Phenanthren, wie auch für das isomere Anthracen, einen speziellen Lokantensatz, der von der systematischen Bezifferung abweicht.[22] Dieser Lokantensatz wird teilweise auch auf heterocyclische Verbindungen mit derselben Grundstruktur (bei denen lediglich Kohlenstoffatome durch andere Atome ersetzt sind) übertragen.
- Lokanten von Phenanthren gemäß IUPAC
- Lokanten von Tricyclo[8.4.0.02,7]tetradeca-1,3,5,7,9,11,13-heptaen
gemäß der Von-Baeyer-Nomenklatur
Nach der Von-Baeyer-Nomenklatur für polycyclische Verbindungen, die allerdings für aromatische Verbindungen nicht empfohlen wird,[23] wird Phenanthren als Tricyclo[8.4.0.02,7]tetradeca-1,3,5,7,9,11,13-heptaen bezeichnet.
Gefahren und Metabolismus
Phenanthren reizt die Augen und Haut, es ist wassergefährdend (WGK 3).[1] Im Körper wird Phenanthren zu Naphthalin-1,2-diol oxidiert.
Einzelnachweise
- ↑ a b c d e f g h i j k Eintrag zu Phenanthren in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ a b c d U. Gloistein, M. Epple, H. K. Cammenga: Influencing the Solid-Solid Phase Transition in Phenanthrene by Suitable Doping. In: Zeitschrift für Physikalische Chemie. 214, München, Deutschland, 2000, S. 379–388.
- ↑ a b Datenblatt Phenanthren bei Merck, abgerufen am 5. September 2016.
- ↑ Eintrag zu Phenanthren. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. Dezember 2014.
- ↑ Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 21. Januar 2019.
- ↑ a b c Hauptmann, Graefe, Remane: Lehrbuch der Organischen Chemie. 2. Auflage, Deutscher Verlag der Grundstoffindustrie, Leipzig 1980, S. 268.
- ↑ L. Nasdala, I.V. Pekov: Ravatite, C14H10, a new organic mineral species from Ravat, Tadzhikistan. In: European Journal of Mineralogy. 5, 1993, S. 699–705; Abstract In: New Mineral Names. (PDF; 611 kB), In: American Mineralogist. 1994, 79, S. 389.
- ↑ R. Fittig, E. Ostermayer: Über das Phenanthren, einen neuen Kohlenwasserstoff im Steinkohlentheer in Ann. Chemie Pharm. 166 (1873) 127.
- ↑ C. Graebe: Ueber Phenanthren in Ann. Chemie Pharm. 167 (1873) 131–166.
- ↑ R. Pschorr: Neue Synthese des Phenanthrens und seiner Derivate in Ber. Deutsch. Chem. Ges. 29 (1896) 496–501.
- ↑ Rolf Werner Soukup: Chemiegeschichtliche Daten organischer Substanzen, Version 2020, S. 126 pdf.
- ↑ R. D. Haworth: Syntheses of alkylphenanthrenes, Part I. 1-, 2-, 3-, and 4-Methylphenanthrenes In: Journal of the Chemical Society (1932), S. 1125–1132, doi:10.1039/JR9320001125.
- ↑ Eberhard Breitmaier und Günther Jung: Organische Chemie, Georg Thieme, 2012, ISBN 9783135415079, S. 183.
- ↑ Zerong Wang: Comprehensive Organic Name Reactions and Reagents, Wiley, 2010, ISBN 9780470638859, S. 1342–1343, doi:10.1002/9780470638859.
- ↑ J. Kroupa, J. Fousek, N. R. Ivanov, B. Brezina, V. Lhotska: In: Ferroelectrics. 79, 1988, S. 189.
- ↑ A. G. Osborn, D. R. Douslin: Vapor Pressures and Derived Enthalpies of Vaporization for Some Condensed–Ring Hydrocarbons. In: Journal of Chemical & Engineering Data. 20, 1975, S. 229–231.
- ↑ F. S. Mortimer, R. V. Murphy: The Vapor Pressures of Some Substances Found in Coal Tar. In: Journal of Industrial and Engineering Chemistry. 15, 1923, S. 1140–1142.
- ↑ C. G. Screttas, G. I. Ioannou, M. Micha-Screttas: In: Journal of Organometallic Chemistry. 511, 1996, S. 217–226.
- ↑ J. Schmidt: In: Chemische Berichte. 44, 1911, S. 1491, 1498.
- ↑ Sandqvist: Justus Liebigs Annalen der Chemie. 392, 1912, S. 77.
- ↑ Dieter Wöhrle, Michael W. Tausch, Wolf-Dieter Stohrer: Photochemie: Konzepte, Methoden, Experimente. John Wiley & Sons, 1998, ISBN 978-3-527-29545-6.
- ↑ IUPAC Nomenclature of Organic Chemistry: Rule A-22.5 (siehe Beispiele).
- ↑ Dieter Hellwinkel: Die systematische Nomenklatur der Organischen Chemie: Eine Gebrauchsanweisung. 4. Auflage. Springer-Verlag, Berlin, Heidelberg 1998, ISBN 978-3-540-63221-4, S. 31 (eingeschränkte Vorschau in der Google-Buchsuche).
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Autor/Urheber: NadirSH, Lizenz: CC BY-SA 4.0
numbering of Phenanthrene acc. to the Von Baeyer nomenclature
Resonanzformeln von Phenanthren (mesomere Grenzstrukturen)
Struktur von Phenanthren
Autor/Urheber: Hbf878, Lizenz: CC0
Numbering of carbon atoms in Phenanthrene, according to IUPAC recommendations 1979, rule A-22.5.
Bromierung von Phenanthren
Autor/Urheber: RoMiaEv, Lizenz: CC BY-SA 4.0
Die einzelnen Syntheseschritte von Phenanthren


![Lokanten von Tricyclo[8.4.0.02,7]tetradeca-1,3,5,7,9,11,13-heptaen gemäß der Von-Baeyer-Nomenklatur](http://upload.wikimedia.org/wikipedia/commons/thumb/d/da/Phenanthrene-numbering_%28Von_Baeyer_nomenclature%29.svg/250px-Phenanthrene-numbering_%28Von_Baeyer_nomenclature%29.svg.png)






