Dialyse
| Klassifikation nach ICD-10 | |
|---|---|
| Z49.1 | Dialyse bei Niereninsuffizienz |
| Z49.2 | peritoneale Dialyse |
| Z49.1 | extrakorporale Dialyse |
| ICD-10 online (WHO-Version 2019) | |
| Klassifikation nach ICD-11 | |
|---|---|
| QB94 | Dialysebehandlung |
| QB94.0 | Vorbereitung für die Dialyse |
| QB94.1 | Extrakorporale Dialysebehandlung |
| QB94.2 | Peritoneale Dialysebehandlung |
| QB94.Y | Sonstige näher bezeichnete Dialysebehandlung |
| QB94.Z | Dialysebehandlung, nicht näher bezeichnet |
| ICD-11: Englisch • Deutsch (Vorabfassung) | |
Als Dialyse (altgriechisch διάλυσιςdialysis, deutsch ‚Auflösung‘, ‚Loslösung‘, ‚Trennung‘, ‚Zerfallen‘) wird ein Blutreinigungsverfahren bezeichnet, das seit 1924 bei Nierenversagen als Ersatzverfahren bei Menschen zum Einsatz kommt. Die Dialyse ist neben der Nierentransplantation die wichtigste Nierenersatztherapie bei chronischem Nierenversagen und eine der Behandlungsmöglichkeiten bei akutem Nierenversagen. Man spricht auch von der Blutdialyse[1] oder von einer Dauerdialyse[2] und zur Abgrenzung zur Leberdialyse von der Nierendialyse.
Dialyse im eigentlichen Sinn ist der durch Diffusion erfolgende Stoffaustausch über eine semipermeable Membran, wobei gelöste Moleküle aus hochkonzentrierten Lösungen (hier Blut/Plasma) in schwachkonzentrierte Lösungen (Dialyselösung) wandern.[3]
Als künstliche Niere[4] oder als Dialysator bezeichnet man (in Abgrenzung zur Peritonealdialyse) das Dialysegerät (Dialysemaschine, Dialyseapparat) für die extrakorporale Hämodialyse, also für die sogenannte maschinelle (apparative) Blutwäsche.[5]
Die Niere hat neben ihrer filtrativen auch eine endokrine Funktion (Erythropoetin und Calcitriol). Nur die Filtration kann von der Dialyse übernommen werden.
Geschichte
Das Adjektiv dialyticus bedeutet „zum Zertrennen (organischer Teile und so weiter) oder zum Zerstören oder Auflösen gehörig oder dienlich“, wie Ludwig August Kraus 1844 schrieb. Die Dialyse war damals das Zergehen oder die Erschöpfung der Kräfte.[6]
Dialyse als Trennverfahren
Thomas Graham hatte 1861 die Dialyse als Trennverfahren beschrieben. Nach Graham und Eckhard „kann man also einem Lösungsgemisch von krystalloiden und colloiden Substanzen, zum Beispiel Blutserum, die ersteren bis auf Spuren entziehen, dadurch dass man das Gemisch durch eine poröse Membran gegen Wasser diffundiren lässt, welches man zur Beschleunigung der Diffusion häufig erneuert.“[7][8][9]
Otto Roth schrieb 1925: „Dialyse: Durchwandern eines in Lösung befindlichen kristallinischen Stoffes durch eine Membran (Pergament usw.) in eine Flüssigkeit von geringerer Konzentration.“[10] Dieses Prinzip wurde in Meyers Kleinem Lexikon 1933 ausführlicher dargestellt: „Dialyse ist die Trennung kristallisierbarer Körper (Kristalloide, zum Beispiel Zucker) von nicht kristallisierbaren (Kolloide, zum Beispiel Eiweiß) aus gemeinsamer Lösung im Dialysator mittels poröser Membran (Pergamentpapier), durch die Kristalloide leicht, Kolloide schwer hindurchtreten.“[11]
Heutzutage können technische Mineralöle und synthetische Öle zur Wiederaufbereitung dialysiert werden (Öldialyse). Insofern ist die Dialyse auch ein Reinigungsverfahren.
Hämodialyse
Ende 1913 berichteten John Jacob Abel (1857–1938), Leonard George Rowntree (1883–1959) und Bernard Benjamin Turner (1871–1945),[12] die erstmals am 10. November 1912 in Baltimore eine Vividiffusion (Dialyse) am Versuchstier (Kaninchen) durchgeführt hatten,[13] über die dazu angewandte Methode und das erste Hämodialysegerät; sie bezeichneten es als „vividiffusion apparatus“ und als künstliche Niere (englisch: „artificial kidney“).[14] Von 1914 bis 1917 führte auch Georg Haas (siehe unten) erste Tierversuche an Hunden durch. Von Abels Arbeit erfuhr er im Frühjahr 1924.[15]
Im Juli 1923 berichtete der Hamburger Physiologe Heinrich Necheles über Dialysen an beidseitig nephrektomierten Hunden mit der ersten „Sandwich-Niere“, einem Dialysierapparat aus Röhren von Kalbsperitoneum, die in elastische Gitter eingespannt waren.

Die weltweit erste erfolgreiche „Blutwäsche“ als extrakorporale Hämodialyse über semipermeable Membranen beim Menschen wurde 1924 (zwischen erster Januarwoche und Ende Oktober) von dem Internisten Georg Haas in Gießen durchgeführt.[16] Die von ihm zur Behandlung benutzte „künstliche Niere“ war ein Kabinensystem mit sogenannter Schlauchniere und stellte das erste bei Menschen eingesetzte künstliche Organ dar. Seine ersten Hämodialysen mit Hirudin zur Antikoagulation und mit Kollodium als Dialysiermembran bei Menschen erfolgten ab Sommer 1924. Mit der ab 1925 erfolgten Verwendung von Heparin zur Verhinderung der Blutgerinnung während der extrakorporalen Dialyse gelang Georg Haas ein weiterer Schritt auf dem Weg zu nicht durch Verunreinigungen gefährdeten „Blutwäsche[n] größeren Stils am Menschen“, die er 1927/1928 am Menschen durchführte. Im Jahr 1929 fasste er seine Untersuchungen und Arbeiten zur Blutauswaschung (Dialysis in vivo) zusammen. Ein weiterer Entwicklungsschritt der klinisch einsetzbaren künstlichen Niere erfolgte 1937 mit der Einführung von Cellophan als Dialysemembran durch Wilhelm Thalhimer.

Der Niederländer Willem Johan Kolff, Internist am Krankenhaus in Kampen, setzte am 17. März 1943 erstmals ein nach dem Prinzip der Archimedischen Schraube funktionierendes Trommeldialysegerät (die erste rotierende Trommelniere) mit Zellophan-Schläuchen als Dialysemembran zur Blutwäsche an einer urämischen Patientin ein.[17] Die Membran dieser „rotierenden Trommel“ erlaubte eine kontrolliertere Blutreinigung von definierten Stoffmengen. Eine technisch überlegene Parallelentwicklung von Nils Alwall in Lund (Schweden) 1946, der wie Georg Haas eine Schlauchniere verwendete, erlaubte auch die Ausschwemmung von Ödemflüssigkeit aus Lungen und Gewebe (Ultrafiltration). Ein Plattendialysator war dann erst die 1948 von dem US-amerikanischen Biochemiker Leonard T. Skeggs (1918–2002) vorgestellte leicht transportierbare künstliche Niere.[18] Weitere Pioniere waren Erich Streicher und Curt Moeller. Eine Behandlung von Patienten mit chronischer Niereninsuffizienz mittels der Dialyse wurde erst nach der Entwicklung von arteriovenösen Shunts als dauerhaftem Blutgefäßzugang durch Belding Scribner (1960) und James E. Cimino (1966) möglich. Die vorherigen Blutwäschen waren nur bei akuter Niereninsuffizienz geeignet, da die dazu notwendigen Gefäßeinschnitte (Vasotomien) nur etwa 11 Behandlungen bei ein und demselben Patienten zuließen.[19]
Peritonealdialyse
Ende des 19. Jahrhunderts wurden die Grundlagen für die Peritonealdialyse (abgekürzt PD, Bauchfelldialyse) von Georg Ganter gelegt. 1923 führte er in Würzburg die erste klinische Peritonealdialyse durch.
Stephen Rosenak und P. Siwon[20] entwickelten in den 1920er Jahren einen Metallkatheter für eine kontinuierliche Peritoneallavage.
1927 wurde Ganters Vision einer künstlichen Niere von den Baseler Chirurgen Heinrich Heusser und Hermann Werder erstmals „voll in die Realität“[21] umgesetzt, indem sie drei Patienten mit akutem Nierenversagen mit einer kontinuierlichen Peritonealdialyse unter Verwendung von zwei Kathetern und einem Dialysat aus einer auf 42 Grad Celsius erwärmten Ringer-Lösung mit zwei- bis fünfprozentigem Glukoselösungszusatz behandelten und eine Senkung des Harnstoffspiegels im Blut nachweisen konnten.[22][23][24]
Franz Volhard beschrieb 1931 eine Peritonealdialyse: „Mein ausgezeichneter früherer Mitarbeiter Keller und ich haben auch versucht, das Bauchfell als Diffusionsmembran zu verwenden und durch intraperitoneale Eingießung und späteres Wiederablassen der Ringerlösung den Harnstoffspiegel zu senken. Erfreulich war das Ergebnis – es ist sowieso nur ein Zeitgewinn zu erwarten – nicht, und wir haben das Verfahren nicht weiter verfolgt.“[25] In der Folgezeit verlor das Verfahren vorerst an Bedeutung, ab 1943 auch zugunsten der von Kolff entwickelten Hämodialyse.[26]
Noch 1951 wurden für Zu- und Abfluss zwei dicke Nadeln empfohlen.[27] 1959 wurde erstmals mithilfe flexibler Kunststoffkatheter aus Polyäthylen der Langzeiteinsatz möglich. Anfang der 1960er Jahre erfolgte die erste automatisierte Peritonealdialyse. Die heutige PD hat aufgrund von Verweilkathetern aus Silikon-Kautschuk ihren Durchbruch geschafft. 1975 entwickelten Popovich und Moncrief (Texas) die ersten Ansätze der so genannten kontinuierlichen ambulanten Bauchfelldialyse (CAPD, continuous ambulatory peritoneal dialysis, s. u.). Ende der 1970er Jahre stellte die Arbeitsgruppe Oreopoulos in Toronto die heutige Form der CAPD vor.
Seit 1977 wird intraperitoneale Dialyselösung auf der Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation geführt.
Dialyseverfahren
Es werden einerseits extrakorporal (außerhalb des Körpers) und intrakorporal (innerhalb des Körpers) erfolgende Verfahren unterschieden. Andererseits unterscheidet man auch nach dem Ort, an dem die Dialyse stattfindet: in einem (Dialyse-)Zentrum oder aber zuhause. Das gebräuchlichste extrakorporale Verfahren ist die Hämodialyse (im Zentrum). Das nicht-extrakorporale Verfahren ist die Peritonealdialyse (zuhause); sie heißt auch intestinale Dialyse.[28]
Da für die Durchführung der Verfahren umfassende Kenntnisse der möglichen unerwünschten Nebenwirkungen erforderlich sind, werden diese meist von Nephrologen oder Intensivmedizinern durchgeführt.
Die Körperoberfläche des Patienten gleicht ungefähr der Oberfläche seines Peritoneums; die Oberfläche der Kapillaren des Hämodialysefilters soll diesem Wert entsprechen.[29]
Zentrumsdialyse
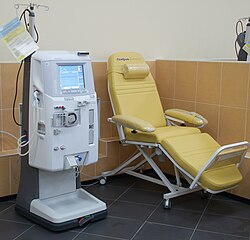
Hämodialyse (HD)
Das Blutreinigungsverfahren Hämodialyse ist der Austausch gelöster Substanzen über eine semipermeable Membran (Dialysator) durch Diffusion entlang einem Konzentrationsgefälle zwischen Blut und Dialysat, wobei zusätzlich durch Ultrafiltration ein Flüssigkeitsentzug durch hydrostatischen Druckunterschied erfolgt.[30] Bei der Hämodialyse wird nach dem Prinzip des Konzentrationsausgleichs kleinmolekularer Substanzen zweier Flüssigkeiten verfahren, die durch eine semipermeable Membran getrennt sind (Osmose). Von der Filtermembran getrennt befindet sich auf der einen Seite das Blut mit Elektrolyten wie Kalium und Phosphat sowie mit den harnpflichtigen Substanzen (z. B. Kreatinin, Harnstoff, Harnsäure). Auf der anderen Seite der Membran befindet sich eine keimarme, aufbereitete Lösung (Dialysierflüssigkeit), deren Wasser bei Online-Zubereitung durch Umkehrosmose aufbereitet wurde, die keine Abfallprodukte enthält und einen an den jeweiligen Bedürfnissen des Patienten orientierten Anteil an Elektrolyten (etwa Kaliumionen von 0 bis 4 mmol/l und Calciumionen von 1,5 bis 1,75 mmol/l)[31] aufweist. Die semipermeable Filtermembran (Dialysemembran) zwischen Blut und Dialyselösung besitzt Poren, die kleine Moleküle wie Wasser, Elektrolyte und harnpflichtige Substanzen durchlassen, aber große Moleküle wie Eiweiße und Blutzellen zurückhalten. Gelegentlich spricht man hier vom Gegenstromprinzip. Zudem kann während der Hämodialyse eine metabolische Azidose durch Bikarbonat ausgeglichen werden, was bessere Kreislaufstabilität und geringere subjektive Beschwerden als die frühere, apparativ weniger aufwändige, Acetatpufferung bewirkt.
Grundvoraussetzungen für die Durchführung einer etwa vier bis fünf Stunden dauernden Hämodialyse[32][33] sind eine ausreichende Kreislaufstabilität, ein ausreichendes Blutvolumen und ein guter (arterieller, venöser) Zugang am Patienten. Letzteres wird durch die operative Anlage eines arteriovenösen Shunts (früher externer Scribner-Shunt, heute in der Regel interner Cimino-Shunt) am Unter- oder Oberarm erreicht. Bei problematischen Eigengefäßen werden dabei Gefäßprothesen (Goretex) verwendet. In sehr seltenen Fällen wird der Shunt am Oberschenkel oder zwischen der Arteria subclavia und der Vena subclavia (wegen der Lage auch Collier- oder Dekolletéshunt genannt), mit oder ohne Verwendung von künstlichen Gefäßen, angelegt. Eine weitere Möglichkeit ist das Einbringen eines Dialysekatheters in eine entsprechend große Körpervene für die Akutdialyse (Shaldon-Katheter, meist über den Hals (Vena jugularis interna) oder durch die Schlüsselbeingrube (Vena subclavia), selten über die Leiste (Vena femoralis), nach Stanley Shaldon), dauerhaft nur bei multimorbiden Patienten mit sehr schlechter Gefäßsituation oder schwerer Herzinsuffizienz (Demers-Vorhofkatheter oder Hickman-Katheter).

Während einer Behandlung wird über den Patientenzugang Blut aus dem Patienten gepumpt, im Dialysator (Filter) an der Dialysemembran vorbeigeführt und anschließend gereinigt dem Patienten wieder zurückgegeben. Giftstoffe (Stoffwechselabbauprodukte) und niedermolekulare Stoffe (membrangängige Stoffe) werden aus dem Blut entfernt, da sie durch die Membran auf die andere Filterseite in die Dialyselösung (Dialysat) diffundieren. Der Dialysator wird dabei ständig von frischem Dialysat durchströmt (ca. 500 ml/min). Die Hämodialysebehandlung wird in der Regel für circa vier bis fünf Stunden (Nachtdialyse bis zu acht Stunden) pro Behandlung und mindestens dreimal in der Woche durchgeführt (abhängig von Körpergewicht, Nierenrestfunktion, Herzleistung).
Patienten mit chronischer Niereninsuffizienz leiden häufig auch an einer Überwässerung. Das überschüssige Wasser wird dem Blut durch Anlegen eines Druckgradienten (Unterdruck auf Dialysatseite) entzogen. Dadurch wird geregelt, wie viel Flüssigkeit dem Blut entzogen wird, und so die natürliche diuretische Funktion der Niere nachgeahmt. Der Flüssigkeitsentzug ist jedoch dadurch beschränkt, dass im Körper die Flüssigkeit (gilt ebenfalls für die Giftstoffe) nicht beliebig schnell in die Blutbahn nachdiffundieren kann, um den Flüssigkeitsverlust auszugleichen, wodurch ein lebensgefährlicher Blutdruckabfall droht. Außerdem geben verschiedene Gewebe Flüssigkeit unterschiedlich schnell ab, so kann es z. B. zu einem Krampf der Muskulatur kommen, obwohl noch zu viel Flüssigkeit im Körper vorhanden ist. Durch diese Effekte ist der erreichbare Flüssigkeitsentzug durch die Dialyse beschränkt und die Patienten dürfen daher nicht nach Belieben trinken. Da andererseits viele Patienten aufgrund der Häufung sogenannter „harnpflichtiger“ Substanzen im Körper an ständigem starken Durst leiden, wird die geringe erlaubte Trinkmenge (Restausscheidung in 24 Stunden plus 500 ml) häufig als belastend empfunden.
Da die Dialyse in der ersten Behandlungshälfte effektiver ist, ist es medizinisch sinnvoll, häufige kurze Dialysen statt seltene lange Dialysen durchzuführen. Durch eine häufigere Hämodialyse werden Vorteile der Peritonealdialyse (Dialyse jeden Tag) und der konventionellen Hämodialyse (hohe Effektivität) miteinander kombiniert. Aufgrund der Praktikabilität und der Patientenakzeptanz, aber auch weil die Krankenkassen grundsätzlich nur Behandlungspauschalen pro Patient bezahlen, werden Patienten in den Dialysezentren nicht mehr als drei Dialysen pro Woche angeboten. Ausnahmen bilden hierbei lediglich zusätzliche Dialysen bei überwässerten Patienten oder in der Phase der Dialyseaufnahme („Andialyse“), in der der Patient unter Umständen eine Woche lang täglich dialysiert wird. Manche Zentren bieten zur Verlängerung der Dialysezeit Nachtdialysen an. Einige Patienten können während der Dialyse schlafen, manchmal erst nach einer Eingewöhnungszeit, andere allerdings gar nicht. Eine Verlängerung der wöchentlichen Dialysezeit und eine gleichmäßigere Therapie sind vor allem durch die tägliche Heimhämodialyse (siehe unten) möglich.
Dialysepatienten haben häufig einen Eisenmangel. Dieser entsteht durch den Blutverlust bei der Dialyse und durch eine verminderte Eisenabsorption im Darm.[34] In vielen Einrichtungen wird deshalb ein Eisenpräparat, z. B. Eisengluconat, intravenös verabreicht.[35] Zur Vermeidung einer Eisenüberladung (Hämochromatose) wird empfohlen, die Konzentration von Ferritin im Serum regelmäßig zu kontrollieren.[36] Zur Anregung der Blutbildung erhalten viele Dialysepatienten Erythropoietin-Analoga.
Intermittierende Peritonealdialyse (IPD)
Eine intermittierende Peritonealdialyse erfolgt dreimal oder viermal pro Woche in einer Dialyseeinrichtung. In einem Zeitraum von etwa acht Stunden werden dabei in etwa halbstündigen Einzelphasen etwa 30–40 l Dialyselösung verbraucht. Die IPD ist die im zeitlichen Ablauf am ehesten mit der maschinellen Hämodialyse vergleichbare Form der Peritonealdialyse, bei der die Dialyse durch medizinisches Personal geleitet und überwacht wird.
Heimdialyse
Heimhämodialyse (HHD)
Bei der HHD führt der Patient die Dialysebehandlung mit dem Dialysegerät zu Hause drei- bis sechsmal wöchentlich selbstständig durch. Hierbei kann er auch von einer Hilfsperson – in der Regel dem Lebenspartner – unterstützt werden. Die Wohnung des Patienten muss über ausreichend Platz verfügen, um einen Vorrat der benötigten Materialien zu lagern und das Dialysegerät aufstellen zu können, am besten in einem separaten Raum. Patienten, die eine HHD durchführen, können häufiger dialysieren, im Regelfall alle zwei Tage oder täglich, und dadurch das problematische längere Behandlungsintervall am Wochenende vermeiden.
Peritonealdialyse (PD)
Es gibt unterschiedliche PD-Verfahren, z. B. die mit Geräten durchgeführte Methode der CCPD (kontinuierliche zyklische Peritonealdialyse, s. u.) oder die manuelle CAPD (continuously ambulatory peritoneal dialysis, kontinuierliche ambulante Peritonealdialyse, s. u.). Die IPD (intermittierende PD, s. o.) zählt zur Zentrumsdialyse. Die Wahl des Verfahrens hängt unter anderem von den Transporteigenschaften des Peritoneums (s. u.) und der Grunderkrankung des Patienten ab.
Bei der PD und der HD handelt es sich um gleichwertige Dialyseverfahren. Wissenschaftliche Daten aus den USA und Europa zeigen für PD-Patienten ein besseres Überleben in den ersten 3 Jahren und ein ähnliches Langzeit-Überleben wie bei HD-Patienten.[37][38][39][40][41] Trotzdem kommt in Deutschland die PD bei nur 5–10 % aller Patienten zum Einsatz.[32][42] Die Lebensqualität von PD-Patienten wird deutlich höher bewertet, denn einerseits können sich PD-Patienten ihre Zeit individueller einteilen, andererseits haben sie eine größere räumliche Flexibilität sowie Unabhängigkeit. Berufstätigkeit, Hobbys, Nahrungsaufnahme und Flüssigkeitszufuhr werden deutlich weniger eingeschränkt.
Das Bauchfell (Peritoneum) ist eine seröse Haut, die die Bauchhöhle auskleidet und große Teile des Darms umhüllt. Es ist ein relativ gut durchblutetes Gewebe, das zum Beispiel eine wichtige Rolle in der Immunabwehr des Körpers spielt.
Aufgrund des besonderen Aufbaus kann das Peritoneum als „Filtermembran“ genutzt werden: Hierzu wird dem Patienten ein Schlauch (Katheter) in die Bauchhöhle implantiert. Über diesen Katheter wird eine Dialyselösung in den Bauchraum gefüllt und dort über mehrere Stunden (z. B. bei CAPD) oder für 20–30 Minuten (z. B. IPD) belassen. Die kleinmolekularen sogenannten „harnpflichtigen“ Substanzen können nun aus dem Blut über die Kapillargefäße des Bauchfells in die Dialyselösung übertreten, da ein Konzentrationsgefälle herrscht. Wenn dem Körper auf diesem Wege auch Flüssigkeit (Wasser) entzogen werden soll, muss die Dialyselösung einen höheren Gehalt an löslichen Substanzen aufweisen als das Blut. Hierzu wird sie mit Traubenzucker, Dextrinen oder anderen Substanzen (experimentell) angereichert.
Die Dialyselösung muss nach einer bestimmten Zeit (in der Regel etwa vier bis sechs Stunden bei CAPD) abgelassen und durch eine frische ersetzt werden. Im Gegensatz zur künstlichen Membran bei der Blutdialyse ist das Peritoneum auch für Eiweiße recht durchlässig, wodurch es zu einem relevanten Eiweißverlust kommt. Vorteile dieses Verfahrens sind: das längere Aufrechterhalten der Restnierenfunktion,[43] die insgesamt selteneren Komplikationen des Dialysezugangs und die Schonung des Kreislaufs, die auch bei sehr alten und herzkranken Menschen eine Nierenersatztherapie ermöglicht.
Eine mögliche Komplikation ist die sklerosierende Peritonitis, auch als abdominelles Cocoon-Syndrom bezeichnet. Ein weiterer möglicher Vorteil ist die weitgehende Unabhängigkeit der Patienten von einem Dialysezentrum: Bei Eignung kann man die Dialyse zu Hause durchführen, auch Urlaubsreisen sind unkomplizierter möglich, da die Materialien direkt an den Urlaubsort geliefert werden (Feriendialyse) und die Terminabsprachen mit einem örtlichen Dialysezentrum entfallen. Ein Nachteil der Peritonealdialyse ist die Gefahr, dass die Bauchhöhle bei einem möglichen Kontakt mit der Umgebung mit pathogenen Keimen mit der Folge einer Bauchfellentzündung infiziert wird. Im Gegensatz zu Bauchfellentzündungen anderer Ursache, die eine schwere und oft tödliche Erkrankung darstellen, ist die CAPD-assoziierte Peritonitis jedoch einfach therapierbar, kann oft sogar ambulant behandelt werden und hat nur eine geringe Sterblichkeit. Hierzu wird ein flüssiges Antibiotikum direkt mit der Dialyselösung in die Bauchhöhle gegeben. Dennoch führen wiederholte Bauchfellentzündungen zu einer Verschlechterung der Effektivität der Bauchfelldialyse.[44] Die Patienten müssen daher beim Wechseln der Lösungen sehr sorgfältig arbeiten. Moderne Kathetersysteme ermöglichen es, die Spitze und das Innere des Katheters steril zu halten.
Limitiert ist das Verfahren durch seine vergleichsweise geringere Effektivität bei einem großen Körpergewicht und bei einer kleinen Nierenrestfunktion. Ist die Körpermasse größer und ist die Nierenrestfunktion gering, eignet sich die PD weniger. Im Laufe der Anwendung insbesondere stärkerer glukosehaltiger Dialyselösungen über mehrere Jahre hinweg kommt es bei manchen Patienten zu Veränderungen des Bauchfells, die bei gleichbleibender Glukosekonzentration eine abnehmende oder sogar eine negative Filtrationsleistung zur Folge haben können. Dann müssen zur Vermeidung von Ödembildung und Bluthochdruck die Konzentration von Glukose in der Dialyselösung erhöht und die Verweilzeit der Lösung im Bauchraum verringert werden.
Aufgrund der Veränderungen des Peritoneums, die in einem sehr variablen Zeitraum in den allermeisten Fällen irgendwann zu einem sogenannten Ultrafiltrationsversagen[45] und damit zu einer nicht ausreichenden Entgiftung und zu einer unzulänglichen Entwässerung führen, ist die Peritonealdialyse immer ein Verfahren auf Zeit. Gute Erfahrungen macht man mit der Peritonealdialyse als „bridge to transplant“ bei jüngeren Menschen. Die laufende Glukoseaufnahme aus der Dialyselösung und auch der kontinuierliche Eiweißverlust können zur Entwicklung oder zur Verschlechterung eines Diabetes mellitus führen. Trotzdem konnte in Studien gezeigt werden, dass insbesondere Diabetiker in den ersten Jahren des Endstadiums ihrer Nierenerkrankung von einer Peritonealdialyse profitieren.[43]
Automatisierte Peritonealdialyse (APD)
Die automatisierte Peritonealdialyse ist ein Heimtherapie-Verfahren, das zumeist während der Nacht durchgeführt wird und bei dem der Beutelwechsel durch eine Maschine automatisch erfolgt.
Kontinuierliche ambulante Peritonealdialyse (CAPD)
Im Gegensatz zur APD wird beim Blutreinigungsverfahren der CAPD der Beutelwechsel durch den Patienten selbst oder mit Hilfe seiner Familienangehörigen oder von Pflegediensten tagsüber von Hand zuhause (oder auch am Arbeitsplatz) durchgeführt.
Sonderformen der Hämodialyse
Hämofiltration
Das Blutreinigungsverfahren Hämofiltration ist eine reine Ultrafiltration und Ersatz durch Elektrolytlösung. Bei der Hämofiltration (Abfiltrieren von Plasmawasser mit Substitution)[46] wird dem Blut Flüssigkeit entzogen, ohne dass eine Spüllösung (Dialysat) verwendet wird. Aufgrund eines über eine Pumpe angelegten Druckgradienten (Transmembrandruck) an der Filtermembran wird konvektiv Plasmaflüssigkeit aus dem Blut über die Membran entzogen (Ultrafiltration). Durch diesen transmembranen Fluss werden auch alle filtergängigen Stoffe mitentfernt. Dies ermöglicht eine langsame Entgiftung und bei Bedarf eine schnelle Volumenveränderung im Patientenkörper. Die entzogene Flüssigkeit wird durch eine Elektrolytlösung (Substituat) individuell angepasst ersetzt. Es handelt sich um ein maschinelles Verfahren.
Als Spontanfiltration bezeichnet man ein Verfahren, bei dem der Blutfluss spontan von Arterie zu Vene erfolgt. Durch den Eigendruck in einer Schlagader des Patientenkreislaufs wird (ohne Pumpe) Plasmaflüssigkeit abgepresst und durch eine Elektrolytlösung ersetzt. Das ist die kontinuierliche arteriovenöse Hämofiltration (CAVH). Diese, 1977[47] von Fritz Schelers Mitarbeiter Peter Kramer in Göttingen entwickelte, wenig effektive und vom Blutdruck abhängige Methode wurde bald durch die pumpengetriebene kontinuierliche venovenöse Hämofiltration (CVVH) abgelöst, die ihrerseits durch die Kombination mit Dialyse zur kontinuierlichen venovenösen Hämodiafiltration erweitert worden ist (CVVHDF). Diese Verfahren werden auf Intensivstationen zur Behandlung von Patienten mit akutem Nierenversagen eingesetzt.
Im Prinzip ähnlich wie CAVH und CVVH sind die Verfahren kontinuierliche arteriovenöse Hämodialyse (CAVHD) und kontinuierliche venovenöse Hämodialyse (CVVHD).[48]
Hämodiafiltration
Die Hämodiafiltration bezeichnet ein extrakorporales Verfahren zur Blutreinigung, bei dem die Hämodialyse und die Hämofiltration in Kombination angewendet werden. Dieses Verfahren kommt insbesondere bei chronischer Niereninsuffizienz zur Anwendung und ermöglicht sowohl die Entfernung von nieder- als auch von mittelmolekularen Substanzen bei kontrolliertem Ersatz des Ultrafiltrats durch physiologische Elektrolytlösung (Diluat). Die Ersatzlösung wird entweder dem Blut vor oder nach dem Dialysator zugegeben und im Dialysator wieder entfernt (Ultrafiltration). Dadurch kann ein höherer transmembraner Fluss erzeugt werden, der zur effektiveren Entfernung der Giftstoffe führt.
Hämoperfusion
Die Hämoperfusion ist kein Nierenersatzverfahren, sondern ein Blutreinigungsverfahren bei akuten Vergiftungen und wird nur von besonders dafür eingerichteten Kliniken durchgeführt. Dabei wird das Blut durch Adsorbenzien (z. B. Aktivkohle oder Austauscherharze) gepumpt. Dadurch können einige fettlösliche oder proteingebundene Stoffe (z. B. bestimmte überdosierte Medikamente, organische Lösungsmittel, Insektizide, Pilzgifte) aus dem Blut entfernt werden. Dieses Verfahren ist nur für eine vergleichsweise geringe Zahl von Substanzen etabliert.
Eine Hämoperfusion wird empfohlen bei Vergiftungen oder bei sonstiger Toxizität (zum Beispiel aufgrund von Barbituraten, vielen Antidepressiva, Ethchlorvynol, Meprobamat, Paraquat, Glutethimid, Metallen wie Lithium und Barium oder bei toxischen Dosen von Aminoglykosiden oder von kardiovaskulären Medikamenten).
Indikationen und Beginn einer Dialysetherapie
Die Entscheidung, ob und wann eine Dialysebehandlung oder Hämofiltration bei Patienten mit Nierenversagen notwendig wird, hängt von verschiedenen Faktoren ab, welche akuter oder chronischer Natur sein können. Ein isolierter Anstieg des Serumkreatinins ist keine Dialyseindikation.[49]
- Akute Indikationen für den Beginn einer Dialysebehandlung:
- akutes Nierenversagen, z. B. während einer Sepsis („Blutvergiftung“), nach einem Trauma (Unfall) oder nach großen operativen Eingriffen
- Hyperkaliämie
- metabolische Azidose
- (diuretikarefraktäre) Überwässerung (manifestiert sich meistens als Lungenödem mit Atemnot)
- Hypervolämie
- unzureichende Kalorienzufuhr[50]
- urämische Serositis, wie Perikarditis
- urämische Enzephalopathie
- akute Vergiftungen mit dialysierbaren Substanzen, wie Lithium oder Acetylsalicylsäure
- Chronische Ursachen für den Beginn einer Dialysebehandlung:
- symptomatisches Nierenversagen
- schwere Herzinsuffizienz
- niedrige glomeruläre Filtrationsrate (GFR), meistens bei einer GFR, die niedriger als 10 bis 15 ml/min pro 1,73 m² Körperoberfläche ist
- anders nicht beherrschbare Hyperphosphatämie oder Urämie (Harnstoff-Stickstoff (N) größer als ca. 100 mg/dl)
Eine Dialyse ist dann indiziert, wenn sie mit Diät oder Medikamenten nicht vermieden werden kann. Oft kann so der Plasmaspiegel der schädlichen sogenannten "harnpflichtigen" Substanzen reduziert werden.[51]
Zu den absoluten Indikationen zur Dialyseeinleitung zählen außerdem ein therapierefraktärer Hypertonus, eine urämische Neuropathie, eine schwere urämische Blutungsneigung sowie ein unstillbares Erbrechen. Zu den relativen Indikationen zählen ein zunehmender Gewichtsverlust wegen Übelkeit und Erbrechens, eine zunehmende Müdigkeit und Schwäche, eine verringerte kognitive und intellektuelle Leistungsfähigkeit, ein ausgeprägter persistierender Pruritus sowie eine zunehmende soziale Isolation mit Depression.[52][53][54]
Kontraindikationen zur Langzeitdialyse
Kontraindikationen sind die Ablehnung der Dialysebehandlung durch den Patienten und eine fehlende Indikation für eine Dialyse.
Hämodialyse
Als absolute Kontraindikation für eine Hämodialyse gilt ein fehlender Gefäßzugang.
Als relative Kontraindikation für eine intermittierende Hämodialyse gelten:
- eine Kreislaufinstabilität (zum Beispiel mit einer schweren arteriellen Hypotonie[55])
- ein stark erhöhtes Blutungsrisiko[56]
- psychiatrische Störungen, die mit einer Selbstgefährdung oder Fremdgefährdung einhergehen
- hochgradige arteriosklerotische Stenosen an Arterien, die lebenswichtige Organe (zum Beispiel Hirn, Herz, Darm) versorgen
Peritonealdialyse
Als Gegenanzeigen für eine kontinuierliche ambulante Peritonealdialyse gelten:
- fehlende Heimdialysevoraussetzungen
- ausgedehnte abdominelle Verwachsungen
- eine Kolostomie (Enterostoma in der Bauchwand)
- frische abdominelle Operationen
- ein Lendenwirbelsäulensyndrom
- abdominelle Hernien
- schwere Atemwegserkrankungen
- ein hyperkataboler Zustand
- ein Loch im Diaphragma (Zwerchfellbruch)
- der Verlust der Fähigkeit des Peritoneums zur adäquaten Clearance
- fehlende Assistenz, wenn der Patient sich nicht selbst helfen kann[57]
- chronisch-entzündliche Darmerkrankungen
- eine chronische obstruktive Lungenkrankheit
- ein Eiweißmangel
- Psychosen[58]
- eine Divertikulitis
- riesige Zystennieren
- eine Anurie[59]
Effektivität der Dialyse
Die Dialyse unterstützt die Nieren bei der Ausscheidung der sogenannten "harnpflichtigen" Substanzen. Die renale Gesamtclearance ist bei Dialysepatienten immer die Summe aus apparativer Clearance und renaler Restfunktion. Mit keinem Verfahren ist eine genaue Bestimmung der renalen Restfunktion möglich. Trotzdem gilt zum Beispiel für die Peritonealdialyse: „Je höher die renale Restausscheidung, desto geringer die erforderliche peritoneale Ultrafiltration, wodurch der Einsatz höherprozentiger Glukoselösungen reduziert werden kann.“[60]
Die glomeruläre Filtrationsrate des dialysierten Patienten setzt sich additiv aus eigener und maschineller GFR zusammen. Die eigene GFR setzt sich additiv aus den glomerulären Filtrationsraten von rechter und linker Niere zusammen. Die maschinelle GFR ist ein fiktiver Wert, der in der Nephrologie grob geschätzt wird. Zu dieser Schätzung der Dialysequalität wird die sogenannte Harnstoff-Clearance herangezogen; sie wird als Kt/V abgekürzt. „Wegen der hohen tubulären Kreatinin-Sekretion bei terminaler Urämie wird der Durchschnitt aus Kreatinin-Clearance und Harnstoff-Urin-Clearance zur Dialysat-Kreatinin-Clearance addiert, um ein der GFR vergleichbares Maß zu erhalten.“[61]
Ähnlich beschreibt Tinsley Randolph Harrison das Verhältnis Kt/V als funktionelle Harnstoff-Clearance, wenn übersetzt wird: „Die Harnstoff-Clearance K ist die Summe der Dialysat-Clearance plus der Nieren-Clearance und wird mit der Zeit an Dialyse multipliziert (T).“[62] Vereinfacht wurde das Kt/V als die Dialysedosis der aktuellen Behandlung beschrieben.[63] Die erforderliche Dialysedosis wird über die Harnstoffclearance Kt/V oder durch die Harnstoffreduktionsrate (URR, Urea Reduction Rate) definiert.[64]
Die maschinelle GFR wird in der Fachliteratur als nominelle Dialysator-Clearance für Harnstoff bezeichnet. Sie liegt zwischen 250 und 300 ml/min. Bei der Zentrumsdialyse wird diese hohe Clearance innerhalb von zwölf Wochenstunden erzielt; in den restlichen 156 Wochenstunden findet keine apparative Clearance statt. „Über die gesamten 168 Stunden einer Woche gerechnet liegt die mittlere Harnstoff-Clearance bei lediglich 17 ml/min.“[65]
Im internationalen Schrifttum werden nicht die glomerulären Filtrationsraten, sondern die Harnstoff-Clearance-Werte Kt/V von Mensch und Maschine addiert.[66] Ebenso wird für Kinder ein Gesamt-Kt/V als Summe von Dialyse und residualer Nierenfunktion gebildet.[67]
Im Idealfall sollte die Nierenersatztherapie die filtrative Nierenfunktion vollständig ersetzen können.[68] Das ist jedoch nur selten erforderlich (bei Aplasia renalis bilateralis, beiderseitiger Anephrie, doppelseitiger Nierenaplasie mit einer „arenalen Anurie“). Meistens gilt folgende Aussage: „Effizienz und Dauer der Dialyse sind an den medizinischen Erfordernissen und dem Wohlbefinden des Patienten zu bemessen.“[69]
Der Erhalt der Nierenrestfunktion ist von zentraler Bedeutung, da sie einen Prädiktor für die Morbidität und die Mortalität der Patienten darstellt.[70]
Nebenwirkungen
Mehrere Krankheitsbilder führen das Wort Dialyse im Namen. Zusätzlich zu den unerwünschten Nebenwirkungen der Dialyse werden in der Fachliteratur zahlreiche Komplikationen der Dialyse beschrieben. Bei diesen Komplikationen lässt sich oft nicht exakt zwischen krankheitsbedingten und behandlungsbedingten Komplikationen unterscheiden.
Zerebrales Dialysesyndrom
Zu den unerwünschten Nebenwirkungen der Dialyse zählt das zerebrale Dialysesyndrom. Es entsteht auf Grund einer intrazellulären Volumenzunahme von Gehirnzellen als eine Folge einer hypotonen Dehydration oder als Disäquilibriumssyndrom bei einer zu schnellen Korrektur der Azotämie urämischer Patienten, wenn die Harnstoffkonzentration im Blut schneller absinkt als im Liquor cerebrospinalis und im Hirngewebe. Das klinische Bild wird charakterisiert durch Benommenheit, Fieber, Erbrechen, delirante Zustände, zerebrale Krämpfe und Dehydrationszustände.[71]
Dialysekopfschmerz
Ein holokranieller Dialysekopfschmerz kann mit Paracetamol behandelt werden.[72]
Dialysedemenz
Die Dialysedemenz ist eine potentiell tödlich verlaufende Form der Dialyseenzephalopathie. Sie gilt als Teil der Aluminiumintoxikation und kann auch bei der aluminiumassoziierten Knochenerkrankung vorkommen. Klinisch zeigt die Dialysedemenz progrediente neurologische Auffälligkeiten, zum Beispiel Dysarthrie, Mutismus, Amnesie, myoklonische Bewegungen, Dysphagie, Grimassieren, Krampfanfälle und schließlich eine schwere Demenz mit tödlichem Verlauf.[73] Früher wurden auch Sprachstörungen und Schreibstörungen, unkoordinierte Bewegungen sowie psychische Veränderungen wie Halluzinationen, Agitationen und Depressionen beschrieben.[74]
Dialysejucken
Ein dialyseassoziierter Juckreiz (Pruritus)[75] fand sich bei den Kurzzeitdialysepatienten in 78 % der Fälle, bei den Langzeitdialysepatienten nur in 43 %. Beobachtet wurden unterschiedliche Pruritusformen. Auch das Schwitzverhalten ändert sich bei Dialysepatienten. Ferner werden seltene dialysebedingte Hauterkrankungen beschrieben, wie Calcinosis cutis, Morbus Kyrle (Hyperkeratosis follicularis et parafollicularis in cutem penetrans, Kyrle-Syndrom, nach Josef Kyrle), Folliculitis perforans und eine reaktive perforierende Kollagenose.[76][77]
Dialyseenzephalopathie
Nach mehrjähriger extrakorporaler Dialyse kann eine Dialyseenzephalopathie auftreten. Dieser schwere Hirnschaden wird durch eine Aluminiumintoxikation verursacht. Die Quellen sind aluminiumhaltige Phosphatbinder und ein kontaminiertes Dialysewasser. Charakteristische Zeichen sind eine Dysarthrie, eine Dysphasie und eine Dyspraxie, die während der Dialyse sich verstärkt und allgemein progredient ist. Es kann zur Demenz sowie zu paranoiden, psychotischen und deliranten Persönlichkeitsveränderungen kommen. Außerdem werden Krämpfe, Myoklonien, Hirnnervenlähmungen und eine periphere Neuropathie beschrieben.[78]
Dialyseosteopathie
Die Dialyseosteopathie besteht in Knochenveränderungen vor allem im Sinne einer Osteomalazie als Folge einer über lange Zeit durchgeführten Hämodialyse bei chronischer Niereninsuffizienz. Verursacht wird sie vor allem durch einen Mangel an aktiviertem Vitamin D und auch durch einen sekundären Hyperparathyreoidismus infolge der Niereninsuffizienz mit Verschlimmerung durch die Nebenwirkungen der Dialyse. Es kommt zu Ablagerungen von Aluminium im Knochengewebe. Der Vitaminmangel und eine Hyperphosphatämie führen zu einer Hypokalzämie und zu einem sekundären Hyperparathyreoidismus.[79] Zusätzlich kann Heparin als Langzeitfolge eine Osteoporose begünstigen.[80]
Dialysearthritis
Die Röntgenanalyse des veraschten Gewebes von Patienten mit einer Dialysearthritis ergab im Gewebe ein Apatit, die chemische Analyse zeigte ein Hydroxyapatit. Histochemisch ließ sich in dem befallenen Gewebe Calciumphosphat nachweisen. 1964 glaubt man, es könne sich bei der Dialysearthritis um eine Mischform aus einer Harnsäuregicht und einer Kalkgicht handeln.[81][82]
Dialyseamyloidose
Die Dialyseamyloidose äußert sich in einem Karpaltunnelsyndrom mit Arthropathien, Spondylarthropathien und Knochenzysten. Man spricht auch von einer dialyseassoziierten Amyloidose, einer hämodialyse-assoziierten Amyloidose und aktuell von einer AB-Amyloidose. Krankheitsspezifische Ablagerungen von Beta-2-Mikroglobulin in den Zellzwischenräumen fand man auch bei urämischen Patienten im Prädialysestadium. Die meisten Betroffenen entwickelten diese Amyloidoseform jedoch erst nach einer langjährigen Dialysetherapie. Der Pathomechanismus ist unklar.[83]
Lebenserwartung nach Ablehnung einer Dialyse
In einer Übersichtsarbeit von 2022 wurden Überlebenszeit und Lebensqualität von Patienten untersucht, die nach Erreichen des Endstadiums ihrer Niereninsuffizienz eine Dialysebehandlung abgelehnt hatten. Ausgewertet wurden 41 Verlaufsstudien (Kohortenstudien) mit insgesamt 5.102 Patienten, die sich aktiv gegen den Beginn einer Dialyse entschieden hatten. Das durchschnittliche Alter der Patienten bei ihrer Entscheidung betrug je nach Studie 60 – 87 Jahre. Die durchschnittliche geschätzte Filtrationsleistung (eGFR) der Nieren zum Zeitpunkt der Entscheidung betrug je nach Studie 7 – 19 ml/min pro 1,73 m².
Die mittleren Werte (Mediane) der Überlebenszeit je Studie betrugen:
- alle 41 Studien: 1 – 41 Monate
- Studien aus Kontinentaleuropa (11 Studien, 1.021 Patienten): 6 – 37 Monate
- Studien aus Asien (7 Studien, 1.147 Patienten): 7 – 41 Monate
- Alter 70–79 Jahre (9 Studien, 607 Patienten): 7 – 41 Monate
- Alter 80+ (25 Studien, 3.186 Patienten): 1 – 37 Monate
Die Überlebenszeiten der jeweils am längsten überlebenden Patienten der drei Studien mit den höchsten mittleren Werten betrugen 82, 79 und 75 Monate.
Im Laufe der Beobachtungszeiten von 8 bis 24 Monaten verbesserte sich der psychische Zustand der Patienten. Ihr körperlicher Zustand und ihre Lebensqualität blieben stabil, bis auf die Endphase des Lebens.
Die Autoren der Übersichtsarbeit kamen abschließend zu folgender Bewertung. Die Ergebnisse würden die weitverbreitete Fehleinschätzung infrage stellen, nach der die Alternative zur Dialyse lediglich Nichtversorgung und Tod seien.[84][85][86]
In einer systematischen Übersichtsarbeit von 2021 wurden 25 Studien ausgewertet, die Überlebenszeit und Lebensqualität verglichen zwischen Patienten mit und ohne Dialyse. Generell war die Überlebenszeit bei Dialysebehandlung länger. Ab einem Alter von 80 Jahren und allgemein bei älteren Patienten mit Begleiterkrankungen war ein Überlebensvorteil durch Dialyse nicht mehr eindeutig. Bezüglich der Lebensqualität gab es jedoch einen Trend, dass Behandlungen ohne Dialyse von Vorteil waren.[87]
Eine weitere Untersuchung zeigte 2024 nur einen winzigen Anstieg der mittleren Lebenserwartung bei 20.440 älteren Patienten (Alter über 65 Jahre; Durchschnitt 77,9 Jahre) als Folge einer früh begonnenen Dialyse. Der Unterschied zwischen Frühdialyse (innerhalb von 30 Tagen; Median 8 Tage) und Spätdialyse (nach drei Jahren) betrug nur neun Tage. Die Patienten mit der Frühdialyse überlebten im Durchschnitt 770 Tage, die mit ausschließlich medikamentöser Behandlung 761 Tage. Die durchschnittliche eGFR aller Patienten betrug zum Studienbeginn 12 ml/min.[88]
Infolgedessen wird in der geriatrischen Nephrologie das Problem von Dialyseabbruch und Dialysevorenthalt thematisiert.[89]
Dialyse von Fremdstoffen
Auch Medikamente und andere Fremdstoffe können bei der Zentrumsdialyse eliminiert werden, wenn sie oder ihre Abbauprodukte die Dialysemembran passieren können. Das muss bei der Dosierung beachtet werden. Manche Substanzen werden durch den Dialysator schneller und manche langsamer als durch die Nieren ausgeschieden. So akkumuliert zum Beispiel Aluminium im Körper von Dialysepatienten; man sah früher einen Zusammenhang zwischen einer Aluminiumintoxikation und der sogenannten Dialysedemenz.[90]
Außerdem gibt es Empfehlungen für die Mineralstoffzufuhr bei Dialyse.[91] Bei der Peritonealdialyse ist auf eine ausreichende Proteinzufuhr zu achten, weil Eiweiß über das Dialysat verloren geht.[92] Bei der Hämodialyse kann es zum Folsäuremangel kommen.[93] Es gibt Arzneimittel zur Behandlung der metabolischen Azidose (Übersäuerung des Blutes bedingt durch eine verminderte Säureausscheidung durch die Nieren). Früher wurde bei einer Niereninsuffizienz eine vorübergehende Hämodialyse zur Elimination von Kontrastmitteln mit Gadolinium anlässlich einer Magnetresonanztomographie empfohlen.[94]
Im Rahmen der sekundären Giftelimination können Dialyseverfahren die Elimination beschleunigen. Mit der Hämodialyse können beispielsweise Ethanol, Methanol, Ethylenglykol, Salicylate (Azetylsalizylsäure), Valproat, Carbamazepin, Phenytoin, Metformin, Kalzium und Lithium entfernt werden. Selten wird eine Hämoperfusion zur Beseitigung von Herbiziden, Alkylphosphaten und Theophyllin eingesetzt.[95]
Siehe auch
Literatur
- Hans Eduard Franz, Walter Hermann Hörl (Hrsg.): Blutreinigungsverfahren. 5. Auflage. Georg-Thieme-Verlag, Stuttgart / New York 1997, ISBN 3-13-497705-2, 586 Seiten.
- Zeitschrift Hämodialyse. Mitteilungsblatt der Interessengemeinschaft der Dialysepatienten Saar e. V. Band 1, 1973/1974 – Band 3, 1975, ZDB-ID 224632-6, fortgesetzt als: Der Dialysepatient. Offizielles Organ des Bundesverbandes Niere e. V. Band 1, 1976 – 32, 2007, ISSN 0724-0252, fortgesetzt als: Der Nierenpatient. Offizielles Organ des Bundesverbandes Niere e. V. Band 33, 2008 – lfd., ISSN 1865-8822.
- Zeitschrift Diatra (Kunstwort aus „Dialyse“ und „Transplantation“).
- H. Bach: Die Entwicklung der künstlichen Nieren aus Hydrodiffusion und Hämodialyse. In: Jost Benedum (Hrsg.): Arbeiten zur Geschichte der Medizin in Gießen. Gießen 1983, Band 7.
- Gerd Breuch, Willi Servos: Dialyse für Einsteiger. Elsevier, Urban & Fischer, München u. a. 2007, ISBN 978-3-437-27790-0.
- Günther Schönweiß: Dialysefibel 2. Plädoyer für die individuelle Dialyse. 2., völlig neubearbeitete und erweiterte Auflage. abakiss, Bad Kissingen 1996, ISBN 3-931916-01-4.
- Jost Benedum: Georg Haas (1886–1971): Pionier der Hämodialyse. In: Medizinhistorisches Journal. Band 14, 1979, S. 196–217.
- Kidney International. Supplement 2008 Apr; Dialysis outcomes in Colombia (DOC) study: a comparison of patient survival on peritoneal dialysis vs hemodialysis in Colombia. Sanabria M1 et al.
- P. Cotovoio et al.: Better Outcomes of Peritoneal Dialysis in Diabetic Patients in spite of Risk of Loss of Autonomy for Home Dialysis. In: Perit Dial Int., 2014 Jan 2. .
- Steffen Geberth, Rainer Nowack: Praxis der Dialyse. 2. Auflage. Springer-Verlag, Berlin / Heidelberg 2014, ISBN 978-3-642-41207-3 (Print); ISBN 978-3-642-41208-0 (E-Book).
- Amitava Majumder, Anne Paschen: Ärztliche Arbeitstechniken. In: Jörg Braun, Roland Preuss (Hrsg.): Klinikleitfaden Intensivmedizin. 9. Auflage. Elsevier, München 2016, ISBN 978-3-437-23763-8, S. 29–93, hier: S. 60–66 (Dialyse).
Weblinks
- Bundesverband Niere e. V. Selbsthilfedachverband. Abgerufen am 31. Januar 2009.
- Verband Deutsche Nierenzentren (DN) e. V. Abgerufen am 31. Januar 2009.
- Der Blutfluß an der Dialysemaschine (Video). Abgerufen am 31. Januar 2009.
- Jörg Vienken: Von Genies und Erfindern. Die Anfänge der Dialysetechnik. (PDF; 18 MB)
Einzelnachweise
- ↑ Brockhaus Enzyklopädie, 19. Auflage. Verlag F. A. Brockhaus, Mannheim 1987, 3. Band, ISBN 3-7653-1103-0, S. 434.
- ↑ Reinhold Kluthe, Norbert Szczeponik: Nieren- und Hochdruckkrankheiten. Springer-Verlag, Berlin / Heidelberg, 1970, ISBN 978-3-540-79627-5, doi:10.1007/978-3-642-87634-9, Kapitel „Die chronische intermittierende Dialysebehandlung (‚Dauerdialyse‘)“, S. 103.
- ↑ Manfred Vasold: Dialyse. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. Walter de Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 304 f.; hier: S. 304.
- ↑ Jost Benedum: Die Frühgeschichte der künstlichen Niere. In: AINS. Anästhesiologie Intensivmedizin Notfallmedizin Schmerztherapie. Band 38, Nr. 11, November 2003, S. 681–688.
- ↑ Die Zeit: Das Lexikon in 20 Bänden. Zeitverlag, 8. Band, Hamburg 2005, ISBN 978-3-411-17568-0, S. 380.
- ↑ Ludwig August Kraus: Kritisch-etymologisches medicinisches Lexikon, 3. Auflage, Verlag der Deuerlich- und Dieterichschen Buchhandlung, Göttingen 1844, S. 308. archive.org; archive.org.
- ↑ Immanuel Munk: Stichwort: Dialyse. In: Albert Eulenburg (Hrsg.): Real-Encyclopädie der gesammten Heilkunde. 2. Auflage, 5. Band, Verlag Urban & Schwarzenberg, Wien / Leipzig 1886, S. 319 f. – Wörtlich auch in Band 4, Wien / Leipzig 1885, S. 379, beim Stichwort Colloide vom selben Autor.
- ↑ Thomas Graham, Annalen der Chemie, Band LXXVII, S. 56 und Band CXXI, S. 28.
- ↑ Eckhard, Beiträge zur Anatomie und Physiologie, Band III, S. 51.
- ↑ Otto Roth: Roth's klinische Terminologie. 10. Auflage von Karl Doll und Hermann Doll, Georg Thieme Verlag, Leipzig 1925, S. 129.
- ↑ Meyers Kleines Lexikon. 9. Auflage, 1. Band, Bibliographisches Institut, Leipzig 1933, S. 481.
- ↑ John Jacob Abel, Leonard George Rowntree, B. B. Turner: On the removal of diffusable substances from the circulating blood by means of dialysis. In: Transactions of the Association of American Physicians. Band 28, 1913, S. 51–54.
- ↑ Jost Benedum: Die Frühgeschichte der künstlichen Niere. In: AINS. Anästhesiologie Intensivmedizin Notfallmedizin Schmerztherapie. Band 38, Nr. 11, November 2003, S. 681–688, hier: S. 684 f.
- ↑ Volkmar Heinze: Dialyse. In: Hans Joachim Sarre: Nierenkrankheiten. 4. Auflage. Georg Thieme Verlag, Stuttgart 1976, ISBN 3-13-392804-X, S. 559.
- ↑ Jost Benedum: Die Frühgeschichte der künstlichen Niere. In: AINS. Anästhesiologie Intensivmedizin Notfallmedizin Schmerztherapie. Band 38, Nr. 11, November 2003, S. 681–688, hier: S. 687.
- ↑ Georg Haas: Versuche der Blutauswaschung am Lebenden mit Hilfe der Dialyse. In: Klinische Wochenschrift, Band 4, Nummer 1, Januar 1925, S. 13 f.
- ↑ Jost Benedum: Die Frühgeschichte der künstlichen Niere. In: AINS. Anästhesiologie Intensivmedizin Notfallmedizin Schmerztherapie. Band 38, Nr. 11, November 2003, S. 681–688.
- ↑ In Memoriam: Skeggs worked on artificial kidney. In: Campus News, Case Western Reserve University, 2. Dezember 2004.
- ↑ Jost Benedum: Die Frühgeschichte der künstlichen Niere. 2003, S. 687.
- ↑ Stephen Rosenak, P. Siwon: Experimentelle Untersuchungen über die peritoneale Ausscheidung harnpflichtiger Substanzen aus dem Blute. In: Mitteilungen aus den Grenzgebieten der Medizin und Chirurgie, 39. Jahrgang, 1926.
- ↑ M. Teschner, A. Klassen, R. Schmidt, G. Kraatz und A. Heidland: Georg Ganter – ein Pionier der Peritonealdialysetherapie. In: Nieren- und Hochdruckkrankheiten, Jahrgang 32, Nr. 3/2003, S. 9
- ↑ Heinrich Heusser, Hermann Werder: Untersuchungen über Peritonealdialyse. Bruns'sche Beiträge zur klinischen Chirurgie 14, 1927, S. 28–32
- ↑ María Mercedes Moreiras-Plaza: Where we come from and where we are going in terms of peritoneal dialysis: identifying barriers and strategies for the future. In: Nefrologia, Jahrgang 34, Nr. 5/2014, S. 545 fl
- ↑ M. Plail: Peritonealer Stoff- und Flüssigkeitstransport und peritoneale Immunkompetenz an der automatisierten Peritonealdialyse (APD) nach Langzeitbehandlung mittels Bikarbonat/Laktat gepuffertem Dialysat. Ein Vergleich zu Laktat gepuffertem Dialysat. Heinrich-Heine-Universität Düsseldorf 2006, S. 1
- ↑ Franz Volhard: Die Behandlung der echten Urämie. In: Gustav von Bergmann, Rudolf Staehelin (Hrsg.): Handbuch der inneren Medizin, Verlag von Julius Springer, 2. Auflage, 6. Band, 1. Teil: Nieren und ableitende Harnwege, bearbeitet von Franz Volhard und Friedrich Suter, Berlin 1931, S. 804–811, Zitat S. 808.
- ↑ E. Quellhorst: Peritonealdialyse. In: Psychonephrologie, Springer 1985, S. 127
- ↑ Ernst Lauda: Lehrbuch der inneren Medizin, Springer-Verlag, 3. Band, Wien 1951, S. 226.
- ↑ Robert Heintz: Nierenfibel für Klinik und Praxis. Georg Thieme Verlag, Stuttgart 1964, S. 167.
- ↑ Jörg Dötsch, Lutz T. Weber (Hrsg.): Nierenerkrankungen im Kindes- und Jugendalter. Springer-Verlag, Berlin 2017, ISBN 978-3-662-48788-4, S. 219 und 229.
- ↑ Amitava Majumder, Anne Paschen: Ärztliche Arbeitstechniken. In: Jörg Braun, Roland Preuss (Hrsg.): Klinikleitfaden Intensivmedizin. 9. Auflage. Elsevier, München 2016, ISBN 978-3-437-23763-8, S. 29–93, hier: S. 62–66 (Dialyseverfahren).
- ↑ Amitava Majumder, Anne Paschen: Ärztliche Arbeitstechniken. In: Jörg Braun, Roland Preuss (Hrsg.): Klinikleitfaden Intensivmedizin. 9. Auflage. Elsevier, München 2016, ISBN 978-3-437-23763-8, S. 29–93, hier: S. 62–66 (Dialyseverfahren), insbesondere S. 62.
- ↑ a b Nierenersatztherapie: CORETH-Forschungsprojekt liefert neue Erkenntnisse zur Verfahrenswahl, PM der Deutschen Gesellschaft für Nephrologie vom 18. Oktober 2017, abgerufen am 14. Dezember 2018
- ↑ Dialyse - Was ist das?, Apotheken Umschau, abgerufen am 14. Dezember 2018
- ↑ Jay B. Wish, George R. Aronoff, Bruce R. Bacon, Carlo Brugnara, Kai-Uwe Eckardt: Positive Iron Balance in Chronic Kidney Disease: How Much is Too Much and How to Tell? In: American Journal of Nephrology. Band 47, Nr. 2, 2018, ISSN 1421-9670, S. 72–83, doi:10.1159/000486968, PMID 29439253 (englisch).
- ↑ Jay B. Wish, George R. Aronoff, Bruce R. Bacon, Carlo Brugnara, Kai-Uwe Eckardt: Positive Iron Balance in Chronic Kidney Disease: How Much is Too Much and How to Tell? In: American Journal of Nephrology. Band 47, Nr. 2, 2018, ISSN 1421-9670, S. 72–83, doi:10.1159/000486968, PMID 29439253 (englisch).
- ↑ Iain C. Macdougall, Claire White, Stefan D. Anker, Sunil Bhandari, Kenneth Farrington: Intravenous Iron in Patients Undergoing Maintenance Hemodialysis. In: The New England Journal of Medicine. Band 380, Nr. 5, 31. Januar 2019, ISSN 0028-4793, S. 447–458, doi:10.1056/NEJMoa1810742 (englisch, Online [abgerufen am 4. März 2019]).
- ↑ Eric D. Weinhandl et al.: Propensity-Matched Mortality Comparison of Incident Hemodialysis and Peritoneal Dialysis Patients. In: Journal of the American Society of Nephrology: JASN. Band 21, Nr. 3, März 2010, S. 499–506, doi:10.1681/ASN.2009060635, PMID 20133483, PMC 2831857 (freier Volltext) – (englisch).
- ↑ J. G. Heaf et al.: Relative Survival of Peritoneal Dialysis and Haemodialysis Patients: Effect of Cohort and Mode of Dialysis Initiation. In: PLoS One. März 2014, doi:10.1371/journal.pone.0090119 (englisch).
- ↑ M. W. Van de Luijtgaarden et al.: Trends in dialysis modality choice and related patient survival in the ERA-EDTA Registry over a 20-year period. In: Nephrology Dialysis Transplantation. Band 31, Nr. 1, Januar 2016, S. 120–128, doi:10.1093/ndt/gfv295, PMID 26311215 (englisch).
- ↑ B. Waldum-Grevbo et al.: Impact of initial dialysis modality on mortality: a propensity-matched study. In: BMC Nephrology:179. Band 16, Juni 2015, S. 179, doi:10.1186/s12882-015-0175-5, PMID 26519164, PMC 4628291 (freier Volltext) – (englisch).
- ↑ R. Saran, B. Robinson, K. C. Abbott et al.: US Renal Data System 2017 Annual Data Report: epidemiology of kidney disease in the United States. In: American Journal of Kidney Diseases. Band 71, 3 (suppl 1), 2018, S. 1–673, doi:10.1053/j.ajkd.2018.01.002, PMID 29477157 (englisch).
- ↑ Jahn M et al.: Neue Indikationen für die Peritonealdialyse. In: Nephrologe. Band 12, 2017, S. 6–13.
- ↑ a b M. Sanabria, J. Muñoz, C. Trillos, G. Hernández, C. Latorre, C. S. Díaz, S. Murad, K. Rodríguez, A. Rivera, A. Amador, F. Ardila, A. Caicedo, D. Camargo, A. Díaz, J. González, H. Leguizamón P. Lopera, Marín L, I. Nieto, E. Vargas: Dialysis outcomes in Colombia (DOC) study: a comparison of patient survival on peritoneal dialysis vs hemodialysis in Colombia. In: Kidney International Supplement. 2008 Apr.
- ↑ L. Troidle, F. Finkelstein: Treatment and outcome of CPD-associated peritonitis. In: Ann Clin Microbiol Antimicrob. 5, 2006, S. 6.
- ↑ Thomas Mettang: Ultrafiltrationsversagen. In: Ulrich Kuhlmann, Joachim Böhler, Friedrich C. Luft, Mark Dominik Alscher, Ulrich Kunzendorf (Hrsg.): Nephrologie. 6. Auflage, Georg Thieme Verlag, Stuttgart / New York 2015, ISBN 978-3-13-700206-2, S. 745 f.
- ↑ W. Koller, T. H. Luger, Ch. Putensen, G. Putz: Blutreinigende Verfahren in der Intensivmedizin. In: Jürgen Kilian, H. Benzer, Friedrich Wilhelm Ahnefeld (Hrsg.): Grundzüge der Beatmung. Springer-Verlag, Berlin u. a. 1991, ISBN 3-540-53078-9; 2., unveränderte Auflage, ebenda 1994, ISBN 3-540-57904-4, S. 404–419; hier: S. 408.
- ↑ Michael Heck, Michael Fresenius: Repetitorium Anaesthesiologie. Vorbereitung auf die anästhesiologische Facharztprüfung und das Europäische Diplom für Anästhesiologie. 3., vollständig überarbeitete Auflage. Springer, Berlin / Heidelberg / New York u. a. 2001, ISBN 3-540-67331-8, S. 804.
- ↑ Amitava Majumder, Anne Paschen: Ärztliche Arbeitstechniken. 2016, S. 62 f.
- ↑ Quelle: DocCheck Flexikon: Stichwort Dialyse. – Andere Ansicht: „Die Indikation zum Beginn ist gegeben bei Kreatinin > 6 mg/dl.“ Quelle: Ulrich Thomae: Niereninsuffizienz. Reihe Herz Kreislauf – Aktuelles Wissen Hoechst, Hoechst Aktiengesellschaft 1989, S. 129.
- ↑ Ulrich Thomae: Niereninsuffizienz. Reihe Herz Kreislauf – Aktuelles Wissen Hoechst, Hoechst Aktiengesellschaft 1989, S. 129.
- ↑ Hans Joachim Sarre: Nierenkrankheiten. 4. Auflage. Georg Thieme Verlag, Stuttgart 1976, ISBN 3-13-392804-X, S. 603.
- ↑ Joachim Hoyer: Chronische Nierenerkrankung. In: Ulrich Kuhlmann, Joachim Böhler, Friedrich C. Luft, Mark Dominik Alscher, Ulrich Kunzendorf (Hrsg.): Nephrologie. 6. Auflage, Georg Thieme Verlag, Stuttgart / New York 2015, ISBN 978-3-13-700206-2, S. 300–471, Zitat S. 459, Tabelle 8.10.
- ↑ R. M. Hakim, J. M. Lazarus: Initiation of dialysis. In: Journal of the American Society of Nephrology, 6. Jahrgang, Mai 1995, S. 1319–1328.
- ↑ Group KDIGOCW (Kidney Disease: Improving Global Outcomes), KDIGO 2012: Clinical practice guideline for the evaluation and management of chronic kidney disease. In: Kidney International Supplement 2013, Band 3, S. 1–150.
- ↑ Martin K. Kuhlmann: Hämodialyse. In: Mark Dominik Alscher: Referenz Nephrologie. Georg Thieme Verlag, Stuttgart 2019, ISBN 978-3-13-240001-6, DOI:10.1055/b-0039-171076, S. 610–660.
- ↑ U. Thomae, Johannes Mann: Indikationen und Kontraindikationen zur Langzeitdialyse. In: Hans Eduard Franz, Walter Hermann Hörl (Hrsg.): Blutreinigungsverfahren. 5. Auflage. Georg Thieme Verlag, Stuttgart / New York 1997, ISBN 3-13-497705-2, S. 56–60.
- ↑ Hugh C. Rayner: Approach to Renal Replacement Therapy. In: John Feehally, Jürgen Floege, Richard J. Johnson: Comprehensive Clinical Nephrology. 3. Auflage, Mosby Elsevier Verlag, Philadelphia 2007, ISBN 978-0-323-04602-2, S. 917–928, Zitat S. 920.
- ↑ Gerd Harald Herold und Mitarbeiter: Innere Medizin 2023, Selbstverlag, Köln 2023, ISBN 978-3-9821166-2-4, S. 645.
- ↑ Horst-Walter Birk: Fort- und Weiterbildung Peritonealdialyse – VNR: 2760602023210520004, in: Hessisches Ärzteblatt, Jahrgang 2023, Nummer 7/8, S. 433.
- ↑ Thomas Mettang: Bestimmung der Funktionsparameter des Peritoneums. In: Ulrich Kuhlmann, Joachim Böhler, Friedrich C. Luft, Mark Dominik Alscher, Ulrich Kunzendorf (Hrsg.): Nephrologie. 6. Auflage, Georg Thieme Verlag, Stuttgart / New York 2015, ISBN 978-3-13-700206-2, S. 719–722.
- ↑ F. Schaefer, Markus Daschner: Blutreinigungsverfahren im Kindesalter. In: Karl Schärer, Otto Mehls (Hrsg.): Pädiatrische Nephrologie. Springer-Verlag, Berlin / Heidelberg 2002, ISBN 3-540-41912-8, S. 391–415, Zitat S. 397.
- ↑ Tinsley Randolph Harrison: Innere Medizin. Sonderausgabe, 17. Auflage, McGraw-Hill, Berlin 2009, Band 2, S. 2185.
- ↑ Fresenius Medical Care: 5008 OP-DE 10/06.12, Seite 4-1, Beschreibung 4.4.17.2, Begriffserklärungen.
- ↑ Willibald Pschyrembel: Klinisches Wörterbuch, 269. Auflage, Verlag Walter de Gruyter, Berlin / Boston 2023, ISBN 978-3-11-078334-6, S. 390.
- ↑ Martin K. Kuhlmann: Therapeutische Verfahren in der Nephrologie. In: Mark Dominik Alscher: Referenz Nephrologie. Georg Thieme Verlag, Stuttgart 2019, ISBN 978-3-13-240001-6, DOI:10.1055/b-0039-171076, S. 610–660, Zitat S. 618.
- ↑ Peter Kotanko, Martin K. Kuhlmann, Nathan W. Levin: Hemodialysis: Technology, Adequacy, and Outcomes. In: John Feehally, Jürgen Floege, Richard J. Johnson: Comprehensive Clinical Nephrology. 3. Auflage, Mosby Elsevier Verlag, Philadelphia 2007, ISBN 978-0-323-04602-2, S. 953–966, Zitat S. 961.
- ↑ Jörg Dötsch, Lutz T. Weber (Hrsg.): Nierenerkrankungen im Kindes- und Jugendalter. Springer-Verlag, Berlin 2017, ISBN 978-3-662-48788-4, S. 223 und 236.
- ↑ Wim van Biesen: Peritoneal dialysis in acute kidney injury. In: Neil Turner, Norbert Lameire, David J. Goldsmith, Christopher G. Winearls, Jonathan Himmelfarb, Giuseppe Remuzzi (Hrsg.): Oxford Textbook of Clinical Nephrology. 4. Auflage, 2. Band, Oxford University Press, Oxford 2016, ISBN 978-0-19-870859-9, Kapitel 235, S. 1989–1997, Zitat S. 1991 (Dose of dialysis).
- ↑ Eduard Quellhorst: Technik und Durchführung der Hämodialysetherapie bei chronischem Nierenversagen. In: Horst Brass, Thomas Philipp, Walter Schulz (Hrsg.): Manuale nephrologicum. Loseblattsammlung, Dustri-Verlag Dr. Karl Feistle, Deisenhofen 1997, ISBN 3-87185-222-8, Band 2, Kapitel X-3, S. 1–6, Zitat S. 6 (Absatz Quantität und Qualität der Dialyse).
- ↑ Gerd Harald Herold et alii: Innere Medizin 2023, Selbstverlag, Köln 2023, ISBN 978-3-9821166-2-4, S. 645.
- ↑ Maxim Zetkin, Herbert Schaldach: Lexikon der Medizin, 16. Auflage, Ullstein Medical, Wiesbaden 1999, ISBN 978-3-86126-126-1, S. 431.
- ↑ Consilium Cedip Practicum 2006, 28. Auflage, JMS Verlag und Industrieservice, Dortmund 2005, ISBN 3-9810440-1-0, S. 835.
- ↑ H. H. Malluche, P. Sawaya: Renale Knochenerkrankung. In: Hans Eduard Franz, Walter Hermann Hörl (Hrsg.): Blutreinigungsverfahren. 5. Auflage. Georg Thieme Verlag, Stuttgart / New York 1997, ISBN 3-13-497705-2, S. 272–302, Zitat S. 284.
- ↑ H. V. Henning, G. Delling: Renale Osteopathie. In: Hans Hornbostel, Werner Kaufmann, Walter Siegenthaler (Hrsg.): Innere Medizin in Praxis und Klinik. 2. Band (Niere, Wasser-, Elektrolyt- und Säure-Basen-Haushalt), 4. Auflage, Georg Thieme Verlag, Stuttgart / New York 1992, ISBN 3-13-491204-X, S. 9.55 und 9.66.
- ↑ Anne-Laure Faucon, Catherine M. Clase, Helena Rydell, Milica Uhde, Peter Barany, Marie Evans, Juan-Jesús Carrero: Burden of CKD-Associated Pruritus and Adverse Clinical Outcomes in Patients Receiving Dialysis: The Stockholm CREAtinine Measurements (SCREAM) Project. In: American Journal of Kidney Diseases vom 25. Juli 2024.
- ↑ Peter Altmeyer, C. Nüchel: Hauterkrankungen. In: Hans Eduard Franz, Walter Hermann Hörl (Hrsg.): Blutreinigungsverfahren. 5. Auflage. Georg Thieme Verlag, Stuttgart / New York 1997, ISBN 3-13-497705-2, S. 323–329.
- ↑ Peter Altmeyer: Therapielexikon Dermatologie und Allergologie. 2. Auflage, Springer-Verlag, Berlin / Heidelberg 2005, ISBN 3-540-23781-X, S. 1097.
- ↑ Roche Lexikon Medizin., Roche Lexikon Medizin, 5. Auflage. Urban & Fischer, München / Jena 2003, ISBN 3-437-15156-8, S. 424.
- ↑ Hexal Lexikon Orthopädie – Rheumatologie, Verlag Urban & Schwarzenberg, München / Wien / Baltimore 1992, ISBN 3-541-16421-2, S. 234.
- ↑ Roche Lexikon Medizin., Roche Lexikon Medizin, 5. Auflage. Verlag Urban & Fischer, München / Jena 2003, ISBN 3-437-15156-8, S. 424.
- ↑ J. E. Z. Caner, L. Decker: Recurrent acute (? gouty) arthritis in chronic renal failure treated with periodic hemodialysis. In: The American Journal of Medicine, Band 36, 1964, S. 571.
- ↑ Robert Heintz: Erscheinungen am Muskel- und Skelettsystem bei Niereninsuffizienz. In: Herbert Schwiegk (Hrsg.): Handbuch der inneren Medizin, 5. Auflage, 8. Band, 1. Teil (bearbeitet von Eberhard Buchborn, Karel Čapek, Peter Deetjen, J. Eigler, Konrad Federlin, Robert Heintz, J. Heller, Hans Jesserer, Arnold Kleinschmidt, Friedrich Krück, J. Martinek, Ernst-Friedrich Pfeiffer, Roland Richterich, Gerhard Riecker, Klaus Thurau, F. Wahlig, H. Wirz, Hans Ulrich Zollinger), Springer-Verlag, Berlin / Heidelberg / New York 1968, ISBN 3-540-04152-4, S. 727–730.
- ↑ D. Bundschu, Hans Eduard Franz: Dialyseassoziierte (β2-Mikroglobulin-)Amyloidose. In: Hans Eduard Franz, Walter Hermann Hörl (Hrsg.): Blutreinigungsverfahren. 5. Auflage. Georg Thieme Verlag, Stuttgart / New York 1997, ISBN 3-13-497705-2, S. 455–460.
- ↑ S. P. Y. Wong, T. Rubenzik, L. Zelnick, S. N. Davison, D. Louden, T. Oestreich: Long-term Outcomes Among Patients With Advanced Kidney Disease Who Forgo Maintenance Dialysis: A Systematic Review. In: The Journal of the American Medical Association JAMA Netw Open. 5. Jahrgang, Nr. 3, 2022, S. e222255, doi:10.1001/jamanetworkopen.2022.2255, PMID 35285915, PMC 9907345 (freier Volltext) – (englisch, nih.gov).
- ↑ C. K. Liu, M. Kurella Tamura: Conservative Care for Kidney Failure-The Other Side of the Coin. In: JAMA network open. Band 5, Nummer 3, März 2022, S. e222252, doi:10.1001/jamanetworkopen.2022.2252, PMID 35285925.
- ↑ Beate Schumacher: Prognose nach Verweigerung der Dialyse. In: Info Diabetologie. 2022, Band 16, Nummer 2, S. 28 doi:10.1007/s15034-022-3827-0.
- ↑ L. E. Buur, J. K. Madsen, I. Eidemak, E. Krarup, T. G. Lauridsen, L. H. Taasti: Does conservative kidney management offer a quantity or quality of life benefit compared to dialysis? A systematic review. In: BMC Nephrol. 22. Jahrgang, Nr. 1, 2021, S. 307, doi:10.1186/s12882-021-02516-6, PMID 34507554, PMC 8434727 (freier Volltext) – (englisch, nih.gov).
- ↑ Maria E. Montez-Rath, I-Chun Thomas, Vivek Charu, Michelle C. Odden, Carolyn D. Seib, Shipra Arya, Enrica Fung, Ann M. O’Hare, Susan P.Y. Wong, Manjula Kurella Tamura: Effect of Starting Dialysis Versus Continuing Medical Management on Survival and Home Time in Older Adults With Kidney Failure: A Target Trial Emulation Study. In: Annals of Internal Medicine, 20. August 2024, doi:10.7326/M23-3028.
- ↑ Susanne D. Kuhlmann: Dialyseabbruch und -vorenthalt: Juristische und ethische Aspekte. In: Ute Hoffmann, Wolfgang Pommer (Hrsg.): Geriatrische Nephrologie. Springer-Verlag, Berlin 2023, ISBN 978-3-662-65647-1, S. 345–351.
- ↑ François Reubi: Nierenkrankheiten. Verlag Hans Huber, 3. Auflage, Bern / Stuttgart / Wien 1982, ISBN 3-456-81140-3, S. 555.
- ↑ Markus Daschner: Tabellarum nephrologicum. 3. Auflage. Shaker Verlag, Aachen 2009, ISBN 978-3-8322-7967-7, S. 54 f. und 110.
- ↑ Markus Kosch, Ulf Gerhardt, Roland M. Schäfer: Blutreinigungsverfahren. In: Helmut Geiger, Dietger Jonas, Tomas Lenz, Wolfgang Kramer (Hrsg.): Nierenerkrankungen. Schattauer Verlag, Stuttgart / New York 2003, ISBN 3-7945-2177-3, S. 199–234, Zitat S. 199.
- ↑ Wolfgang Piper: Innere Medizin. Springer Verlag, Springer-Lehrbuch, Heidelberg 2007, ISBN 978-3-540-33725-6, S. 441.
- ↑ Bernd Haubitz, Marion Haubitz: Bildgebende Verfahren. In: Karl-Martin Koch: Klinische Nephrologie. Verlag Urban & Fischer, München / Jena 2000, ISBN 3-437-21730-5, S. 118–132, Zitat S. 120.
- ↑ Gerd Harald Herold und Mitarbeiter: Innere Medizin 2023, Selbstverlag, Köln 2023, ISBN 978-3-9821166-2-4, S. 940.
Auf dieser Seite verwendete Medien
Autor/Urheber: Superikonoskop, Lizenz: CC BY-SA 4.0
Nachbau der 1924 erstmals an Menschen eingesetzten, von Georg Haas entwickelten künstlichen Niere. Als Membran dienten Kollodiumröhren. Dialysemuseum Fürth
Autor/Urheber: Anna Frodesiak, Lizenz: CC0
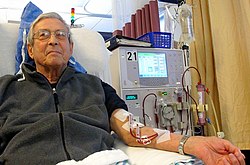
Patient receiving dialysis.
(c) Bundesarchiv, Bild 183-S0104-0301 / CC-BY-SA 3.0
Temporal catheter for hemodialysis
Autor/Urheber: Rob Koopman from Leiderdorp, Netherlands, Lizenz: CC BY-SA 2.0
Museum Boerhaave walk-through