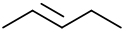
Pentene
Pentene (auch Amylene genannt) sind Kohlenwasserstoffe mit der Summenformel C5H10, die über eine Kohlenstoff-Kohlenstoff-Doppelbindung (kurz C=C-Doppelbindung) verfügen. Sie gehören somit zur Gruppe der Alkene. Es gibt fünf konstitutionsisomere Pentene,[1] von denen Pent-2-en als cis- oder trans-Isomer vorliegen kann. Als Isomerengemisch kommen Pentene in Crackgasen und im Erdgas vor. Ein weiteres Konstitutionsisomer ist das Cyclopentan, das allerdings kein Penten ist.
Struktur und Eigenschaften
| Pentene | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Name | Pent-1-en | cis-Pent-2-en | trans-Pent-2-en | |||||||
| Andere Namen | 1-Penten, Amylen | (Z)-Pent-2-en β-Amylen | (E)-Pent-2-en β-Amylen | |||||||
| Strukturformel | ||||||||||
| CAS-Nummer | 109-67-1 | 627-20-3 | 646-04-8 | |||||||
| 109-68-2 (Isomerengemisch) | ||||||||||
| Summenformel | C5H10 | |||||||||
| Molare Masse | 70,13 g·mol−1 | |||||||||
| Kurzbeschreibung | farblose, niedrig siedende, hochentzündliche Flüssigkeiten | |||||||||
| Schmelzpunkt | −138 °C | −151,4 °C | −136 °C | |||||||
| Siedepunkt | 30 °C | 36,9 °C | 36,3 °C | |||||||
| Löslichkeit | unlöslich in Wasser, leicht löslich in Ethanol und Ether | |||||||||
| GHS- Kennzeichnung |
| |||||||||
| H- und P-Sätze | 224‐304‐315‐319 | 225‐304‐315‐319‐335 | 224‐304‐315‐319‐335 | |||||||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | ||||||||
| 210‐301+310 305+351+338‐331 | 210‐261‐301+310 305+351+338‐331 | 210‐261‐301+310 305+351+338‐331 | ||||||||
| Pentene (Fortsetzung) | ||||||||||
| Name | 2-Methyl-but-1-en | 2-Methyl-but-2-en | 3-Methyl-but-1-en | |||||||
| Andere Namen | γ-Isoamylen | β-Isoamylen | α-Isoamylen, 2-Methyl-but-3-en | |||||||
| Strukturformel | ||||||||||
| CAS-Nummer | 563-46-2 | 513-35-9 | 563-45-1 | |||||||
| Summenformel | C5H10 | |||||||||
| Molare Masse | 70,13 g·mol−1 | |||||||||
| Kurzbeschreibung | farblose, niedrig siedende, hochentzündliche Flüssigkeiten | |||||||||
| Schmelzpunkt | −137,5 °C | −133,8 °C | −169,5 °C | |||||||
| Siedepunkt | 31,2 °C | 38,6 °C | 20,1 °C | |||||||
| Löslichkeit | unlöslich in Wasser, leicht löslich in Ethanol und Ether | |||||||||
| GHS- Kennzeichnung |
|
|
| |||||||
| H- und P-Sätze | 224‐304 | 225‐302 | 224‐304‐315‐319‐335 | |||||||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | ||||||||
| 210‐301+310‐331 | 210 | 210‐261‐301+310‐305+351+338‐331 | ||||||||
Die Dampfdruckfunktionen ergeben sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) wie folgt:
Dampfdruckfunktionen der Pentene T (K) A B C 1-Penten[8] 285,98–303,87 3,91058 1014,294 −43,367 cis-2-Penten[9] 274,74–342,03 3,99984 1069,229 −42,393 trans-2-Penten[9] 274,18–341,36 4,03089 1084,165 −40,158 2-Methyl-1-buten[10] 274,30–335,82 3,98652 1047,811 −41,089 2-Methyl-2-buten[10] 276,19–343,74 4,04727 1098,619 −39,889 3-Methyl-1-buten[9] 273,37–324,29 3,95126 1013,575 −36,32
Gewinnung
Pentene sind Bestandteile in Steinkohlenteer, in Schieferöl, in Crackgasen und Crackbenzin und können durch fraktionierte Destillation gewonnen werden. Bei einer Pyrolyse von Kautschuk bildet sich unter anderen 2-Methyl-but-1-en und 2-Methyl-but-2-en.
Pentene bilden sich durch Dehydratisierung (Eliminierung von Wasser) aus Pentanolen (sog. Amylalkoholen). Auf diesem Weg lassen sich z. B. aus Fuselölen Pentene (sog. Fuselölamylen) gewinnen.
Verwendung
Pentene werden zur Synthese von Amylphenolen, Isopren und Pentanolen eingesetzt, sowie zur Polymerisation verwendet. Außerdem werden Amylene als Stabilisatoren Chloroform und Dichlormethan zugesetzt, um das unter Luft- und Lichteinfluss entstehende Phosgen abzufangen.[11]
Einzelnachweise
- ↑ Number of ethylene derivatives with n carbon atoms. In: The On-Line Encyclopedia of Integer Sequences. Abgerufen am 10. September 2021.
- ↑ Datenblatt 1-Pentene bei Sigma-Aldrich, abgerufen am 6. Mai 2011 (PDF).
- ↑ Datenblatt cis-2-Pentene bei Sigma-Aldrich, abgerufen am 6. Mai 2011 (PDF).
- ↑ Datenblatt trans-2-Pentene bei Sigma-Aldrich, abgerufen am 6. Mai 2011 (PDF).
- ↑ Datenblatt 2-Methyl-1-butene bei Sigma-Aldrich, abgerufen am 6. Mai 2011 (PDF).
- ↑ Datenblatt 2-Methyl-2-butene bei Sigma-Aldrich, abgerufen am 6. Mai 2011 (PDF).
- ↑ Datenblatt 3-Methyl-1-butene bei Sigma-Aldrich, abgerufen am 6. Mai 2011 (PDF).
- ↑ A. F. Forziati, D. L. Camin, F. D. Rossini: Density, refractive index, boiling point, and vapor pressure of eight monoolefin (1-alkene), six pentadiene, and two cyclomonoolefin hydrocarbons. In: J. Res. NBS. 45, 1950, S. 406–410.
- ↑ a b c D. W. Scott, G. Waddington: Vapor Pressure of cis-2-Pentene, trans-2-Pentene and 3-Methyl-1-Butene. In: J. Am. Chem. Soc. 72, 1950, S. 4310–4311, (doi:10.1021/ja01165a542).
- ↑ a b D. W. Scott, G. Waddington, J. C. Smith, H. M. Huffman: Thermodynamic properties of three isomeric pentenes. In: J. Am. Chem. Soc. 71, 1949, S. 2767–2773 (doi:10.1021/ja01176a050).
- ↑ Patent DE2714836C2: Stabilisierte Methylenchloridzusammensetzung sowie deren Verwendung zur Dampfentfettung von Metallen. Angemeldet am 2. April 1977, veröffentlicht am 17. Dezember 1987, Anmelder: Stauffer Chemical Co, Erfinder: Mazin Rida Irani.
Weblinks
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Skelettformel von 3-Methyl-but-1-en (2-Methyl-but-3-en).
chem. Struktur von 2-Methyl-but-2-en, ein Penten
chem. Struktur von cis-Pent-2-en, ein Penten
chem. Struktur von 2-Methyl-but-1-en, ein Penten
chem. Struktur von Pent-1-en, ein Penten