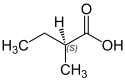Pentansäuren
Die Pentansäuren (auch Valeriansäuren) sind eine Gruppe von konstitutionsisomeren gesättigten Monocarbonsäuren mit fünf Kohlenstoffatomen. Sie haben die allgemeine Summenformel C5H10O2 und eine molare Masse von 102,13 g/mol. Man kann sie sich zusammengesetzt vorstellen aus einer Butyl- und einer Carboxygruppe (–COOH); damit sind alle vier Varianten (Strukturisomere) vertreten, die sich in ihren Eigenschaften teils deutlich unterscheiden. Die 2-Methylbuttersäure kommt zudem in zwei enantiomeren Formen – der (R)-Form und der (S)-Form – vor, die sich zusätzlich untereinander in ihren physiologischen Eigenschaften unterscheiden. Somit gibt es insgesamt fünf isomere Pentansäuren.
| Pentansäuren | |||||
| Name | Valeriansäure | Isovaleriansäure | 2-Methylbuttersäure | Pivalinsäure | |
| Andere Namen | n-Pentansäure | iso-Pentansäure | sec-Pentansäure | tert-Pentansäure | |
| Strukturformel |  |  |  (R)-(–)-2-Methylbuttersäure |  (S)-(+)-2-Methylbuttersäure |  |
| CAS-Nummer | 109-52-4 | 503-74-2 | 32231-50-8 | 1730-91-2 | 75-98-9 |
| PubChem | 7991 | 10430 | 8314 (Racemat, CAS-Nummer: 116-53-0) | 6417 | |
| Schmelzpunkt | −33,6 °C bis −34 °C[1][2] | <−30 °C[3] | < −80 °C (Racemat)[4] | 35–36 °C[5][6] | |
| Siedepunkt | 184–187 °C[7] | 175–177 °C[3] | 177 °C (Racemat)[4] | 163–164 °C[8] | |
| Wasserlöslichkeit | 40 g·l−1 bei 20 °C[9] | 25 g·l−1 bei 20 °C[10] | 20 g·l−1 bei 20 °C (Racemat)[11] | 25 g·l−1 bei 20 °C[12] | |
| Geruch | unangenehm[9] | unangenehm[10] | durchdringend käsig, schweißig[13] | angenehm süß, fruchtig[13] | unangenehm[8] |
Vorkommen und Verwendung

Valeriansäure kommt in der Natur in Holzessig, Isovaleriansäure in etherischen Ölen, Teeblättern und Baldrianwurzeln, (R)-2-Methylbuttersäure in Kakaobohnen, (S)-2-Methylbuttersäure in vielen Früchten wie Äpfeln und Aprikosen vor.[14][15] Pivalinsäure ist eine synthetische Substanz. Die natürlichen Pentansäuren werden als Ester für Aromastoffe verwendet, Isovaleriansäure auch zur Herstellung von Sedativa und Hypnotika. Pivalinsäure besitzt aufgrund der sterischen Hinderung des Stoffes Bedeutung im medizinischen Bereich als geschützter Ester, der nur langsam gespalten und resorbiert wird (z. B. als Testosteronpivalat).
Nomenklatur
Nach der IUPAC-Nomenklatur werden Verbindungen mit einer acyclischen Pentan-Struktureinheit als unverzweigte Hauptkette, bei denen die endständige Methylgruppe durch eine Carboxygruppe ersetzt ist, als Pentansäure bezeichnet. Eine zulässige, aber nicht bevorzugte Alternativbezeichnung ist Butancarbonsäure.[16]
Neben der Stammverbindung Valeriansäure existieren daher zahlreiche weitere alkylsubstituierte Monocarbonsäuren ohne zusätzliche funktionelle Gruppen oder ungesättigten Substituenten, die als Petansäuren bezeichnet werden, jedoch nicht isomer zur Valeriansäure sind.
Beispiele:
- 4-Methylpentansäure (Isocapronsäure)
- 2-Propylpentansäure (Valproinsäure)
Einzelnachweise
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 96. Auflage. CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-438.
- ↑ Jürgen Falbe, Manfred Regitz: RÖMPP Lexikon Chemie. Band 6: T–Z, 10. Auflage, Thieme, 1999, ISBN 3-13-735110-3.
- ↑ a b Eintrag zu 3-Methylbuttersäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Februar 2017. (JavaScript erforderlich)
- ↑ a b David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-342. Nr. 7074.
- ↑ W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-220.
- ↑ Jürgen Falbe, Manfred Regitz: RÖMPP Lexikon Chemie. Band 2: Cm–G, 10. Auflage, Thieme, 1997, ISBN 3-13-734710-6, S. 991.
- ↑ Eintrag zu Valeriansäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Februar 2017. (JavaScript erforderlich)
- ↑ a b Eintrag zu 2,2-Dimethylpropionsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Februar 2017. (JavaScript erforderlich)
- ↑ a b Eintrag zu Pentansäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 6. Juli 2013.
- ↑ a b Eintrag zu 3-Methylbuttersäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 6. Juli 2013.
- ↑ Eintrag zu 2-Methylbuttersäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Februar 2017. (JavaScript erforderlich)
- ↑ Eintrag zu Versatic-Säuren. In: Römpp Online. Georg Thieme Verlag, abgerufen am 6. Juli 2013.
- ↑ a b H. Günzler: Analytiker-Taschenbuch 21. Springer DE, 2000, ISBN 3-540-66232-4, S. 39 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ „Wie kommt der Apfelsaft zu seinem Aroma?“
- ↑ Karl A. D. Swift: Current Topics in Flavours and Fragrances: Towards a New Millennium of Discovery. Springer, 1999, ISBN 0-7514-0490-X, S. 52 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Carboxylic Acids and their Derivatives. Simple Carboxylic Acids Rule C-401. In: IUPAC Nomenclature of Organic Chemistry. Advanced Chemistry Development, Inc.,, abgerufen am 13. August 2020 (englisch).
Auf dieser Seite verwendete Medien
Autor/Urheber: frank wouters aus antwerpen, belgium, Lizenz: CC BY 2.0
cacao seed, drying before toast
cacao
Struktur von Valeriansäure
Struktur von Isovaleriansäure (3-Methylbutansäure)
(S)-2-Methyl_Butyric_Acid-Structural_Formula
(R)-2-Methyl_Butyric_Acid-Structural_Formula
Strukturformel der Pivalinsäure