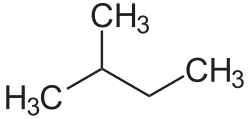
Pentane
| Eigenschaften der Pentane[1] | ||||
| Name | Pentan[2] | Isopentan[3] | Neopentan[4] | |
| Andere Namen | Pentan (IUPAC) | 2-Methylbutan | 2,2-Dimethylpropan | |
| Kältemittel | R-601 | R-601a | R-601b | |
| Strukturformel |  | |||
| CAS-Nummer | 109-66-0 | 78-78-4 | 463-82-1 | |
| PubChem | 8003 | 6556 | 10041 | |
| Summenformel | C5H12 | |||
| Molare Masse | 72,15 g·mol−1 | |||
| Kurzbeschreibung | farblose Flüssigkeiten | farbloses Gas | ||
| Schmelzpunkt | −130 °C | −160 °C | −16,6 °C | |
| Siedepunkt | 36 °C | 28 °C | 9,5 °C | |
| Dampfdruck (20 °C) | 562 mbar | 761 mbar | 1456 mbar | |
| Dampfdruck (30 °C) | 815 mbar | 1080 mbar | 2100 mbar | |
| Dampfdruck (50 °C) | 1590 mbar | 2042 mbar | 3700 mbar | |
| Dichte | 0,63 g·cm−3 | 0,62 g·cm−3 | 0,6135 g·cm−3 | |
| Löslichkeit in H2O | 39 mg·l−1 | 50 mg·l−1 | 33 mg·l−1 | |
| Flammpunkt | −49 °C | −57 °C | <–7 °C | |
| Heizwert | 12,6 kWh·kg−1 oder 45,4 MJ·kg−1 | |||
| Untere Explosionsgrenze (UEG) | 1,1 Vol.‑% | 1,3 Vol.‑% | 1,3 Vol.‑% | |
| 33 g·m−3 | 38 g·m−3 | 40 g·m−3 | ||
| Obere Explosionsgrenze (OEG) | 8,7 Vol.‑% | 7,6 Vol.‑% | 7,5 Vol.‑% | |
| 260 g·m−3 | 230 g·m−3 | 230 g·m−3 | ||
| Zündtemperatur | 260 °C | 420 °C | 450 °C | |
Pentane sind Kohlenwasserstoffe mit der Summenformel C5H12 und zählen zu den Alkanen. Es existieren drei Konstitutionsisomere: n-Pentan, Isopentan und Neopentan.
Der Name leitet sich von griech. "penta", fünf ab, das Molekül weist 5 Kohlenstoffatome auf. Auch alle größeren Alkanmoleküle werden analog nach Zahlwörtern benannt.
n-Pentan und Isopentan sind niedrig siedende Flüssigkeiten, die bei Raumtemperatur noch flüssig sind, auf warmer Haut jedoch sieden. Erst weit unter −100 °C werden sie fest. Neopentan hat einen noch niedrigeren Siedepunkt, ist also sogar bei Raumtemperatur schon gasförmig. Sein Schmelzpunkt ist jedoch im Vergleich zu den zwei Isomeren viel höher, die Schmelztemperatur von −16,6 °C bedeutet, Neopentan ist in einer Tiefkühltruhe fest.
Alle drei Isomere bilden farblos-klare Flüssigkeiten, der Dampfdruck bei einer bestimmten Temperatur steigt vom n-Pentan zum iso-Pentan und – mit etwas mehr Differenz – weiter zum neo-Pentan. Pentane brennen auch unter dem Gefrierpunkt von Wasser und sind als Mischung mit Luft in Bereichen von wenigen Volumenprozent Konzentration explosionsfähig.
Handhabung und Lagerung als Flüssigkeit wird durch hohen Dampfdruck erschwert. Da die Flüssigkeiten elektrisch nicht leitend sind, besteht beim Ausgießen die Gefahr von elektrischer Aufladung, Funkenentladung und Entzündung.
Pentan kann (veraltet) als Amylhydrid aufgefasst werden. Amylalkohol ist Pentanol.
Die Dampfdruckkurven können nach Antoine in der Form log10(P) = A−(B/(T+C)) (P in bar, T in K) in den angegebenen Temperaturbereichen mit folgenden Parametern angenähert werden:
| Dampfdruckfunktionen der Pentane | ||||||||||||
| T (K) Bereiche | A | B | C | |||||||||
| n-Pentan[5] | 268,8–341,37 | 3,9892 | 1070,617 | −40,454 | ||||||||
| 341,37–? | ? | ? | ? | |||||||||
| Isopentan[6] | 190,3–300,9 | 3,90935 | 1018,516 | −40,081 | ||||||||
| 300,9–453,5 | 3,97183 | 1021,864 | −43,231 | |||||||||
| Neopentan[5][7] | 268,0–313,2 | 3,86373 | 950,318 | −36,329 | ||||||||
| 313,2–343 | ? | ? | ? | |||||||||
| 343–433 | 4,61616 | 1478,868 | 41,256 | |||||||||

Einzelnachweise
- ↑ alle Daten wurden aus der GESTIS-Datenbank entnommen, die Einzellinks stehen in der Name-Zeile.
- ↑ Eintrag zu CAS-Nr. 109-66-0 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 11. Januar 2017. (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 78-78-4 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. Januar 2017. (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 463-82-1 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. Januar 2017. (JavaScript erforderlich)
- ↑ a b Osborn, A.G.; Douslin, D.R.: Vapor-Pressure Relations for 15 Hydrocarbons in J. Chem. Eng. Data 19 (1974) 114-117.
- ↑ D.R. Stull: Vapor Pressure of Pure Substances Organic Compounds, in: Ind. Eng. Chem. 39 (1947), S. 517–540, doi:10.1021/ie50448a022.
- ↑ Dawson, P.P., Jr.; Silberberg, I.H.; McKetta, J.J.: Volumetric Behavior, Vapor Pressures, and Critical Properties of Neopentane in J. Chem. Eng. Data 18 (1973) 7-15.
Auf dieser Seite verwendete Medien
Autor/Urheber: Steffen 962, Lizenz: CC0
Dampfdruckfunktionen von n-Pentan, Isopentan und Neopentan
Struktur von Pentan
Struktur von n-pentane
Struktur von Isopentan, izopentan