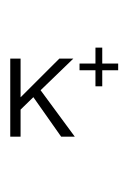Pentakaliumtriphosphat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Pentakaliumtriphosphat | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | K5P3O10 | |||||||||||||||
| Kurzbeschreibung | weißer, hygroskopischer Feststoff[3] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 448,40 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest[3] | |||||||||||||||
| Dichte | 2,72 g·cm−3[4] | |||||||||||||||
| Schmelzpunkt | 614,5 °C[4] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Pentakaliumtriphosphat ist eine anorganische chemische Verbindung des Kaliums aus der Gruppe der Phosphate.
Gewinnung und Darstellung
Pentakaliumtriphosphat kann durch Reaktion von Dikaliumhydrogenphosphat mit Kaliumdihydrogenphosphat gewonnen werden.[6]
Eigenschaften
Pentakaliumtriphosphat ist ein weißer geruchloser Feststoff, der gut löslich in Wasser ist.[3] Das kristallwasserfreie Salz ist stark hygroskopisch. Der pH-Wert einer 1%igen wässrigen Lösung beträgt 9,9.[5] Neben dem Anhydrat existiert ein Di- und ein Tetrahydrat.[7] Die Verbindung zersetzt sich bei 915 K.[8]
Verwendung
Pentakaliumtriphosphat wird wie Pentanatriumtriphosphat als Lebensmittelzusatzstoff mit der Nummer E451 verwendet.
Einzelnachweise
- ↑ Eintrag zu E 451: Triphosphates in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 28. Juni 2020.
- ↑ Eintrag zu PENTAPOTASSIUM TRIPHOSPHATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. Dezember 2021.
- ↑ a b c d Pentapotassium triphosphate. (PDF; 129 kB) FAO, abgerufen am 4. Dezember 2017 (englisch).
- ↑ a b c d Eintrag zu Kaliumtriphosphat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 17. November 2022. (JavaScript erforderlich)
- ↑ a b Ullmanns Encyklopädie der technischen Chemie. Wiley, 1979, 1979, ISBN 3-527-20018-5, S. 332 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Arthur D. F. Toy: The Chemistry of Phosphorus Pergamon Texts in Inorganic Chemistry. Elsevier, 2016, ISBN 978-1-4831-3959-3, S. 518 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ D. E. C. Corbridge: Phosphorus 2000: chemistry, biochemistry & technology. Elsevier, 2000, S. 208 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. Durif: Crystal Chemistry of Condensed Phosphates. Springer Science & Business Media, 2013, ISBN 978-1-4757-9894-4, S. 81 (eingeschränkte Vorschau in der Google-Buchsuche).