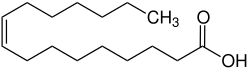
Palmitoleinsäure
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Palmitoleinsäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C16H30O2 | |||||||||||||||||||||
| Kurzbeschreibung | farblose Flüssigkeit[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 254,41 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | flüssig | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Löslichkeit | schwer löslich in Wasser [1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Palmitoleinsäure (chemisch: cis-Hexadec-9-ensäure) ist eine einfach ungesättigte Fettsäure mit 16 Kohlenstoffatomen. Die Doppelbindung befindet sich zwischen C9 und C10 bzw. vom Ende der Kohlenstoffkette aus gesehen am siebten Kohlenstoffatom, es handelt sich somit um eine Omega-7-Fettsäure. Die Monoensäure zählt zu den nicht-essentiellen Fettsäuren.[3]
Sie wurde erstmals 1854 von Gotthard Hofstädter im Walrat gefunden und unter dem Namen Physetölsäure bekannt.[4] Der heutige Name wurde 1927 vorgeschlagen, fast gleichzeitig wurde entdeckt, dass die Zoomarinsäure identisch ist.[5]
Vorkommen
Palmitoleinsäure kommt in Pflanzenfetten häufig vor, meistens in geringeren Mengen bis ca. 10 %.[6] In größeren Mengen kommt sie (chemisch gebunden an Glycerin) als Glycerid in tierischen Geweben wie Depotfett von Vögeln, Nage- und einigen Säugetieren sowie Reptilien und Amphibien, in Fisch- und Seetierölen sowie Walrat und in Säugetier-Leber vor.[4][7] Auch in Muttermilch wurde sie nachgewiesen.[8]

In pflanzlichen Fetten und Ölen kommen Palmitoleinsäure-haltige Triacylglyceride in hoher Konzentration im Sanddornöl von bis über 32 % der Fettsäurereste,[9] im Macadamiaöl und im Avellanaöl der Chilenischen Haselnuss zu ca. 20 % der Fettsäurereste vor.[9] Sie werden darum als Ersatz für Nerzöl verwendet, das etwa 17–20 % enthält. Sie kommt weiter in verschiedenen Algenölen und im Samenöl der Schakalbeere Diospyros mespiliformis, im Fruchtfleisch der Zuckermelone (Cucumis melo), der Papaya (Carica papaya) und der Kaki (Diospyros kaki) in größeren Mengen vor.[10][11] Ebenfalls in erhöhter Konzentration kommt sie in den Fettsäuren von Bäckereihefe vor.[12]
Die Palmitoleinsäure ist ebenfalls in der Fraktion der freien Fettsäuren des Stratum Corneum (die äußerste Schicht der Epidermis) zu knapp 4 % enthalten,[13][14] weshalb sie in kosmetischen Anwendungen und der Lederpflege begehrt ist.[15] Sie ist ein Lipokin mit hormonartiger Wirkung, Bezeichnung für Palmitoleinsäure als ein von Fettgewebe freigesetztes Lipid mit hypothetischer Hormon-Wirkung.[16]
Die Biosynthese geschieht ausgehend von der Palmitinsäure durch deren Desaturierung, also die Umwandlung von gesättigten in ungesättigte Verbindungen, mittels des Enzyms Delta-9-Desaturase (SCD).[17] Sie entsteht auch durch β-Oxidation aus der Vaccensäure, der umgekehrte Fall, die Elongase der Vaccensäure ergibt wieder die Palmitoleinsäure.[18]
Isomere
In pflanzlichen Quellen finden sich eine Reihe von Isomeren der Palmitoleinsäure. Die cis-Isomere (4Z)-,(5Z)-,(7Z)- (Hypogäsäure),(8Z)-,(10Z)-, (11Z)-Hexadecensäure, und die trans (3E)-Hexadecensäure.[19]
Sie kommt in natürlichen Quellen auch als trans-Stereoisomer, also der Palmitelaidinsäure (E)-9-Hexadecensäure, vor z. B. in Milchprodukten.[20][21][22][23]
Im menschlichen Talg (Sebum) kommt zu über 20 % das spezielle Regioisomer, die Sapiensäure (C16:1-delta-6c) vor, die hier durch eine Delta 6-Desaturase der Palmitinsäure entsteht.[16][24][25]
Einzelnachweise
- ↑ a b c d e Eintrag zu CAS-Nr. 373-49-9 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. November 2006. (JavaScript erforderlich)
- ↑ a b Datenblatt Palmitoleic acid bei Sigma-Aldrich, abgerufen am 16. April 2011 (PDF).
- ↑ Georg Löffler: Funktionelle Biochemie. Springer, 1993, ISBN 0-387-54692-8, S. 136.
- ↑ a b H. Schönfeld (Hrsg.): Chemie und Technologie der Fette und Fettprodukte. 1. Band, Springer, 1936, ISBN 978-3-7091-5855-5 (Reprint), S. 27 f.
- ↑ Walter Karrer: Konstitution und Vorkommen der organischen Pflanzenstoffe. 2. Auflage. Springer, 1976, ISBN 978-3-0348-5143-5, S. 303.
- ↑ 9-Hexadecenoic acid bei PlantFA Database, abgerufen am 2. November 2017.
- ↑ Josef Schormüller: Die Bestandteile der Lebensmittel. Springer, 1965, ISBN 978-3-642-46012-8, S. 321.
- ↑ A. Ogunleye, A. T. Fakoya, S. Niizeki, H. Tojo, I. Sasajima, M. Kobayashi, S. Tateishi, K. Yamaguchi: Fatty acid composition of breast milk from Nigerian and Japanese women. In: J Nutr Sci Vitaminol (Tokyo). Band 37, Nr. 4, S. 435–42, doi:10.3177/jnsv.37.435.
- ↑ a b Sabine Krist: Lexikon der pflanzlichen Fette und Öle. 2. Auflage. Springer, 2013, ISBN 978-3-7091-1004-1, S. 98, 433, 706.
- ↑ Michael A. Borowitzka, Navid R. Moheimani: Algae for Biofuels and Energy. Springer, 2013, ISBN 978-94-007-5478-2, S. 218.
- ↑ Victor R. Preedy, Ronald Ross Watson, Vinood B. Patel: Nuts and Seeds. Academic Press, 2011, ISBN 978-0-12-375688-6, S. 150.
- ↑ J. Schormüller: Alkoholische Genussmittel. Handbuch der Lebensmittelchemie, Band VII, Springer, 1968, ISBN 978-3-642-46131-6 (Reprint), S. 611.
- ↑ Maren Kemper: Kutane Effekte von Zigarettennebenstrom. Dissertation, Universität Hamburg 2007, S. 6, (PDF; 2,3 MB) ( vom 24. Januar 2011 im Internet Archive)
- ↑ Ina-Maria Schneider, Wolfgang Wohlrab, Reinhard Neubert: Fettsäuren und Epidermis. In: Der Hautarzt. Band 48, Nr. 5, 1997, S. 303–310, doi:10.1007/s001050050587.
- ↑ James A. Kent: Handbook of Industrial Chemistry and Biotechnology. Vol. 1, 12th Edition, Springer, 2012, ISBN 978-1-4614-4258-5, S. 1381.
- ↑ a b Eintrag zu Lipokin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. Oktober 2017.
- ↑ Richard E. Litz: Biotechnology of Fruit and Nut Crops. CABI, 2005, ISBN 0-85199-662-0, S. 133.
- ↑ Carla Ferreri, Chryssostomos Chatgilialoglu: Membrane Lipidomics. Wiley, 2015, ISBN 978-1-118-54041-1, S. 26–30.
- ↑ Fatty Acids. Isomere mit Masse 254,1 g·mol−1. In: PlantFA Database. Michigan State University, abgerufen am 4. Juli 2020.
- ↑ Adam M. Bernstein, Michael F. Roizen, Luis Martinez: Purified palmitoleic acid for the reduction of high-sensitivity C-reactive protein and serum lipids: A double-blinded, randomized, placebo controlled study. In: Journal of Clinical Lipidology. Vol. 8, Nr. 6, 2014, S. 612–617, doi:10.1016/j.jacl.2014.08.001.
- ↑ Dairy fat may help not harm In: Harvard Gazette. 20. Dezember 2010.
- ↑ trans-Fettsäuren und ihr Einfluss auf die Gesundheit auf dge.de, abgerufen am 17. Oktober 2017.
- ↑ Nicht alle trans-Fettsäuren sind schlecht auf wissenschaft-aktuell.de, abgerufen am 17. Oktober 2017.
- ↑ Meyer R. Rosen: Delivery System Handbook for Personal Care and Cosmetic Products. William Andrew Pub., 2005, ISBN 0-8155-1504-9, S. 776.
- ↑ Christos C. Zouboulis, Andreas D. Katsambas, Albert M. Kligman: Pathogenesis and Treatment of Acne and Rosacea. Springer, 2014, ISBN 978-3-540-69374-1, S. 34 f.
Weblinks
- Palmitoleinsäure – Wissenswertes und Hitlisten (PDF; 158 kB), auf archiv.ever.ch, abgerufen am 17. Oktober 2017 (mit Tabelle zum Palmitoleinsäuregehalt vieler Lebensmittel).
Auf dieser Seite verwendete Medien
Strukturformel von Palmitoleinsäure
Autor/Urheber: Die Autorenschaft wurde nicht in einer maschinell lesbaren Form angegeben. Es wird Svdmolen als Autor angenommen (basierend auf den Rechteinhaber-Angaben)., Lizenz: CC BY-SA 3.0
Hippophae rhamnoides
Photo by Svdmolen


