Packungsdichte (Kristallographie)
Die Packungsdichte (auch Packungsverhältnis oder Raumerfüllung genannt, englisch APF für atomic packing factor) ist in der Kristallographie definiert als das Verhältnis des Volumens der Atome, die sich in einer Elementarzelle befinden, zum Gesamtvolumen der Elementarzelle.
Der Begriff wurde analog in die Mathematik für räumliche Optimierungsprobleme übernommen, etwa Kugelpackungen, die in der Theorie der Datenkompression eine Rolle spielen.
Grundlagen
Die Atome werden dabei als harte, inkompressible Kugeln mit maximaler und identischer Größe angenommen. Der Zahlenwert der Packungsdichte ist charakteristisch für die Art der Packung. Sie hängt nicht von der Auffassung der Elementarzelle ab (Die Kugeln aus zwei oder mehr Elementarzellen erfüllen denselben Raumanteil wie in einer Elementarzelle). Aus der Raumerfüllung lassen sich weitere Schlüsse über die Gestalt des Gitters ziehen und beispielsweise die Stabilität oder die Dichte eines Kristalls begründen.
Allgemein ergibt sich die Packungsdichte aus:
wobei die Anzahl der Atome (= die Summe der einzelnen Anteile) in der Elementarzelle ist. Das Volumen der Kugeln in der Elementarzelle mit Radius berechnet sich durch:
Bei vielen Kristallsystemen ist die Elementarzelle kubisch. Das Volumen einer solchen Elementarzelle mit dem Gitterparameter beträgt:
Für Packungen mit kubischer Elementarzelle gilt folglich:
Geht man von nur einer Atomsorte mit identischer Atomgröße aus, so ist die größtmögliche Raumerfüllung die einer kubisch dichtesten Kugelpackung (kubisch flächenzentrierte Gitter) und die hexagonal dichteste Kugelpackung. Sie beträgt ungefähr 74 %.
Kristallstruktur von Elementen
In den hier aufgeführten Packungstypen kristallisieren die meisten Elemente aus.
Berechnung der Raumerfüllung
Kubisch Primitive Packung
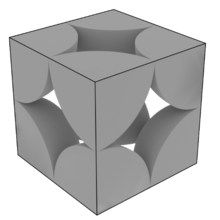
In einer kubisch primitiven Packung (englisch: scp, simple cubic packing) besetzen die Kugeln die 8 Ecken der kubischen Elementarzelle. Da die Alpha-Modifikation von Polonium in diesem Typ kristallisiert, wird er oft mit dem Trivialnamen α-Polonium-Typ bezeichnet.

Von oben betrachtet sieht eine Schicht dieser Packung so aus:
Alle Schichten dieses Packungstyps sind also identisch. Mit ihrem Volumen füllt jede Kugel des Volumens in jeweils umliegenden Elementarzellen. Jede Elementarzelle ist insgesamt mit einem Kugelvolumen gefüllt. Jede Kugel berührt 6 andere Kugeln direkt, die Koordinationszahl ist 6. Alle Kugeln berühren sich lückenlos. Der Gitterparameter ist das zweifache des Kugelradius :
Somit ist
Die Packungsdichte ist .
Kubisch flächenzentrierte Packung
In einer kubisch flächenzentrierten Packung (englisch: fcc, face centered cubic) besetzen 8 Kugeln die Ecken einer kubischen Elementarzelle und füllen sie mit 1/8 ihres Kugelvolumens. Zusätzlich befinden sich auf der Mitte der 6 Flächen eine Kugel, welche 1/2 ihres Volumens in die Elementarzelle hinzufüllt. Somit befinden sich in jeder Elementarzelle 8·1/8 + 6·1/2 = 4 Kugeln. Da Kupfer in diesem Typ kristallisiert, wird er auch als Kupfer-Typ bezeichnet.


Die oberste und unterste Schicht sind gleich. Hier berühren sich die Kugeln entlang der Diagonalen der Elementarzelle:
Die mittlere Schicht sieht von oben betrachtet wie folgt aus:
Die Kugeln auf den Ecken berühren andere Kugeln auf Ecken folglich nicht. Der Radius aller Kugeln ist trotzdem gleich. Der Satz des Pythagoras folgert:
Der Radius ist also
Die Packungsdichte beträgt .
Kubisch raumzentrierte Packung

In einer kubisch innenzentrierten (auch: „raumzentrierten“) Packung (englisch: bcc, body centered cubic) sitzen wie ebenfalls 8 Kugeln auf den Ecken der kubischen Elementarzelle. Die Kugeln berühren sich an den Ecken nicht. In der Mitte der Elementarzelle sitzt eine Kugel, deren ganzes Volumen von der Elementarzelle eingeschlossen ist. Hier befinden sich also 8·1/8 + 1 = 2 Kugeln in der Elementarzelle. Dieser Typ wird mit dem Trivialnamen Wolfram-Typ bezeichnet.
Die oberste und unterste Schicht sehen wie folgt aus:
In der mittleren Schicht sitzt die volle Kugel:
Auch bei diesem Typ haben alle Kugeln denselben Radius. Die Kugeln berühren sich entlang der Raumdiagonalen durch die Elementarzelle.
Um die Raumdiagonale zu berechnen benötigt man die Flächendiagonale. Es wird also zweimal der Satz des Pythagoras angewandt:
und
Der Radius entspricht:
Die Packungsdichte beträgt .
Anwendungen
Mit der Kenntnis der Packung können beispielsweise Dichte, Molare Masse uvm. berechnet werden.
Beispiel
Die Dichte ist eine intensive Größe, die nicht von der Größe des betrachteten Systems abhängt. Die Dichte eines Kubikmeters eines Metalls ist identisch mit der Dichte der Elementarzelle der Struktur des Metalls. Unter Kenntnis des Gitterparameters, der Molaren Masse und der Anzahl der Atome pro Elementarzelle kann die Dichte z. B. eines Metalls wie folgt berechnet werden:
Die Molmasse von Kupfer ist 63,456 g/mol. Kupfer kristallisiert in einem kubisch-dicht gepackten Gitter. Es befinden sich also Atome in einer Elementarzelle. Der Radius eines Kupferatoms beträgt Å, das entspricht . Damit erhält man
- ,
wobei die Zahl der Atome pro Mol (Avogadrozahl) ist. Der Gitterparameter berechnet sich für diesen Typ wie folgt:
- .
Die Dichte von Kupfer ist somit:
Literatur
- Ulrich Müller: Anorganische Strukturchemie. 6. Auflage, Vieweg+Teubner Verlag, Wiesbaden 2008, ISBN 978-3-8348-9545-5
- R. Hoppe: Die Koordinationszahl – ein „anorganisches Chamäleon“. Angewandte Chemie, Band 82, Nr. 1, Januar 1970, S. 7–16. doi:10.1002/ange.19700820103
Weblinks
- Berechnungen der Packungsdichten, Fachinformationszentrum Chemie Berlin (ChemgaPedia)
- Berechnung von Packungsdichten verschiedener kubischer Kristallstrukturen
Auf dieser Seite verwendete Medien
Autor/Urheber: Johannes Schneider, Lizenz: CC BY-SA 4.0
Elementarzelle einer kubisch raumzentrierten Elementarzelle
Autor/Urheber: Baszoetekouw at en.wikipedia, Lizenz: BSD
The face centered cubic crystal structure. Image created by Special:Emailuser/Bas Zoetekouw. Intended as replacement for Cubic-face-centered.png.
Autor/Urheber: Johannes Schneider, Lizenz: CC BY-SA 4.0
Schicht A und C einer kubisch flächenzentrierten Packung. Die Kugeln berühren sich entlang der Diagonalen der Elementarzelle.
Autor/Urheber: Johannes Schneider, Lizenz: CC BY-SA 4.0
Elementarzelle einer kubisch flächenzentrierten Kristallstruktur
Autor/Urheber: Johannes Schneider, Lizenz: CC BY-SA 4.0
Elementarzelle einer Kubisch primitiven Elementarzelle
Autor/Urheber: Johannes Schneider, Lizenz: CC BY-SA 4.0
Schicht aus einer kubisch primitiven Kristallstruktur von oben betrachtet. Jede Kugel sitzt in 8 umgebenden Elementarzellen und trägt 1/8 ihres Volumens zu jeder Elementarzelle bei.
Autor/Urheber: Johannes Schneider, Lizenz: CC BY-SA 4.0
Die Mitte einer kubsich innenzentrierten (raumzentrierten) Packung. Die Kugel trägt ihr ganzes Volumen zur Elementarzelle hinzu.
Autor/Urheber: Johannes Schneider, Lizenz: CC BY-SA 4.0
An der Raumdiagonalen einer kubischen Elementarzelle berühren sich die Kugeln einer kubisch innenzentrierten (raumzentrierten) Packung.
Autor/Urheber: Bas Zoetekouw in der Wikipedia auf Englisch, Lizenz: BSD
The simple cubic crystal structure.
Autor/Urheber: Johannes Schneider, Lizenz: CC BY-SA 4.0
Die oberste und unterste Schicht einer kubisch flächenzentrierten Packung. Die 4 Kugeln tragen 1/2 ihres Volumens zur Elementarzelle bei.
Autor/Urheber: Johannes Schneider, Lizenz: CC BY-SA 4.0
Die mittlere Schicht einer kubisch flächenzentrierten Packung. Die 4 Kugeln tragen die Hälfte ihres Volumens zur Elementarzelle bei.
Autor/Urheber: Johannes Schneider, Lizenz: CC BY-SA 4.0
Die oberste und unterste Schicht einer kubisch innenzentrierten (raumzentrierten) Packung. Die 8 Kugeln tragen jeweils 1/8 ihres Volumens zur Elementarzelle bei.
Autor/Urheber: Johannes Schneider, Lizenz: CC BY-SA 4.0
Der Abstand a zwischen zwei Kugeln identischen Radius r.




















