Oxalsäuredimethylester
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Oxalsäuredimethylester | ||||||||||||||||||
| Andere Namen | Dimethyloxalat | ||||||||||||||||||
| Summenformel | C4H6O4 | ||||||||||||||||||
| Kurzbeschreibung | farbloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 118,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Dichte | 1,148 g·cm−3 (25 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | 163,5 °C[1] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex | 1,39 (20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 | −756,3 kJ/mol[4] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Oxalsäuredimethylester ist eine chemische Verbindung aus der Gruppe der Oxalate, ein Ester der Oxalsäure.
Gewinnung und Darstellung
Oxalsäuredimethylester kann durch Veresterung von Oxalsäure mit Methanol mit p-Toluolsulfonsäure als Katalysator gewonnen werden.
Auch die Darstellung durch oxidative Carbonylierung ist möglich.[5]
Die oxidative Carbonylierung von Methanol verknüpft in einer Pd2+-katalysierten Reaktion bei relativ milden Prozessbedingungen und mit hohen Ausbeuten klassische C1-Bausteine aus dem aus Kohle oder Biomasse gewonnenen Synthesegas zu dem C2-Baustein Dimethyloxalat.[6][7][8][9] Die Oxidation verläuft über Distickstofftrioxid, das nach (1) aus Stickstoffmonoxid und Sauerstoff gebildet wird und anschließend nach (2) mit Methanol zu Methylnitrit reagiert:[10]

Im nächsten Reaktionsschritt (3) der Dicarbonylierung reagiert Kohlenmonoxid mit Methylnitrit in der Dampfphase bei Normaldruck und Temperaturen bei 80–120 °C an einem Palladiumkontakt zu Dimethyloxalat:

Die Summengleichung zeigt, dass Sauerstoff über die Reaktanden Distickstofftrioxid und Methylnitrit als eigentliches Oxidationsmittel wirkt.

Das Verfahren verläuft bezüglich Methylnitrit, das quasi als Überträger der Oxidationsäquivalente fungiert, verlustfrei. Allerdings muss das entstehende Wasser abgeführt werden, da sonst mit der Hydrolyse des Dimethyloxalats zu rechnen ist. Interessanterweise hängt der Reaktionsablauf nach X.-Z. Jiang[10] entscheidend von der Natur des Trägermaterials ab, auf dem der Palladiumkatalysator aufgebracht ist. Mit 1 % Pd/α-Al2O3 entsteht in einer Dicarbonylierungsreaktion selektiv Dimethyloxalat, mit 2 % Pd/C entsteht unter gleichen Reaktionsbedingungen durch Monocarbonylierung Dimethylcarbonat gemäß:

Alternativ kann die oxidative Carbonylierung von Methanol auch mit 1,4-Benzochinon (BQ) als Oxidationsmittel im System Pd(OAc)2/PPh3/BQ mit Massenverhältnis 1/3/100 bei 65 °C und 70 atm CO gemäß[9] mit hoher Ausbeute und Selektivität durchgeführt werden:

Eigenschaften
Oxalsäuredimethylester ist ein farbloser Feststoff, welcher löslich in Wasser ist.[2]
Verwendung
Oxalsäuredimethylester wird für Alkylierungen[11] sowie in der Kosmetikindustrie als Chelatbildner eingesetzt.[12]
Für Länder mit geringen Ölvorkommen, aber großen Kohlevorräten (in Zukunft vielleicht auch Biomasseverfügbarkeit), d. h. Ländern mit großem Potential für synthesegasbasierte Chemie, wie derzeit z. B. China, bietet die oxidative Carbonylierung von Methanol einen neuen und vielversprechenden Zugang zu der wichtigen C2-Basischemikalie Ethylenglycol[13] Dimethyloxalat lässt sich in sehr guten Ausbeuten (94,7 % d. Th.[14]) durch Hydrierung an kupferhaltigen Katalysatoren[15] in Ethylenglycol überführen:
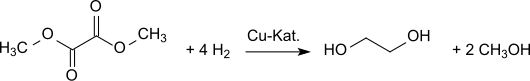
Das entstehende Methanol wird in den Prozess der oxidativen Carbonylierung zurückgeführt; d. h., als einzige Rohstoffe werden im Gesamtprozess Kohlenmonoxid, Wasserstoff und Sauerstoff verbraucht. Eine Anlage mit einer Kapazität von 200,000 Tonnen Ethylenglycol pro Jahr nach diesem „Coal-to-MEG“-Prozess ist bereits in der Inneren Mongolei in Betrieb, eine zweite Anlage mit 250,000 Tonnen/Jahr soll in der zweiten Jahreshälfte 2012 in der Provinz Henan in Betrieb gehen.[16] Weitere Anlagen bis zu einer Gesamtjahreskapazität von mehr als 1 Million Tonnen Ethylenglycol sind geplant.
Aus Oxalsäuredimethylester ist auch der als Treibstoffzusatz (Oxygenat) aus Biomasse[17] diskutierte Kohlensäuredimethylester durch Decarbonylierung bei Temperaturen um 100 °C in Anwesenheit von Alkalimetallalkoholaten zugänglich[18] gemäß:

Das entstehende Kohlenmonoxid kann in die Ausgangsreaktion (3) zurückgeführt werden.
Durch Umesterung von Oxalsäuredimethylester mit Phenol in Gegenwart von Titan-Katalysatoren wird Diphenyloxalat erhalten[19], das analog zum Dimethyloxalat in der Flüssig- oder Gasphase zu Kohlensäurediphenylester decarbonyliert wird. Diphenylcarbonat findet als Ersatz des hochgiftigen Phosgens für die Herstellung von Polycarbonaten Verwendung.[20]
Verwandte Verbindungen
- Oxalsäurediethylester C6H10O4
Einzelnachweise
- ↑ a b c d e f g Datenblatt Dimethyl oxalate bei Sigma-Aldrich, abgerufen am 16. Oktober 2016 (PDF).
- ↑ a b Eintrag zu Oxalsäuredimethylester bei ChemBlink, abgerufen am 25. Februar 2011.
- ↑ Eintrag zu Dimethyl oxalate bei TCI Europe, abgerufen am 27. Juni 2011.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-26.
- ↑ Hans-Jürgen Arpe: Industrielle Organische Chemie: Bedeutende Vor- und Zwischenprodukte, S. 168; ISBN 978-3-527-31540-6.
- ↑ Patent US4467109: Process for continuous preparation of diester of oxalic acid. Angemeldet am 19. Mai 1983, veröffentlicht am 21. August 1984, Anmelder: Ube Industries, Erfinder: Susumu Tahara et al.. und EP108359, Process for the preparation of a diester of oxalic acid, Erfinder: K. Masunaga et al., Anmelder: Ube Industries, Ltd., veröffentlicht am 16. Mai 1984
- ↑ Europäische Patentanmeldung EP-A 425 197, Process for preparing diester of carbonic acid, Erfinder: K. Nishihira, K. Mizutare, Anmelder: Ube Industries, veröffentlicht am 2. Mai 1991
- ↑ US-Patent 4,451,666, Synthesis of oxalate esters by the oxidative carbonylation of alcohols, Erfinder: J.A. Sofranko, A.M. Gaffney, Anmelder: Atlantic Richfield Co., erteilt am 29. Mai 1984.
- ↑ a b E. Amadio: Oxidative Carbonylation of Alkanols Catalyzed by Pd(II)-Phosphine Complexes, PhD Thesis, Ca’Foscari University Venice, 2009.
- ↑ a b X.-Z. Jiang, Palladium Supported Catalysts in CO + RONO Reactions, Platinum Metals Rev., 1990, 34, (4), 178–180
- ↑ Alkylation with Oxalic Esters. Scope and Mechanism
- ↑ Marina Bährle-Rapp: Springer Lexikon Kosmetik und Körperpflege, S. 130; ISBN 978-3-540-20416-9.
- ↑ Nexant/Chemsystems,Coal to MEG, Changing the Rules of the Game ( vom 14. Juli 2011 im Internet Archive) (PDF; 5,4 MB), 2011 Prospectus
- ↑ Europäische Patentanmeldung EP-A 046 983, Process for continuously preparing ethylene glycol, Erfinder: S. Tahara et al., Anmelder: Ube Industries, Ltd., veröffentlicht am 10. März 1982, und H. T. Teunissen and C. J. Elsevier, Ruthenium catalyzed hydrogenation of dimethyl oxalate to ethylene glycol, J. Chem. Soc., Chem. Commun., 1997, 667-668).
- ↑ S. Zhang et al., Highly-Dispersed Copper-Based Catalysts from Cu–Zn–Al Layered Double Hydroxide Precursor for Gas-Phase Hydrogenation of Dimethyl Oxalate to Ethylene Glycol, Catalysis Letters, Sept. 2012, 142 (9), 1121–1127.
- ↑ C. Boswell, China’s coal-based chemicals are a trade-off, ICIS Chemical Business, datiert 20. Januar 2010.
- ↑ Fonds der Chemischen Industrie – Informationsserie Nachwachsende Rohstoffe:Stammbaum Biomasse-Produkte ( vom 12. November 2013 im Internet Archive) (PDF; 99 kB)
- ↑ US-Patent 4,544,507, Production of carbonate diesters from oxalate diesters, Erfinder: P. Foley, Anmelder: Celanese Corp., erteilt am 1. Oktober 1985
- ↑ US-Patent 5,834,615, Process for producing diaryl carbonate, Erfinder: K. Nishihira et al., Anmelder: Ube Industries, Ltd., erteilt am 10. November 1998, und X.B. Ma et al., Preparation of Diphenyl Oxalate from Transesterification of Dimethyl Oxalate with Phenol over TS-1 Catalyst, Chinese Chem. Lett., 14 (5), 461–464 (2003).
- ↑ Japanische Patentanmeldung JP-2011236146, Method for Producing Diaryl Carbonate and Method for Producing Polycarbonate, Anmelder: Mitsubishi Chemical Corp., veröffentlicht am 24. November 2011.
Auf dieser Seite verwendete Medien
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 3.0
Dimethylcarbonat (DMC) aus Dimethyloxalat (DMO)
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 3.0
Ethylenglycol (MEG) aus Dimethyloxalat (DMO)
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 3.0
Monocarbonylierung von Methanol über Methylnitrit zu Dimethylcarbonat
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 3.0
Oxidative Carbonylierung von Methanol mit Benzochninon als Oxidationsmittel_korrigiert
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 3.0
Synthese von Dimethyloxalat durch oxidative Carbonylierung von Methanol
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 3.0
Synthese von Dimethyloxalat - Summarische Reaktionsgleichung
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 3.0
Synthese von Methylnitrit über NO








