Ornithin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
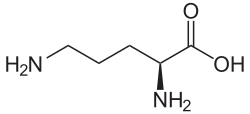 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | L-(+)-Ornithin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C5H12N2O2 | |||||||||||||||||||||
| Kurzbeschreibung | farblose Kristalle[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | A05BA50 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 132,2 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | in Wasser mit alkalischer Reaktion leicht löslich[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Ornithin (von griech. ornis, Vogel) ist eine basische, nichtproteinogene α-Aminosäure. Sie tritt in der L-Form hauptsächlich im Harnstoffzyklus als Trägersubstanz auf.
Herstellung
L-Ornithin wurde erstmals von Max Jaffé[4] 1877 aus Hühnerexkrementen hergestellt.[2] Die technische Herstellung von L-Ornithin erfolgt durch Hydrolyse von L-Arginin im alkalischen Medium.
Rolle im Harnstoffzyklus
L-Ornithin entsteht im Harnstoffzyklus unter Katalyse der Arginase aus L-Arginin durch Wassereinbau und Freisetzung von Harnstoff (NH2–CO–NH2).
L-Ornithin verbindet sich dann, katalysiert durch die Ornithin-Carbamoylphosphat-Transferase, mit Carbamoylphosphat unter Abspaltung dessen Phosphats, und bildet so L-Citrullin.
Die Argininosuccinat-Synthase katalysiert anschließend unter ATP-Verbrauch die Kondensation mit L-Asparaginsäure. Es entsteht Arginin-Bernsteinsäure, das unter physiologischen Bedingungen als Argininosuccinat, dem Anion, vorliegt.
L-Argininosuccinat wird durch die L-Argininosuccinat-Lyase in Fumarat und L-Arginin gespalten. L-Arginin kann nun wieder Harnstoff freisetzen. Damit liegt wieder L-Ornithin vor und der Reaktionskreis schließt sich.
Anwendungen
Ornithin spielt auch in der Mikrobiologie eine Rolle beim MIO-Test. Forschungsergebnisse zeigen, dass sportliche Leistung in Kombination mit Ornithin und Arginin die Bildung von Wachstumshormonen beeinflussen können.[5] Eine Reaktion mit Ornithin erkennt man an der Färbung des Agars im Röhrchen:
- Positive Reaktion: Röhrchen bleibt violett angefärbt
- Negative Reaktion: Röhrchen zeigt gelbe Anfärbung
Isomerie
L-Ornithin ist am stereogenen Zentrum (α-Kohlenstoffatom) (S)-konfiguriert. Enantiomer zum L-Ornithin ist das im Bacitracin vorkommende D-Ornithin.[6] Dieses ist (R)-konfiguriert und nur von untergeordneter Bedeutung.
Einzelnachweise
- ↑ Eintrag zu ORNITHINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. September 2021.
- ↑ a b c d Eintrag zu l-Ornithin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Delanghe JR, Speeckaert MM: Creatinine determination according to Jaffe—what does it stand for? In: NDT Plus. 4. Jahrgang, Nr. 2, 27. Januar 2011, S. 83–86, doi:10.1093/ndtplus/sfq211, PMID 25984118, PMC 4421578 (freier Volltext) – (englisch).
- ↑ Adam Zajac, Stanisław Poprzecki, Aleksandra Zebrowska, Małgorzata Chalimoniuk, Jozef Langfort: Arginine and ornithine supplementation increases growth hormone and insulin-like growth factor-1 serum levels after heavy-resistance exercise in strength-trained athletes. In: J Strength Cond Res. 24 (4), 2010, S. 1082–1090, PMID 20300016.
- ↑ Eintrag zu Bacitracin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
Weblinks
Auf dieser Seite verwendete Medien
Struktur von L-Ornithin
