Organische Säuren
Organische Säuren sind chemische Verbindungen, die über eine oder mehrere funktionelle Gruppen oder andere Strukturelemente verfügen, die unter Abgabe von Protonen mit Wasser oder anderen protonierbaren Lösungsmitteln Gleichgewichtsreaktionen eingehen. Dabei entstehen die jeweiligen Anionen der betreffenden organischen Säuren und die Protonen werden im Fall von Wasser als Lösungsmittel, das als Protonenakzeptor und damit als Base reagiert, unter Bildung von Oxoniumionen H3O+, aufgenommen. Die Konzentration der Oxoniumionen in der Lösung ist dann größer als die Konzentration von Hydroxidionen, sodass die Lösung als sauer bezeichnet wird:
Neben organischen Säuren, die bereits mit Wasser als Säuren reagieren, gibt es eine Vielzahl weiterer organischer Verbindungen, die zwar nicht mit dem schwachen Protonenakzeptor Wasser, wohl aber mit anderen stärkeren oder sehr starken Protonenakzeptoren – wie z. B.mit dem Hydrid-Anion H− oder mit dem Amid-Anion NH2− als Säuren reagieren können. In diesen beiden speziellen Fällen stellt sich aber kein Gleichgewicht ein, denn es kommt zur Bildung von gasförmigem Wasserstoff, bzw. von gasförmigem Ammoniak die beide als Gase entweichen:
Auch solche Reaktionen sind Säure-Base-Reaktionen, müssen aber in Abwesenheit von Wasser und in einem Lösungsmittel durchgeführt werden, das selbst keine Protonen abgeben kann (z. B. in Diethylether). Sonst würden die benötigten sehr stark basischen Anionen Hydrid bzw. Amid vom Wasser oder dem unpassenden Lösungsmittel protoniert und damit vernichtet werden.
Gruppierung organischer Säuren
Vorbemerkungen, Säurestärke
Ein Maß für die Säurestärke einer chemischen Verbindung ist die Säurekonstante bzw. ihr pKs-Wert. Der Wert der Säurekonstante gibt an, wie stark die Verbindung als Säure bei der obigen Gleichgewichtsreaktion mit Wasser reagiert (protolysiert), d. h. wie weit das obige Gleichgewicht auf die rechte Seite verlagert ist. Dabei gilt: je kleiner der pKs-Wert, desto größer ist die Säurestärke der organischen Säure.
Der Begriff Organische Säure wird häufig vorschnell und vereinfachend mit Carbonsäure gleichgesetzt, also mit Verbindungen, die eine oder mehrere Carboxygruppen (–COOH) tragen. Es gibt jedoch sehr viele organische Verbindungen, die als Säuren reagieren können, die aber gar keine Carboxygruppe, sondern andere Gruppen enthalten, die ebenfalls mehr oder weniger leicht ein Proton abgeben, d. h. sauer reagieren können. Das können Gruppen sein wie z. B. die Hydroxygruppe in Alkoholen R-OH, oder die Sulfanylgruppe –SH in (Thiolen), oder die Gruppe –SO3H in organischen (Sulfonsäuren).

Die Abgabe eines Protons gelingt um so leichter, d. h. die Verbindung ist eine um so stärkere Säure, je besser das entstehende Anion durch Mesomerie oder andere zusätzliche Effekte stabilisiert wird. Dafür ist die Verbindung Ascorbinsäure (Vitamin C) ein besonders drastisches Beispiel. In der Molekülstruktur findet sich keine Carboxygruppe und trotzdem ist diese Verbindung mit pKS 4,25 eine stärkere Säure als die Essigsäure mit pKS 4,75, weil das Anion der Ascorbinsäure wegen der vorhandenen Enolgruppen und möglicher tautomerer Effekte stabilisiert wird.
Wichtig ist es festzuhalten, dass auch an C- oder an N-Atome gebundene Protonen abgegeben werden können, wenn die entstehenden Anionen mesomeriestabilisiert sind. Solche Verbindungen bezeichnet man auch als C-H-acide bzw. als N-H-acide Verbindungen. Bei diesen Verbindungen kann man – in Abwesenheit von Wasser als Lösungsmittel – die vollständige Abgabe des Protons durch Zugabe des starken Reduktionsmittels Natrium erzwingen, wobei die Protonen zum elementaren Wasserstoff reduziert und damit dem Gleichgewicht entzogen werden. Mit den so hergestellten Anionen der C-H- bzw. N-H aciden Verbindung können dann chemische Synthesen durchgeführt werden.
Carbonsäuren

Carbonsäuren mit pKS Werten ab 3,8 (Ameisensäure) und höher sind deutlich stärkere Säuren als Alkohole mit pKS Werten ab 15,9 (Ethanol) und höher. Die Säurestärke von Carbonsäuren steigt noch weiter an, wenn in der Nähe der Carboxygruppe (in α-, β- oder γ-Position) weitere elektronenziehende Gruppen vorhanden sind. So ist z. B. Trifluoressigsäure mit pKS 0,23 schon als starke Säure zu bezeichnen, im Vergleich zur nicht substituierten schwachen Essigsäure mit pKS 4,75. Beide Säuren sind stärkere Säuren als die 2-Hydroxypropionsäure Milchsäure mit pKS 3,9, die wiederum eine nur wenig stärkere Säure ist als die normale Propionsäure mit pKS 4,1.
Alkohole, Phenole, Enole
Unsubstituierte Alkohole (pKs größer 16) haben nur sehr geringe Aciditäten, während die Phenole und Naphthole wegen der Mesomeriestabilisierung der entstehenden Phenolate deutlicher acider sind: Phenol ist mit dem pKs-Wert von 9,9 um den Faktor 106 stärker sauer als z. B. Ethanol (mit einem pKs von 16). Substituenten an den aromatischen Ringsystemen der Phenole, die einen −I- oder −M-Effekt ausüben, können die Säurestärke von Phenolen und Naphtholen stark erhöhen, indem sie die negative Ladung der entstehenden Anionen stabilisieren.[1] Sind mehrere solche Substituenten vorhanden, kann das zu stark sauren Verbindungen führen, wie z. B. bei der Pikrinsäure (pKs 0,3) mit drei Nitrogruppen (−M-Effekt) am aromatischen Ring, oder auch beim Pentachlorphenol (pKs 4,7) (−I-Effekt). Auf den speziellen Fall des Endiols Ascorbinsäure, das mit dem pKs von 4,2 stärker sauer ist als Essigsäure (pKs 4,8) wurde bereits hingewiesen.
Thiole
Thiole besitzen eine höhere Acidität als die entsprechenden Alkohole; die entstehenden Thiolate sind stabiler als die Alkoholate. Dies zeigt der Vergleich der analogen Verbindungen Ethanol (pKs 16) und Ethanthiol (auch Ethylmercaptan, pKs 12).
Schwefelsäureester und Sulfonsäuren

Die Monoester der Schwefelsäure und die Sulfonsäuren besitzen einen pKs Wert, der wegen der ähnlichen Struktur vergleichbar ist mit dem pKs Wert der zweiten Dissoziationsstufe der Schwefelsäure (pKs Wert 1,9). Die p-Toluolsulfonsäure etwa besitzt einen pKs von 0,7. Der Mono-Ester der Schwefelsäure mit Laurylalkohol, das sog. Laurylsulfat, ist zwar stärker sauer als die Sulfonsäure, besitzt den pKs Wert −0,09 und ist damit noch deutlich schwächer sauer als das Proton der ersten Dissoziationsstufe der Schwefelsäure (pKs Wert −3).
Phosphorsäureester und Phosphonsäuren
Die Mono- und Diester der Phosphorsäure (Phosphorsäureester) sowie die organischen Derivate der Phosphonsäuren sind je nach Dissoziationsstufe mittelstarke bis schwache Säuren.
CH- und NH-acide Verbindungen

Auch Kohlenwasserstoffe ohne Carboxy-, Hydroxy- oder Sulfanylgruppe können aufgrund ihrer CH- oder NH-Acidität als Säuren agieren. Hierbei ist das Vorkommen von Mehrfachbindungen und benachbarten funktionellen Gruppen oder Heteroatomen die Ursache der Acidität. Die bekannteste CH-acide Verbindung ist das Ethin (Acetylen), das aufgrund der Dreifachbindung einen pKs-Wert von 25 aufweist (Ethan: 50). Weitere Beispiele sind das Nitroethan (pKs 8,6) und das Nitrocyclopentadien, das stärker sauer ist (pKs 3,3) als Ameisensäure (3,75). Bei der Deprotonierung entsteht aus dem Nitrocyclopentadien ein Derivat des aromatischen Cyclopentadienyl-Anions. Auch hier bestimmen mesomere Effekte zusammen mit induktiven Effekten die Acidität der Verbindungen. Acetonitril ist ein weiteres Beispiel für eine einfache CH-acide Verbindung. Bekannte NH-acide Verbindungen sind Phthalimid (pKs = 8,3[2]) und Sulfonylharnstoffe (Tolbutamid hat einen pKs von 5,16[3]).
Übersicht
Stoffklasse acide funktionelle Gruppe Beispiel pKs-Wert bei 25 °C Carbonsäuren Carboxygruppe: R–COOH  Essigsäure
Essigsäure4,8 Substituierte
CarbonsäurenCarboxygruppe: R–CHxXy–COOH  Trifluoressigsäure
Trifluoressigsäure0,23[4] aromatische
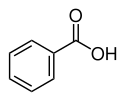
CarbonsäurenCarboxygruppe: Ar–COOH  Benzoesäure
Benzoesäure4,2[4] Alkohole Hydroxygruppe: R–OH  Ethanol
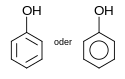
Ethanol16 Phenole Hydroxygruppe : Ar–OH
(Ar=Aryl) Phenol
Phenol9,9[5] Naphthole Hydroxygruppe : Ar–OH
(Ar=Aryl)α-Naphthol 9,3[6] Substituierte Phenole
(Substituenten mit -I-Effekt
wie Halogene, Nitrogruppe)Hydroxygruppe : O2N–Ar–OH
(Ar=Aryl) Pikrinsäure
Pikrinsäure0,4[5] Enole Hydroxygruppe (Enol) : C=C–OH  Ascorbinsäure
Ascorbinsäure4,2 Thiole R–SH  Ethanthiol (C2H5–SH)
Ethanthiol (C2H5–SH)12[7] Schwefelsäureester
(Sulfate)R–O–SO3H Schwefelsäuredodecylester −0,09
Wert für die Säure[8]Sulfonsäuren
(Alkylsulfonsäuren)R–SO3H H3C–SO3H Methansulfonsäure −0,6[4] Sulfonsäuren
(Arensulfonsäuren)R–Ar–SO3H
(Ar=Aryl)H3C–C6H4–SO3H p-Toluolsulfonsäure −2,8[9] Phosphate
(= Phosphorsäureester)R–O–PO(OH)2 Adenosinmonophosphat 3,3[4] org. Phosphonsäuren R–PO(OH)2 H3C–PO(OH)2 Methylphosphonsäure 2,35 CH-acide Verbindungen
AlkineH–CC–R 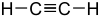 Ethin
Ethin25 CH-acide Verbindungen
NitroalkaneO2N–CRR'–H 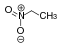 Nitroethan
Nitroethan8,6[10] CH-acide Verbindungen
β-DicarbonyleRC=OCH2C=OR'  Acetylaceton
Acetylaceton≈ 9[11] NH-acide Verbindungen
ImideR–(CO)2N–H  Phthalimid
Phthalimid8,3[2] Anorganische Säuren zum Vergleich Mineralsäuren HO–SO2–OH  Schwefelsäure
Schwefelsäure−3
Einzelnachweise
- ↑ Alfons Hädener, Heinz Kaufmann: Grundlagen der organischen Chemie. Springer, 2006, ISBN 978-3-7643-7040-4
- ↑ a b Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 1984, S. 521, ISBN 3-7776-0406-2.
- ↑ J. Sangster: LOGKOW Databank. Sangster Res. Lab., Montreal Quebec, Canada. 1994.
- ↑ a b c d chem.wisc.edu: pKa Data, Compiled by R. Williams (PDF; 645 kB).
- ↑ a b CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ Rappoport, Zvi., Frankel, Max.: Handbook of tables for organic compound identification. 3d ed Auflage. Chemical Rubber Co, Cleveland 1967, ISBN 0-8493-0303-6.
- ↑ ChemieOnline Buchstabe E (Ethylmercaptan).
- ↑ P.H. Stahl, C.G. Wermuth: Handbook of Pharmaceutical Salts: Properties, Selection, and Use, 2002, Helvetica Chimica Acta, ISBN 3-906390-26-8.
- ↑ Guthrie, J. P.: Hydrolysis of esters of oxy acids: pKa values for strong acids. In: Can. J. Chem. 1978, 56, 2342–2354.
- ↑ ChemieOnline Buchstabe N ( vom 28. Mai 2008 im Internet Archive)
- ↑ ChemieOnline Buchstabe A
Auf dieser Seite verwendete Medien
Allgemeine Struktur der Carbonsäuren
4-Toluolsulfonsäure ;p-Toluolsulfonsäure; 4-Methylbenzolsulfonsäure
Vector drawing of nitroethane. Created with BKChem and adjusted with Inkscape.
Ethyl_acetoacetate
chemical structure of Phthalimide, made using BKchem
Struktur von Schwefelsäure
Struktur von Acetylaceton
Trifluoressigsäure
Struktur von Pikrinsäure
Chemical structure of benzoic acid.
Ethanthiol; Ethylmercaptan