Norvalin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
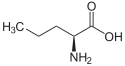
| Strukturformel von L-Norvalin | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | L-(+)-Norvalin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C5H11NO2 | |||||||||||||||||||||
| Kurzbeschreibung | farblose, kleine Blättchen[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 117,15 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | gut löslich in heißem Wasser[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Norvalin ist eine nichtproteinogene α-Aminosäure. Strukturell leitet sich L-Norvalin durch Substitution des α-Wasserstoffatoms durch eine Aminogruppe (–NH2) von der Valeriansäure ab. L-Valin und L-Isovalin sind Konstitutionsisomere des L-Norvalins.
Durch Decarboxylierung von Norvalin entsteht n-Butylamin. Dessen Trivialname Norvalamin weist auf diese Reaktion hin.

Anwendung
L-Norvalin hemmt das Enzym Arginase, so dass es zur Erhöhung der Arginin-Konzentration kommt.[3] Norvalin kann anstelle von L-Leucin in Proteine eingebaut werden.[4]
Einzelnachweise
- ↑ a b c d e Eintrag zu Norvalin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Juni 2014.
- ↑ a b Datenblatt L-Norvaline bei Sigma-Aldrich, abgerufen am 8. November 2016 (PDF).
- ↑ C. I. Chang, J. C. Liao, L. Kuo: Arginase modulates nitric oxide production in activated macrophages, in: American Journal of Physiology, 1998, 274 (1 Pt 2), S. 342–348 (Volltext (Memento vom 14. Januar 2016 im Internet Archive); PMID 9458885).
- ↑ Izydor Apostol, Joseph Levine, Julie Lippincott, Jeanette Leach, Edward Hess, Christopher B. Glascock, Michael J. Weickert, Richard Blackmore: Incorporation of Norvaline at Leucine Positions in Recombinant Human Hemoglobin Expressed in Escherichia coli, in: J. Biol. Chem., 1997, 272 (46), S. 28980–28988 (doi:10.1074/jbc.272.46.28980; PMID 9360970).
Auf dieser Seite verwendete Medien
Struktur von L-Norvalin
Decarboxylierung von Norvalin zu n-Butylamin (Norvalamin)