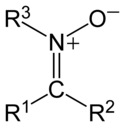
Nitrone
Nitrone sind eine Gruppe chemischer Verbindungen in der organischen Chemie. Sie enthalten eine funktionelle Gruppe, die man als N-Oxid eines Imins beschreiben kann.[1] Nitrone sind aufgrund ihrer Zwitterladung relativ reaktiv, beispielsweise als 1,3-Dipol in Additionen an elektronenreiche C-C-Mehrfachbindungen.[2]
Darstellung
Nitrone können durch die Reaktion von Ketonen oder Dienen mit zwei aufeinander folgenden Doppelbindungen mit N-monoalkylierten Hydroxylaminen hergestellt werden. Es kommt zunächst zu einem nukleophilen Angriff des Stickstoffs am Kohlenstoff des Carbonyls, es entsteht ein Zwischenprodukt mit positiv geladenem vierbindigem Stickstoff sowie negativ geladenem Sauerstoff am ehemaligen Carbonyl. Nach Eliminierung von Wasser mit dem ehemaligen Sauerstoff des Carbonyls und den beiden Wasserstoffatomen des Hydroxyamins erhält man durch Ausbildung einer Doppelbindung zwischen Stickstoffe und Kohlenstoff die Nitronstruktur.
Eine weitere Möglichkeit ist die Dehydrierung eines zweifach alkyl-substituierten Hydroxyamins. Auch die N-Alkylierung von Oximen und die oxidative Dehydrierung von sekundären Aminen führt zu den Nitronen.[3]
Reaktionen
Nitrone reagieren mit Alkenen zu Isoxazolidinen. Diese 1,3-dipolare Cycloaddition ist streng cis-selektiv. Isoxazolidine können durch katalytische Hydrierung zu β-Aminoalkoholen gespalten werden.[3]
Mit terminalen Alkinen reagieren Nitrone in Anwesenheit von Kupfer(I)-iodid zu den schwer zugänglichen β-Lactamen. Diese Reaktion wird auch als Kinugasa-Reaktion bezeichnet.[4][5][6]
Einzelnachweise
- ↑ Eintrag zu nitrones. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.N04164 – Version: 2.3.3.
- ↑ Ian Fleming: Grenzorbitale und Reaktionen organischer Verbindungen. Wiley-VCH, Weinheim 1988, ISBN 3-527-25792-6, S. 174.
- ↑ a b D. Döpp, H. Döpp In: D. Klamann (Hrsg.): Methoden der Organischen Chemie. Bd. E14b, Thieme Verlag, Stuttgart 1990, ISBN 3-13-220004-2, S. 1372–1544.
- ↑ Manabu Kinugasa, Shizunobu Hashimoto: The reactions of copper(I) phenylacetylide with nitrones. In: J. Chem. Soc., Chem. Commun. 1972, S. 466–467, doi:10.1039/C39720000466.
- ↑ Runa Pal, Amit Basak: A novel synthesis of -lactam fused cyclic enediynes by intramolecular Kinugasa reaction. In: Chem. Commun. 2006, S. 2992–2994, doi:10.1039/b605743h.
- ↑ Ryo Shintani, Gregory C. Fu: Catalytic Enantioselective Synthesis of β-Lactams: Intramolecular Kinugasa Reactions and Interception of an Intermediate in the Reaction Cascade. In: Angew. Chem. Int. Ed. 2003, 42, S. 4082–4085, doi:10.1002/anie.200352103.
Auf dieser Seite verwendete Medien
Struktur von
Struktur von
General structure of a nitrone