Nitrate
Als Nitrate werden sowohl die Salze als auch die Ester der Salpetersäure (HNO3) bezeichnet.

Die Salze haben die allgemeine Zusammensetzung MINO3 (MI: einwertiges Kation). Einige der Salze werden mit dem historischen Trivialnamen Salpeter bezeichnet. Das planare Anion NO3− trägt eine negative Ladung.
Die Ester der Salpetersäure werden auch Salpetersäureester genannt und haben die allgemeine Struktur R–O–NO2 (R: organischer Rest).

Einige Salpetersäureester werden fälschlicherweise als Nitroverbindung bezeichnet, so z. B. Glycerintrinitrat als Nitroglyzerin. Nitroverbindungen (R–NO2) haben jedoch im Gegensatz zu Nitraten eine C-N-Bindung.
In der Mineralogie bilden die Nitrate je nach verwendeter Mineralsystematik zusammen mit den Carbonaten bzw. mit den Carbonaten und Boraten eine eigene Klasse. In der mittlerweile veralteten 8. Auflage der Strunz’schen und der vorwiegend im englischen Sprachraum gebräuchlichen Mineralsystematik nach Dana werden Carbonate, Nitrate und Borate in einer Klasse zusammengefasst, in der modernen und von der International Mineralogical Association (IMA) verwendeten 9. Auflage der Mineralsystematik nach Strunz dagegen nur die Carbonate und Nitrate.
Salze der Salpetersäure
Struktur
| Name | Formel | Trivialname |
|---|---|---|
| Kaliumnitrat | KNO3 | Kalisalpeter |
| Natriumnitrat | NaNO3 | Natronsalpeter, Chilesalpeter |
| Bariumnitrat | Ba(NO3)2 | Barytsalpeter |
| Calciumnitrat | Ca(NO3)2 | Kalksalpeter, Mauersalpeter |
| Ammoniumnitrat | NH4NO3 | Ammonsalpeter |
| Silbernitrat | AgNO3 | Höllenstein |
| Aluminiumnitrat | Al(NO3)3 | |
| Eisen(III)-nitrat | Fe(NO3)3 | |
| Weitere Beispiele siehe Kategorie:Nitrat | ||
Das Nitration ist planar gebaut. Alle Bindungswinkel O–N–O betragen 120°. Ebenso sind die Bindungslängen der N–O-Bindungen gleich lang und liegen zwischen den Längen für Einfach- bzw. Doppelbindungen. Die reale Struktur des Nitrations muss deshalb zwischen drei mesomeren Grenzstrukturen existieren:
Stickstoff verfügt als Element der zweiten Periode über keine Oktettaufweitung, so dass die mesomeren Grenzstrukturen mit positiven und negativen Ladungen vorliegen.
Eigenschaften
Die Salze sind – mit Ausnahme des Bismutoxidnitrats BiONO3 – gut löslich in Wasser und spielen eine wichtige Rolle als Nährstoff für Pflanzen. Nitratanionen selbst sind weitgehend ungiftig. Grenzen zur Toxizität für Säugetiere und Menschen liegen in der gleichen Größenordnung wie diejenigen von Chloriden und Sulfaten, nämlich im zweistelligen Grammbereich. Große Mengen führen jedoch – wie bei allen Salzen – zu osmotischen Problemen (siehe: Osmoregulation). Als Lebensmittelzusatzstoffe werden Nitrate im Milligrammbereich verwendet.
Beim trockenen Erhitzen (Schmelzen) zerfallen Nitrate.
So reagiert Natriumnitrat unter Sauerstoffabspaltung zu Natriumnitrit:
Bleinitrat bildet Blei(II)-oxid und Stickstoffdioxid wird freigesetzt:
Alkalinitrate werden als Oxidationsmittel z. B. im Schwarzpulver verwendet.
Herstellung
Nitratsalze sind durch Umsetzung von Salpetersäure beispielsweise mit Hydroxiden, Carbonaten, Metallen o. ä. leicht zugänglich:
- Umsetzung von Salpetersäure mit Bariumhydroxid zu Bariumnitrat und Wasser.
- Umsetzung von Salpetersäure mit Kaliumcarbonat zu Kaliumnitrat, Wasser und Kohlendioxid.
- Umsetzung von Salpetersäure mit Zink zu Zinknitrat, Wasser und Stickstoffmonoxid.
Nitrate sind auch durch vollständige Oxidation von Stickstoffverbindungen wie Nitriten, Ammoniak oder Hydroxylamin zugänglich.
Vorkommen

Nitrate sind in der Biosphäre und Hydrosphäre hauptsächlich in Form von Natriumnitrat allgegenwärtig. Wegen der hohen Löslichkeit akkumulieren sich Nitrate in größeren Mengen nur an wenigen spezifischen Orten. Abbauwürdige große Nitratvorkommen sind daher selten. Sie finden sich in Wüsten mit lang anhaltendem hyperariden Klima wie in der Atacama-Wüste in Chile (ca. 2 × 108 t), in der Turpan-Senke in Nordwest-China (ca. 2,5 × 108 t[1]), in den McMurdo Dry Valleys der Antarktis und in der Mojave in den USA.[2] Weitere Fundorte gibt es in Ägypten, Kleinasien und Kolumbien. Nitrate der häufigen Alkali- und Erdalkalimetalle kommen in natürlicher Form als Chile-, Kalk- oder Kalisalpeter vor.
Bildung und Abbau von Nitraten
Im Boden und in Gewässern werden Nitrate durch bakterielle Nitrifikation gebildet. Bei der Zersetzung insbesondere eiweißhaltiger Stoffe werden primär Ammoniumverbindungen freigesetzt. Die Oxidation durch Bakterien der Gattung Nitrosomonas führt zu Nitrit, welches durch Bakterien der Gattung Nitrobacter zum Nitrat weiteroxidiert wird.
Bei einem Mangel an Sauerstoff führt hingegen die bakterielle Denitrifikation von Nitrat zu elementarem Stickstoff.[3] Diese Umsetzungen werden z. B. in Kläranlagen systematisch zur Beseitigung der Stickstoffverbindungen ausgenutzt.
Verwendung
Nitrat wirkt als effizienter Sauerstoffspender. Deshalb ist Kaliumnitrat Bestandteil des Schwarzpulvers (Sprengsalpeter). Es werden gegebenenfalls auch Nitrate anderer Kationen verwendet, meist wenn farbige Lichteffekte in der Pyrotechnik gewünscht werden; z. B. Barium- (grün), und Strontiumnitrat (rot). Bariumnitrat wird ebenso in Wunderkerzen verwendet, ohne hierbei eine merkliche Flammenfärbung zu erzeugen.
Als Lebensmittelzusatzstoff wird Natriumnitrat (E 251) und Kaliumnitrat (E 252) als Konservierungsmittel z. B. zum Pökeln von Fleisch- und Wurstwaren verwendet, da es über die Bildung von Nitrit das Wachstum anaerober Keime hemmt.
Nitrate bewirken in lebenden Organismen eine enzymatische Freisetzung des blutgefäßerweiternden Stickstoffmonoxids (NO) und werden daher in der Medizin (etwa zur Behandlung und Vorbeugung von Angina-pectoris-Anfällen[4] sowie bei der Behandlung einer schweren akuten Herzschwäche[5]) verwendet, unter anderem die Medikamente Nitroglyzerin oder Isosorbidmononitrat zur Gefäßerweiterung (siehe auch NO-Donatoren).
Düngung
Nitrate werden von Pflanzen als Nährstoffe verwertet und in der Landwirtschaft als Düngemittel eingesetzt. Sie können direkt von pflanzlichen Organismen als Stickstoffquelle aufgenommen und verwertet werden.

In der Landwirtschaft werden Nitrate als Dünger, auch in Form von Gülle (allg. Wirtschaftsdünger) eingesetzt. Diese Wirtschaftsdünger enthalten Stickstoff zum Teil als Nitrat (Calciumnitrat in Blaukorn) und zum Teil als Ammoniumverbindungen (Ammoniumnitrat, Ammoniumphosphat), oft aber auch in Form von organischen Stickstoffverbindungen (Proteine, Amine, Harnstoff). Durch Nitrifikation entsteht im Boden unter Mitwirkung von Bakterien aus Ammoniumionen (NH4+) über die Zwischenstufe Nitrit das Nitrat. Der organisch gebundene Stickstoff kann im Boden mineralisiert werden (Freisetzung von Ammoniumverbindungen und letztlich auch Nitrat) oder in den Bodenhumusvorrat eingehen, aus dem er erst allmählich wieder mineralisiert wird (i. d. R. 1 bis 3 % Mineralisierungsrate pro Jahr).
Verschärfungen des Düngerechts
Insbesondere als Folge der Güllewirtschaft, (in untergeordneten Mengen auch durch übermäßige Düngung z. B. beim Anbau verschiedener Gemüsearten[6] oder in privaten Hausgärten sowie durch undichte Abwasserleitungen) haben die Nitratgehalte in den vergangenen Jahrzehnten nicht nur in den Grundwässern deutlich zugenommen. Über die Flussläufe gelangten die erhöhten Nitratmengen bis in die Nord- und Ostsee. Schon in den 1980er Jahren sah sich die Europäische Union, damals noch Europäische Wirtschaftsgemeinschaft, veranlasst, Gegenmaßnahmen zu ergreifen.[7] 1991 erließ sie die sogenannte Nitrat-Richtlinie (91/676/EWG).[8] In den Erwägungsgründen hieß es: "Die Verschmutzung der Gewässer der Gemeinschaft aus diffusen Quellen wird hauptsächlich durch Nitrat aus landwirtschaftlichen Quellen verursacht". Ende 2016 strengte die Europäische Kommission ein Vertragsverletzungsverfahren gegen die Bundesrepublik Deutschland an, da diese die Vorgaben der Richtlinie nicht adäquat in deutsches Recht umgesetzt habe. Ihr wurde u. a. vorgeworfen, die weitere Entwicklung dieser Situation nicht angemessen überwacht und die teilweise stark erhöhten Nitratkonzentrationen in den Gewässern nicht energisch genug bekämpft zu haben. Im Juni 2018 gab der Europäische Gerichtshof der Klage vollumfänglich statt.[9] Aus dem Bemühen um die Einhaltung der europarechtlichen Vorgaben resultierten u. a. Änderungen an der Düngeverordnung, Detaillierungen in den jeweiligen Landes-Düngeverordnungen, sowie der Erlass der Stoffstrombilanzverordnung.[10]
Gesundheitliche Bedeutung
Die Ursache für gesundheitliche Risiken liegt in der Gefahr einer Reduktion des Nitrats zu Nitrit und der Bildung von krebserregenden Nitrosaminen. Eine solche Umwandlung findet zum einen im Darm durch entsprechende Bakterien statt, zum anderen können auch einige Mundbakterien über den Blutweg angeliefertes und über die Speicheldrüsen in den Mund geschwemmtes Nitrat reduzieren.[11] Die Darmflora des Säuglings kann (wie die Darmflora eines Erwachsenen) Nitrit bildende Bakterien enthalten. Das entstehende Nitrit oxidiert das Hämoglobin zu Methämoglobin, welches der Säugling aufgrund seiner noch nicht ausgereiften Reduktionskapazität nicht wieder zu Hämoglobin rückreduzieren kann, so dass der Säugling von innen erstickt. Auch bei Wiederkäuern besteht durch Nitratreduktion im Pansen eine akute Gefahr der Nitritbildung. Hier werden sogar Nitratkonzentrationen über 20 mg/l im Trinkwasser als schädlich betrachtet.
Nitrate in Trinkwasser
Mit rund 75 Prozent ist die Landwirtschaft am Nitrateintrag in die Gewässer beteiligt; der Rest sind Verkehr, Industrie und die Abwasserbehandlung.[12]
Der aktuelle Grenzwert für NO3− in Trinkwasser liegt laut der deutschen Trinkwasserverordnung bei einem zulässigen Höchstwert von 50 mg/l. In der Schweiz gilt ein Höchstwert von 40 mg/l.[13] In Österreich liegt der Grenzwert für Nitrat laut Trinkwasserverordnung ebenfalls bei 50 mg/l, allerdings ist hier die Bedingung [NO3−]/50 + [NO2−]/3 ≤ 1 einzuhalten (bei den Werten in den eckigen Klammern wird mit Konzentrationen in mg/l gerechnet).[14] Wässer, die diesen Grenzwert überschreiten, werden von Wasserversorgern oft mit nitratärmerem Wasser vermischt, um den Grenzwert einzuhalten.
In jüngster Zeit wurden erste Wasseraufbereitungen mit Umkehrosmose oder Nanofiltration gebaut, um durch Teilentsalzung den Nitratwert im Trinkwasser abzusenken. Eine weitere funktionale Technik ist der Einsatz von Ionentauschern. Bereits in Anwendung ist das CARIX-Verfahren, das zugleich zur Enthärtung eingesetzt wird.[15] 2021 waren in Deutschland über 20 Anlagen von kommunalen Wasserversorgern in Betrieb genommen und es befanden sich 12 weitere in Planung.[16]
Je höher der Nitratwert, desto höher das Darmkrebsrisiko. Ein Risikoanstieg ist bereits bei Nitratkonzentrationen zu verzeichnen, die deutlich unter den gesetzlich vorgeschriebenen Grenzwerten liegen.[17] Gefahr besteht für Säuglinge und für Menschen mit entarteter Darmflora durch die mögliche Bildung von Nitrit. In der Hauptsache aber dienen die Grenzwerte für Nitrat als Indikatorwerte für eine allgemeine Belastung der Trinkwasserquellen mit stickstoffhaltigen organischen Verschmutzungen, die eingedämmt bleiben sollen (siehe Absatz zur Philosophie der Grenzwerte in der Trinkwasserverordnung). Im Jahr 2014 leitete die EU gegen Deutschland ein Vertragsverletzungsverfahren wegen überhöhter Nitratwerte im Grundwasser ein. Ein weiteres Verfahren wird vorbereitet.[18]
Ende 2015 hat sich der Sachverständigenrat für Umweltfragen (SRU) für die Erarbeitung einer nationalen Stickstoffstrategie ausgesprochen, denn 27 % aller Grundwasserkörper seien aufgrund des zu hohen Nitratgehaltes in einem schlechten chemischen Zustand.[19] Nitrat in den Gärresten von Biogasanlagen können ebenfalls das Grundwasser belasten, wenn die ausgebrachten Mengen den Pflanzenbedarf übersteigen. Deshalb sollten Gärreste separiert und Nährstoffe aus der Region exportiert werden, wenn anfallende Mengen an Gülle und Gärrest den Nährstoffbedarf in der Region übersteigen.[20] Mit dem Ziel die Nitratwerte im Grundwasser zu senken und somit die Strafzahlungen der EU abzuwenden, wurde 2017 in Deutschland die Düngeverordnung verschärft. In einigen Regionen werden die Nitratgrenzwerte nach wie vor überschritten, so dass Deutschland erneut handeln muss.[21] Auch in der Schweiz hat sich die Situation kaum verbessert und die Grenzwerte werden nach wie vor nicht immer eingehalten.[22][23]
Nitrate in Lebensmitteln
In der EU werden die Höchstmengen an Nitrat in Lebensmitteln durch die Verordnung (EG) Nr. 1881/2006 geregelt. Die jeweiligen Höchstgrenzen hängen dabei vom Erzeugnis aber auch von der Verarbeitung ab und orientieren sich auch daran, was durch gute Herstellungspraxis oder gute landwirtschaftliche Praxis erreichbar ist: Spinat, frisch (3500 mg/kg) und gefroren (2000 mg/kg), Eisbergsalat, unter Glas/Folie (2500 mg/kg) oder im Freiland (2000 mg/kg), andere Salate, je nach Erntedatum und Anbauart (3000 – 5000 mg/kg), Rucola, je nach Erntedatum (6000 – 7000 mg/kg), Beikost für Säuglinge und Kleinkinder (200 mg/kg).[24]
Salpeter
Salpeter ist der Trivialname einiger häufig vorkommender Nitrate. Er ist wohl über Dissimilation entstanden aus mittelhochdeutsch/mittellateinisch salniter (wie sal nitri[25] Bezeichnung für gereinigten Salpeter[26]), zusammengesetzt aus lateinisch sal, ‚Salz‘, und ägyptisch nṯr(.j), ‚Natron‘. Eine Verwandtschaft besteht mit hebräisch neter und deutsch „Natron“.[27][28] Im Deutschen Wörterbuch der Brüder Grimm wird die Deutung auf das lateinische sal petrae, „Felsensalz“, „Steinsalz“ zurückgeführt.[29]
Im Einzelnen unterscheidet man folgende Salpeterarten:
- Ammonsalpeter, brennbarer Salpeter (Ammoniumnitrat)
- Barytsalpeter (Bariumnitrat)
- Chilesalpeter, Natronsalpeter (Natriumnitrat)
- Bengalsalpeter, Kalisalpeter (Kaliumnitrat)
- Kalksalpeter, Mauersalpeter (Calciumnitrat)
In der Natur können diese Mineralien auf unterschiedlichen Wegen entstehen. Nitratsalze bilden sich in ariden, heißen, vegetationslosen Gebieten bei biochemischen Zersetzungen (Oxidation) von stickstoffhaltigen organischen Substanzen (Guano und andere Exkremente von Vögeln und Tieren), ebenso von Mikroalgen, Stickstoffbakterien u. a.
Des Weiteren kann Salpeter durch atmosphärische Stickstoffbindung und durch die Korrosionswirkung von Salpetersäure auf Gesteinstrümmer im Wüstenboden gebildet werden. Nitrate entstehen aus Tuffen in ausgedehnten Liparit-Formationen.
In früherer Zeit wurden die Hersteller des Salpeters[30] als Salpetersieder bezeichnet. Historisch sind Kali- und Chilesalpeter nicht nur als Sauerstoffspender im Sprengsalpeter (Schwarzpulver) von Bedeutung. Salpeter war bis zur Entdeckung des Haber-Bosch-Verfahrens zur Herstellung von Ammoniak die einzige Quelle für größere Mengen von Stickstoff-Verbindungen, insbesondere für Nitratdünger und Salpetersäure. Er wurde weltweit verschifft (siehe Salpeterfahrt). Daher ergaben sich bis ins 20. Jahrhundert Konflikte um diesen Rohstoff, z. B. der Salpeterkrieg in Südamerika 1879 bis 1884. Mehrere Bauernaufstände im Hotzenwald führten im 18. und 19. Jahrhundert zu den Salpetererunruhen. Das Salpeterversprechen, ein Vertrag zwischen Carl Bosch und der Obersten Heeresleitung von 1914, sollte die synthetische Herstellung von Salpeter im industriellen Rahmen ermöglichen.[31]
Nachweise
Die Umsetzung mit Schwefelsäure und Salicylsäure führt zu einem intensiv gelben Reaktionsprodukt, das nach DIN 38405-29 (Deutsche Einheitsverfahren D29), modifiziert nach ISO 7890-3, zu einer empfindlichen Bestimmung des Nitratgehalts in Wasserproben genutzt werden kann.
Qualitative Nachweismethoden sind:
- Ringprobe
- Reduktion mit Devarda-Legierung zu Nitrit und anschließender Nachweis mit Lunges Reagenz
- Griess-Ilosvay-Reaktion
- qualitativ und quantitativ mit dem Reagenz nach Busch
Ester der Salpetersäure
Bedeutung
| Name | Formel | |
|---|---|---|
| Ethylnitrat |  | |
| Glycerintrinitrat | 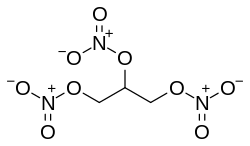 | |
| Zellulosenitrat |  | |
| Weitere Beispiele siehe Kategorie:Salpetersäureester | ||

Organische Nitrate – die Salpetersäureester – sind Verbindungen, die sich explosionsartig zersetzen können. Daher finden die Ester von Polyalkoholen als Explosivstoffe Verwendung (z. B. Nitropenta, Pentaerythrittrinitrat oder Glycerintrinitrat). Cellulosenitrat mit unterschiedlichen Nitrierungsgraden findet Verwendung in der Pyrotechnik, ist ein Bestandteil in Nitrozelluloselacken (Nitrolacke) und in Zelluloid.
Synthese
Ester der Salpetersäure werden durch Veresterung eines Alkohols mit konzentrierter Salpetersäure erhalten. Die Bildung ist spontan und schwach exotherm. Sie erfordert lediglich etwas konzentrierte Schwefelsäure als Katalysator.
Literatur
- Ulrich Rohmann, Heinrich Sontheimer: Nitrat im Grundwasser – Ursachen, Bedeutung, Lösungswege. ZfGW-Verlag, Frankfurt am Main 1985, ISBN 3-922671-12-8.
- Lutz Keppner, Frauke Grimm, Dagmar Fischer: Nitratbericht 2016. Hrsg.: BMUB, BMEL. 2017, OCLC 975369560 (bmub.bund.de [PDF] freier Volltext).
Einzelnachweise
- ↑ Wensheng Ge, Greg Michalski, Keqin Cai: The Characteristics and Genesis of the Massive Nitrate Deposits in the Turpan-Hami Basin of Xinjiang, China. In: Acta Geologica Sinica. Band 88, s1, 2014, S. 218–219, doi:10.1111/1755-6724.12269_9 (geojournals.cn [PDF]).
- ↑ Yan Qin, Yanhe Li, Huiming Bao, Feng Liu, Kejun Hou, Defang Wan, Cheng Zhang: Massive atmospheric nitrate accumulation in a continental interior desert, northwestern China. In: Geology. Band 40, Nr. 7, 2012, S. 623–626, doi:10.1130/G32953.1 (lmr.imr.net.cn [PDF]).
- ↑ Tamara Kolbe, Jean-Raynald de Dreuzy u. a.: Stratification of reactivity determines nitrate removal in groundwater. In: Proceedings of the National Academy of Sciences. 116, 2019, S. 2494, doi:10.1073/pnas.1816892116.
- ↑ Heinz Lüllmann, Klaus Mohr, M. Wehling: Herz und Kreislauf. In: Pharmakologie und Toxikologie. Arzneimittelwirkungen verstehen – Medikamente gezielt einsetzen. Georg Thieme Verlag, Stuttgart / New York 2016, S. 127–170.
- ↑ Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF): Nationale Versorgungsleitlinie Chronische Herzinsuffizienz – Langfassung. 2017; Version 2.
- ↑ Oliver Zemek, Reto Neuweiler, Walter Richner, Frank Liebisch, Ernst Spiess: Abschätzung und Reduktion der Nitratauswaschung im Gemüsebau. (PDF; 173 KB) In: Agrarforschung Schweiz 11, 76–81, 2020. Abgerufen am 12. Mai 2020.
- ↑ Entschließung des Rates vom 28. Juni 1988 über den Schutz der Nordsee und anderer Gewässer in der Gemeinschaft, EG Abl. Nr. C 328 vom 7. Dezember 1987, S. 1.
- ↑ Richtlinie des Rates vom 12. Dezember 1991 zum Schutz der Gewässer vor Verunreinigung durch Nitrat aus landwirtschaftlichen Quellen (91/676/EWG), EG Abl. Nr. L 375 vom 31. Dezember 1991, S. 1.
- ↑ Urteil des Gerichtshofs vom 21. Juni 2018 in der Rechtssache C-543/16. Abgerufen am 20. März 2023.
- ↑ Verordnung über den Umgang mit Nährstoffen im Betrieb und betriebliche Stoffstrombilanzen (StoffBilV) vom 14. Dezember 2017, BGBl. I S. 3942; 2018 I S. 360.
- ↑ Martin Ledig, Georg Wittke: Nitrat in Lebensmitteln. In: Naturwissenschaften im Unterricht. Chemie. 5, Nr. 42, 1994, 23, S. 7–12.
- ↑ Was ist Nitrat und wie kommt es ins Grundwasser? - LfU Bayern. Abgerufen am 22. Dezember 2022.
- ↑ BAFU/BAG (Hrsg.): Umwelt und Gesundheit in der Schweiz. Eine facettenreiche Beziehung (= Umwelt-Zustand. Nr. 1908). Bern 2019, S. 23 (admin.ch [PDF; 5,1 MB; abgerufen am 19. November 2019]).
- ↑ RIS - Trinkwasserverordnung - Bundesrecht konsolidiert, Fassung vom 25.05.2024. Abgerufen am 25. Mai 2024.
- ↑ Merkblatt Nr. 1.6/2 Stand: September 2013 Ansprechpartner: Referat 91 - Möglichkeiten der Nitratentfernung aus dem Trinkwasser, abgerufen am 10. August 2024
- ↑ gwf-wasser.de - Hersteller plant erstmals zwölf CARIX-Anlagen gleichzeitig, 24. März 2021, abgerufen am 10. August 2024
- ↑ Jörg Schullehner, Birgitte Hansen, Malene Thygesen, Carsten B. Pedersen, Torben Sigsgaard: Nitrate in drinking water and colorectal cancer risk: A nationwide population-based cohort study. In: International Journal of Cancer. 143. Jahrgang, Nr. 1, 2018, S. 73–79, doi:10.1002/ijc.31306.
- ↑ EU schlägt Alarm: Staatlich geduldete Brunnenvergiftung, Artikel bei wdr.de. Aufgerufen am 30. November 2015.
- ↑ Deutscher Bundestag, Experten fordern Stickstoffstrategie, 11. November 2015
- ↑ Deutschlandfunk, Zuviel Nitrat im Grundwasser, 23. Oktober 2013
- ↑ Heike Jahberg: Streit ums Düngen: Bauern wollen weiter Mist machen. In: tagesspiegel.de. 4. April 2019, abgerufen am 4. April 2019.
- ↑ Nitrat im Wasser. In: Agrarbericht 2020. Archiviert vom (nicht mehr online verfügbar) am 19. April 2021; abgerufen am 19. April 2021.
- ↑ Nitrat im Grundwasser. In: bafu.admin.ch. 29. August 2018, abgerufen am 17. Juni 2019.
- ↑ Verordnung (EG) Nr. 1881/2006 der Kommission vom 19. Dezember 2006 zur Festsetzung der Höchstgehalte für bestimmte Kontaminanten in Lebensmitteln, Anhang Abschnitt 1.
- ↑ Vgl. Otto Zekert (Hrsg.): Dispensatorium pro pharmacopoeis Viennensibus in Austria 1570. Hrsg. vom österreichischen Apothekerverein und der Gesellschaft für Geschichte der Pharmazie. Deutscher Apotheker-Verlag Hans Hösel, Berlin 1938, S. 154 (Sal Nitri: Unreiner Salpeter).
- ↑ Wilhelm Hassenstein, Hermann Virl: Das Feuerwerkbuch von 1420. 600 Jahre deutsche Pulverwaffen und Büchsenmeisterei. Neudruck des Erstdruckes aus dem Jahr 1529 mit Übertragung ins Hochdeutsche und Erläuterungen von Wilhelm Hassenstein. Verlag der Deutschen Technik, München 1941, S. 40 (Salniter).
- ↑ Salpeter. In: Digitales Wörterbuch der deutschen Sprache. Abgerufen am 15. Oktober 2017
- ↑ Friedrich Kluge, Alfred Götze: Etymologisches Wörterbuch der deutschen Sprache. 20. Aufl., hrsg. von Walther Mitzka. De Gruyter, Berlin / New York 1967; Neudruck („21. unveränderte Auflage“) ebenda 1975, ISBN 3-11-005709-3, S. 622.
- ↑ Salpeter. In: Jacob Grimm, Wilhelm Grimm (Hrsg.): Deutsches Wörterbuch. Band 14: R–Schiefe – (VIII). S. Hirzel, Leipzig 1893, Sp. 1700–1701 (woerterbuchnetz.de).
- ↑ A. R. Williams: The production of saltpetre in the middle ages. In: Ambix. Band 22, Nr. 2, 1975, S. 125–133, doi:10.1179/amb.1975.22.2.125.
- ↑ Thomas M. Klapötke: N: Stickstoff – ein Element schreibt Weltgeschichte. Herausgegeben von Gerhard Ertl und Jens Soentgen. In: Angewandte Chemie. Band 127, Nr. 52, 2015, S. 15833–15833, doi:10.1002/ange.201510425.
Weblinks
- Nitrat, Nitrit und Nitrosamine: Alles Wurscht?
- Bundesamt für Landwirtschaft: Informationen der Behörden über Nitrat im Trinkwasser (Schweiz)
- Bundesamt für Umwelt: Nitrat im Grundwasser (Schweiz)
- Salpeter in der „Oekonomische Encyklopädie von J. G. Krünitz“
- Nitrat – das neue Brainfood. Vom Umweltgift zum Therapeutikum
Auf dieser Seite verwendete Medien
Ethylnitrat
Chemical structure of nitroglycerin
Organische_Nitroester
Autor/Urheber: Jü, Lizenz: CC0
40 mm Tischtennisbälle (aus Zelluloid) gemäß der aktuell gültigen ITTF-Regeln
Autor/Urheber:
- Cicle_del_nitrogen_ca.svg: Johann Dréo (User:Nojhan), traduction de Joanjoc d'après Image:Cycle azote fr.svg.
- derivative work: Burkhard (talk)
Stickstoffzyklus
Resonance hybrid of the nitrate ion, [NO3]−.
Structure drawn in ChemBioDraw Ultra 12.0.Autor/Urheber: Kopiersperre, Lizenz: CC BY-SA 4.0
Beschriftung auf einem Sack Kalksalpeter 15 (+26 CaO)









