Nickelorganische Verbindungen

Nickelorganische Verbindungen sind metallorganische Verbindungen, die eine Nickel-Kohlenstoff-Bindung aufweisen. Die erste Verbindung dieser Klasse war das Nickeltetracarbonyl, ein Metallcarbonyl, das Ludwig Mond bereits 1890 beschrieb und im Mond-Verfahren zur Nickelgewinnung einsetzte. Nickelorganische Verbindungen werden als Synthesebausteine in der Organischen Chemie und in der chemischen Gasphasenabscheidung eingesetzt. Die chemische Industrie nutzt nickelorganische Verbindungen als Katalysator für technischer Anwendungen wie Hydrierungen, Carbonylierungen, Hydrocyanierungen oder im SHOP (Shell Higher Olefin Process).
Geschichte
Ludwig Mond, einer der Mitbegründer der Imperial Chemical Industries, untersuchte in den Jahren um 1890 zusammen mit Carl Langer und Friedrich Quincke die Chemie des Nickeltetracarbonyls. Bei ihren Versuchen behandelten sie Nickel mit Kohlenstoffmonoxid. Dabei erhielten sie einen Stoff, der die Gasflamme eines Bunsenbrenners grünlich-gelb färbte und beim Erhitzen im Glasrohr einen Nickelspiegel bildete. Die gefundene Verbindung ließ sich zu einer farblosen, wasserklaren Flüssigkeit mit einem Siedepunkt von 43 °C kondensieren.[1] Ludwig Mond setzte Nickeltetracarbonyl großtechnisch zur Gewinnung von hochreinem Nickel nach dem Mond-Verfahren ein. Paul Sabatier stellte später Versuche mit Nickel, Wasserstoff und Ethen an, um die zum Nickeltetracarbonyl analoge Ethenverbindung herzustellen.[2] Sabatier entdeckte dabei die Hydrierung mittels Nickelkontakten, der gesuchte Komplex Trisethennickel(0) wurde erst viele Jahre später von Günther Wilke synthetisiert.[3]
Walter Reppe entdeckte in den 1930er Jahren eine Reihe von homogenkatalytischen Reaktionen, etwa die Carbonylierung von Acetylen zu Acrylsäure mittels Nickeltetracarbonyl als Katalysator.[4] Im Jahr 1952 entdeckten Günther Wilke und seine Mitarbeiter am Max-Planck-Institut für Kohlenforschung in Mülheim an der Ruhr den „Nickeleffekt“, die durch Nickelsalze beeinflusste Umsteuerung der durch aluminiumorganische Verbindungen katalysierten Aufbaureaktion von Ethen zu Buten statt α-Olefinen.[4] Neben der daraus folgenden Entwicklung des Ziegler-Natta-Verfahrens fand die Gruppe um Wilke eine Reihe weiterer Reaktionen der Nickelorganischen Verbindungen, wie die Bildung von 1,5-Cyclooctadien, Vinylcyclohexen oder 1,5,9-Cyclododecatrien aus 1,3-Butadien.[4] Wilke studierte auch den Einfluss von Phosphan-Liganden auf die Steuerung der Produktverteilung, die Einblicke in den Mechanismus der untersuchten Reaktionen erlaubte. Wilhelm Keim nutzte in den 1970er Jahren nickelorganische Verbindungen für die Oligomerisierung von Ethen zu α-Olefinen im SHOP-Prozess.[5]
Verbindungen
Nickelorganische Verbindungen weisen meist die Oxidationszahl 0 oder +2 auf. Nickel bildet mit einer Reihe von Komplexen mit Liganden wie Olefinen, Kohlenstoffmonoxid oder Phosphanen. Auch Carben- oder Sandwichkomplexe wie Nickelocen sind bekannt. Komplexe, die nur einen Ligandtypen enthalten, werden als reine oder homoleptische Komplexe bezeichnet. Enthalten die Komplexe neben verschiedenartige Liganden, werden die Komplexe gemischte oder heteroleptische Komplexe genannt.
Homoleptische Nickel-Komplexe
Nickel-Olefin-Komplexe

In reinen Nickel-Olefin-Komplexe weist Nickel die Oxidationsstufe 0 auf. Ein typischer Vertreter der Nickel-Olefin-Komplexe ist das Bis-[cyclooctadien-(1,5)]-nickel(0). Es entsteht durch Reduktion von Nickelsalzen in Gegenwart des 1,5-Cyclooctadiens; andere chelatisierende Olefinkomplexe sind auf analoge Weise erhältlich.[6] Die Komplexe lassen sich über Austauschreaktionen des Olefins in einander überführen.[6] Bis-[cyclooctadien-(1,5)]-nickel(0), ein 18-Elektronenkomplex, eignet sich zur Darstellung vieler anderer Nickelorganischen Verbindungen. So reagiert es mit Acetylaceton zu Cycloocten-(4)-yl-(1)-nickelacetylacetonat.[6]
Nickel-Cyclopentadienyl-Komplexe

Nickel bildet verschiedene Cyclopentadienyl-Komplexe. Ein bekannter Komplex ist das Nickelocen, ein Metallocen, das durch Salzmetathese aus Natriumcyclopentadienid und Nickel(II)-chlorid hergestellt werden kann und eine ähnliche Struktur wie Ferrocen aufweist. Nickel besitzt in diesem Komplex die Oxidationszahl +2. Der Komplex weist eine 20-Elektronenstruktur auf, wobei Nickel acht und die beiden Cyclopentadienyl-Anionen jeweils sechs Elektronen beisteuern. Daher ist der Komplex empfindlich gegen Oxidationsmittel.
Nickelocen reagiert mit Oxidationsmitteln Carbonium-Ionen wie dem Triphenylmethylkation [C(C6H5)3]+ unter Bildung eines zweikernigen Tripeldeckerkomplex-Kations der Zusammensetzung [Ni2(C5H5)3]+.[7]
Nickel-Allyl-Komplexe

Die ersten homoleptischen Nickel-Allyl-Komplexe wurden von Wilke bei der Umsetzung von [(trans, trans, trans-1,5,9-Cyclododecatrien)Ni(0)] mit 1,3-Butadien gefunden.[8] Die Synthese des Bis(π-allyl)nickel (Ni(η3-C3H5)2) gelingt durch Umsetzung von [Bis(1,5-Cyclooctadien)Nickel(0)] mit Allylhalogeniden wie Allylchlorid und weiterer Reaktion mit Ammoniak.
Heteroleptische Nickel-Komplexe
Nickel-Carben-Komplexe
Nickel bildet Carbenkomplexe, die eine Nickel-Kohlenstoff-Doppelbindung enthalten.[9]
Reaktionen
Oligomerisierungen
Nickelorganische Verbindungen katalysieren die Oligomerisierung von Alkenen und Alkinen. Die Eigenschaft wurde bei der Entwicklung der Ziegler-Katalysatoren als Nickel-Effekt am Max-Planck-Institut für Kohlenforschung entdeckt. Spuren von Nickel im Autoklaven störten dabei die Aufbaureaktion zugunsten der Abbruchreaktion; als Produkt entstand aus Ethen 1-Buten. Acetylen lässt sich durch Nickelorganische Komplexe zu Cyclooctatetraen zyklisieren.
Formal handelt es sich hierbei um eine [2+2+2+2]-Cycloaddition. Die Oligomerisierung von 1,3-Butadien mit Ethen zu trans-1,4-Hexadien wurde früher im technischen Maßstab durchgeführt.
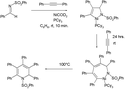
Durch eine formale [2+2+2]-Cycloaddition lassen sich Alkine cyclotrimerisieren. Die Methode kann auch unter Verwendung von Arinen zur Darstellung von Naphthalen-Derivaten verwendet werden.[10] Das Arin kann in situ erzeugt werden.
Die Bildung von Nickelorganischen Verbindungen in diesen Reaktionen ist nicht immer offensichtlich, doch unter geeigneten experimentellen Bedingungen können diese quantitativ dargestellt werden:[11]
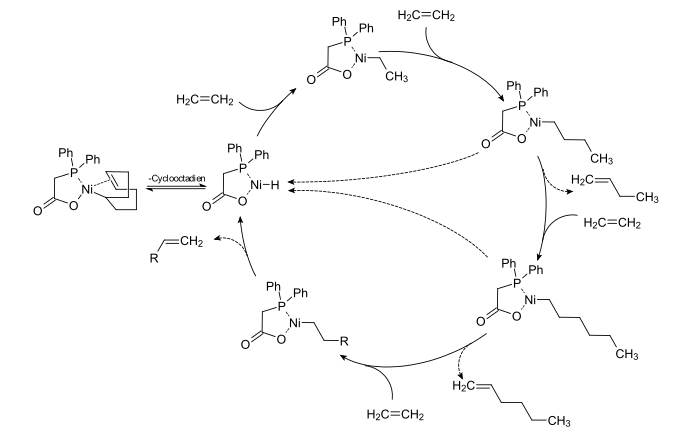
Die Oligomerisierung von Ethen zu α-Olefinen wurde durch Wilhelm Keim entwickelt. Als aktiver Katalysator gilt das Nickel-Hydrid, dass durch Abspaltung des Cyclooctadien-Liganden aus dem Start-Olefin-Komplex gebildet wird. Durch Insertion von Ethen in die Nickel-Wasserstoff-Bindung entstehen Oligomere, die durch β-Elimination α-Olefine verschiedener Kettenlänge, jedoch immer mit einer geradzahligen Anzahl von Kohlenstoffatomen. Es wird angenommen, dass der Diphenylphospinoessigsäureligand die Kettenlängenverteilung der entstehenden Olefine beeinflusst.
Kupplungsreaktionen
Nickelorganische Verbindungen bewirken Kupplungsreaktionen zwischen Allylhalogeniden und Arylhalogeniden. Andere Kupplungsreaktionen unter Nickelkatalyse sind die Kumada-Kupplung und die Negishi-Kupplung.
Carbonylierung
Nickelorganische Verbindungen katalysieren die Addition von Kohlenstoffmonoxid an Alkene und Alkine. Die industrielle Produktion von Acrylsäure wurde zeitweise durch die Reaktion von Acetylen, Kohlenstoffmonoxid und Wasser bei Drücken von 40 bis 55 bar und Temperaturen von 160 bis 200 °C durchgeführt.
Hydrocyanierung
Nickelorganische Verbindungen katalysieren die Addition von Cyanwasserstoff an Olefine. Werden Diolefine eingesetzt, gelingt die Synthese von Dinitrilen, die zu wichtigen Monomeren wie Diamiden, Diaminen der Disäuren weiterverarbeitet werden können. Als Ausgangsverbindung dienen Nickel-Phophin-Komplexe, die im katalytischen Zyklus Nickel-Phosphin-Allyl-Komplexe bilden.[12]
Literatur
- Günther Wilke: Über nickelorganische Verbindungen. In: Pure and Applied Chemistry. 17, 1968, S. 179–194, doi:10.1351/pac196817020179.
- Günther Wilke: Beiträge zur nickelorganischen Chemie. In: Angewandte Chemie. 100, 1988, S. 189–211, doi:10.1002/ange.19881000113.
Einzelnachweise
- ↑ Ludwig Mond, Carl Langer, Friedrich Quincke: Action of carbon monoxide on nickel. In: Journal of the Chemical Society, Transactions. 57, 1890, S. 749–753, doi:10.1039/CT8905700749.
- ↑ Günther Wilke: Homogene Katalyse durch Übergangsmetall-Verbindungen. In: Beobachtung, Experiment und Theorie in Naturwissenschaft und Medizin. Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart 1987, ISBN 3-8047-0912-5, S. 275–286.
- ↑ Karl Fischer, Klaus Jonas, Günther Wilke: Tris(äthylen)nickel(0). In: Angewandte Chemie. 85, 1973, S. 620–621, doi:10.1002/ange.19730851408.
- ↑ a b c Wilhelm Keim: Nickel: Ein Element mit vielfältigen Eigenschaften in der technisch-homogenen Katalyse. In: Angewandte Chemie. 102, 1990, S. 251–260, doi:10.1002/ange.19901020305.
- ↑ Wilhelm Keim: Oligomerisierung von Ethen zu α-Olefinen: Erfindung und Entwicklung des Shell-Higher-Olefin-Prozesses (SHOP). In: Angewandte Chemie. 125, 2013, S. 12722–12726, doi:10.1002/ange.201305308.
- ↑ a b c Borislav Bogdanović, Michael Kröner, Günther Wilke: Übergangsmetallkomplexe, I. Olefin-Komplexe des Nickels(0). In: Justus Liebigs Annalen der Chemie. 699, 1966, S. 1–23, doi:10.1002/jlac.19666990102.
- ↑ Helmut Werner, Albrecht Salzer: Die Synthese Eines Ersten Doppel-Sandwich-Komplexes: Das Dinickeltricyclopentadienyl-Kation. In: Synthesis and Reactivity in Inorganic and Metal-Organic Chemistry. 2, 1972, S. 239–248, doi:10.1080/00945717208069606.
- ↑ G. Wilke, M. Kröner, B. Bogdanovič: Ein Zwischenprodukt der Synthese von Cyclododecatrien aus Butadien. In: Angewandte Chemie. 73, 1961, S. 755–756, doi:10.1002/ange.19610732305.
- ↑ Wolfgang A. Herrmann: N-Heterocyclische Carbene: ein neues Konzept in der metallorganischen Katalyse N-Heterocyclische Carbene. In: Angewandte Chemie. 114, S. 1342, doi:10.1002/1521-3757(20020415)114:8<1342::AID-ANGE1342>3.0.CO;2-A.
- ↑ Jen-Chieh Hsieh, Chien-Hong Cheng: Nickel-catalyzed cocyclotrimerization of arynes with diynes; a novel method for synthesis of naphthalene derivatives. In: Chemical Communications. 2005, S. 2459, doi:10.1039/b415691a.
- ↑ Sensuke Ogoshi, Haruo Ikeda, Hideo Kurosawa: Formation of an Aza-nickelacycle by Reaction of an Imine and an Alkyne with Nickel(0): Oxidative Cyclization, Insertion, and Reductive Elimination. In: Angewandte Chemie International Edition. 46, 2007, S. 4930–4932, doi:10.1002/anie.200700688.
- ↑ B. Taylor: The addition of hydrogen cyanide to α-olefins catalyzed by nickel(0) complexes. In: Journal of Catalysis. 26, 1972, S. 254–260, doi:10.1016/0021-9517(72)90057-7.
Auf dieser Seite verwendete Medien
Skeletal reprentation of nickelocene
(c) V8rik in der Wikipedia auf Englisch, CC BY-SA 3.0
Nickeldihydroazepine intermediate
(c) V8rik at the English Wikipedia, CC BY-SA 3.0
Alkyne Trimerization Involving An Aryne
(c) V8rik at the English Wikipedia, CC BY-SA 3.0
Nickel Catalyzed Carbonylation