Nickel-Cadmium-Akkumulator
Ein Nickel-Cadmium-Akkumulator (NiCd-Akku) ist ein Akkumulator (sogenannte Sekundärzelle).
Von der grundsätzlichen Bauart ist zwischen offenen und gasdichten Zellen zu unterscheiden. Gasdichte Zellen sind häufig baugleich mit handelsüblichen Batterien und können daher als Ersatz für diese sogenannten Primärzellen verwendet werden, offene Zellen werden für stationäre Anwendungen verwendet.

Geschichte
Entwicklung und Verbreitung

Der 1899 von dem Schweden Waldemar Jungner entwickelte Nickel-Cadmium-Akkumulator gehört zu den alkalischen Batteriesystemen, an denen auch Thomas Alva Edison zu dieser Zeit arbeitete und dabei u. a. den Nickel-Eisen-Akkumulator entwickelte. Durch die Verwendung von Cadmium anstelle von Eisen konnte Jungner die Energie- und Stromausbeute seines Akkus gegenüber dem Vorläufer von Edison um rund 7 % steigern;[1] auch gegenüber den bis dahin vorherrschenden Bleiakkumulatoren bot der NiCd-Akkumulator zahlreiche Vorteile, nicht zuletzt den, dass der Elektrolyt während der Ladung und Entladung des Akkumulators unverändert blieb.
1910 begann die industrielle Fertigung der NiCd-Akkumulatoren in Schweden. Diese ersten Exemplare hatten sogenannte Taschenelektroden, die auch heute noch üblich sind. Ungefähr 1930 wurden in Deutschland sogenannte Sinterelektroden entwickelt. Das Prinzip der gasdichten Zellen wurde 1933 von Adolf Dassler[2] veröffentlicht. Serienreife gasdichte Zellen waren in den 1950er Jahren verfügbar. 1983 stellte die Firma Hoppecke Batterien eine Faserstruktur-Nickel-Cadmium-Batterie mit FNC-Technologie (Faserstruktur-Technologie) vor. Anders als bei Taschenplatten und Sinterelektroden ist der Träger für das aktive Material kein schweres, steifes Metall, sondern ein leichtes und flexibles Vlies aus vernickelten Polypropylenfasern. Dieses metallisierte-Faserstruktur-Vlies wurde ursprünglich für so anspruchsvolle Einsatzbereiche wie die Luft- und Raumfahrt sowie für Elektro- und Hybridfahrzeuge entwickelt.
Bis in die 1990er Jahre hatte sich der NiCd-Akkumulator immer weiter verbreitet. Danach stieg der Marktanteil des Nickel-Metallhydrid-Akkumulators (NiMH) und später wurde auch dieser von den Lithium-Akkumulatoren verdrängt, da sie höhere Energiedichten haben.
EU-weites Verbot
Im Dezember 2004 verabschiedete der EU-Ministerrat eine Richtlinie, um die technische Nutzung von Cadmium zu reduzieren. Vorbehaltlich der Zustimmung des EU-Parlaments war vorgesehen, dass die Mitgliedsstaaten innerhalb von zwei Jahren das Inverkehrbringen von Nickel-Cadmium-Akkus durch nationale Gesetze verbieten. Auf Wunsch einiger Mitgliedsstaaten, darunter auch Deutschland, wurden unter anderem schnurlose Elektrowerkzeuge von dem Verbot zunächst ausgenommen, weil „für Elektrowerkzeuge nicht sichergestellt ist, dass gleichwertiger Ersatz aktuell verfügbar ist“. Diese Ausnahme sollte vier Jahre nach Inkrafttreten der Richtlinie überprüft werden, um das Cadmium-Verbot dann möglicherweise auszudehnen. Siehe auch RoHS.
2006 nahm das Europäische Parlament eine veränderte Version der Richtlinie an, welche Batterien und Akkumulatoren mit mehr als 0,002 Gewichtsprozent Cadmium verbietet.[3]
Durch das am 1. Dezember 2009 in Kraft getretene Batteriegesetz (BattG) hat der deutsche Gesetzgeber die Richtlinie in nationales Recht umgesetzt. § 3 Abs. 2 BattG verbietet das Inverkehrbringen entsprechend cadmiumhaltiger Batterien mit Ausnahme von solchen für Not- oder Alarmsysteme, Notbeleuchtung und medizinische Ausrüstung. Kabellose Elektrowerkzeuge waren bis zum 31. Dezember 2016 von dem Verbot ausgenommen.
Eigenschaften

NiCd-Akkumulatoren haben eine nominale Spannung von 1,2 V, die somit 20 % unter den 1,5 Volt normaler Batterien liegt. Das stellt jedoch meist kein Problem dar, da die meisten Geräte auf niedrige Spannungen von 0,9–1,0 V entladener Batterien ausgelegt sind. Durch ihren geringen Innenwiderstand können NiCd-Akkumulatoren hohe Ströme liefern. Sie werden u. a. deswegen im Modellbau und bei anderen Hochstromanwendungen bevorzugt genutzt. NiCd-Akkus müssen bei einer Restspannung (Entladeschlussspannung) von 0,85–0,9 V wieder aufgeladen werden. Eine weitergehende Entladung führt zu Tiefenentladung mit ähnlichen Auswirkungen wie bei der Bleibatterie. Der Memory-Effekt ist schwach ausgeprägt.
Eine bei anderen Technologien selten anzutreffende Eigenschaft ist das hervorragende Tieftemperaturverhalten von NiCd-Akkumulatoren. Selbst bei −40 °C besitzt ein Akku mit Faserstrukturplatten-Technik noch über 50 % seiner nominellen Kapazität bei Raumtemperatur.
Aufbau

Die Elektroden des NiCd-Akkumulators bestehen in geladenem Zustand aus Platten, die am Minuspol mit fein verteiltem Cadmium und am Pluspol mit Nickel(III)-oxidhydroxid beladen sind. Als Elektrolyt wird 20%ige Kaliumhydroxid-Lösung verwendet. Diese Kombination liefert eine Spannung von 1,3 V.[4]
Bei Überladung des Akkumulators wird an der negativen Elektrode Wasserstoff und an der positiven Elektrode Sauerstoff produziert; man sagt der Akku „gast“. In geschlossenen, also gasdichten Zellen muss dies wegen der Explosionsgefahr unbedingt verhindert werden. Aus diesem Grund wird die negative Cadmiumelektrode überdimensioniert und dient als negative Entladereserve. Die positive Nickelelektrode enthält etwas Cadmiumhydroxid als „antipolare Masse“. Bei Überladung mit geringeren Laderaten (ca. 0,1 C) stellt sich so ein Gleichgewicht zwischen Sauerstofffreisetzung und -verbrauch ein, es wird kein Wasserstoff entwickelt.
In gasdichten Faserstruktur-NiCd-Zellen wird der entstehende Sauerstoff an einer katalytisch wirksamen Oberfläche der Faserstruktur-Rekombinationselektrode so schnell rekombiniert, dass im Betrieb sogar ein leichter Unterdruck entsteht.
Ladung
Elektrochemie
NiCd-Akkumulatoren bestehen aus folgenden Komponenten:
- einem Elektrolyten, meist 20-prozentiger Kaliumhydroxidlösung
- einer negativen Elektrode: Cd
- einer positiven Elektrode: NiO(OH)
- einem Separator
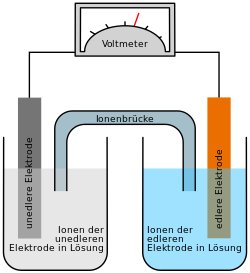
Entladevorgang: An der Anode / negativen Elektrode wird Cadmium zum Cadmiumhydroxid (Cd(OH)2) oxidiert. Die freiwerdenden Elektronen fließen dann über den Verbraucher zur Kathode / positiven Elektrode. Dort wird das Nickel(III)-oxidhydroxid NiOOH zu Nickel(II)-hydroxid Ni(OH)2 reduziert.
Standardelektrodenpotentiale: E(Cd/Cd2+) = −0,81 V (in basischer Lösung); E(NiO(OH)/Ni(OH)2)= +0,49 V
Reaktionen:
Negative Elektrode: Positive Elektrode: Gesamtreaktion:
- : Entladung
- : Ladung
Ladevorgang: Die Reaktionen laufen in umgekehrter Richtung ab, die Cadmium-Elektrode ist dann ebenfalls Minuspol, aber Kathode, da hier reduziert wird, die Nickelelektrode ist entsprechend Pluspol / Anode, an dem eine Oxidation abläuft.
Überladen: Gegen Ende des Ladezyklus steigt die Zellspannung an, ab etwa 1,55 bis 1,6 V wird die Zersetzungsspannung des Wassers unter den Bedingungen der Zelle überschritten, es kommt zum Gasen:
| Negative Elektrode: | |
| Positive Elektrode: | |
| Gesamtreaktion: |
In gasdichten NiCd-Akkus wird ein Überschuss von Cadmium(II)-hydroxid verwendet. Am Pluspol entsteht beim Überladen Sauerstoff, während am Minuspol noch Cd2+ reduziert wird. Der Sauerstoff reagiert dann mit Cadmium weiter zu Cadmium(II)-hydroxid und wird so gleich wieder verbraucht.
Probleme
NiCd-Akkus enthalten das giftige Schwermetall Cadmium und müssen daher über besondere Rücknahmesysteme gesondert entsorgt werden (siehe Abschnitt Entsorgung).
Beim Überladen können NiCd-Akkumulatoren beschädigt werden:
- Ausgasen durch Überhitzung/Überladung (irreversibel)
- Entstehen von γ-NiOOH und dadurch Spannungsabfall (44–50 mV)
- Entstehen von intermetallischer Verbindung Ni5Cd21 und dadurch Spannungsabfall (120 mV)
Auch Falschladung (Verpolen) beschädigt eine Zelle durch Ausgasen an der Anode. Dadurch entsteht auch hochentzündlicher Wasserstoff. Die Falschpolung einer Zelle innerhalb eines Akkupacks tritt bereits bei Tiefentladung auf. Die Zellen sind in Reihe geschaltet. Wenn die schwächste Zelle entladen ist, liegt an ihrer negativen Elektrode der Pluspol, an der positiven Elektrode der Minuspol der Nachbarzellen.
Hohe Ladezustände bei der Lagerung von NiCd-Akkus führen zu Kristallwachstum an der Cd-Elektrode. Kristalle können die Trennschichten durchbohren und so einen inneren Kurzschluss der Zelle verursachen. NiCd-Akkus lassen sich am besten bei 40 % Ladezustand lagern, um eine Tiefentladung zu vermeiden und ein Kristallwachstum zu reduzieren.
Vorteile
NiCd-Zellen sind bei Tiefentladung und Überladung robuster als NiMH- und Lithium-basierte Akkumulatoren. So können sie mehrere Jahre in entladenem Zustand gelagert werden, ohne Schaden zu nehmen.[5] Auch kann in einer Batterie aus reihengeschalteten NiCd-Zellen ein einheitlicher Ladezustand erreicht werden, indem diese gezielt mit geringem Strom (1/10 der Kapazität pro Stunde) überladen wird. Zellen mit einem bereits hohen Ladestand wandeln die überschüssige Energie in Wärme um, ohne dabei irreversible Schäden zu erleiden. Dieses Verfahren ist bei anderen Akkutypen nicht oder nur eingeschränkt möglich. Weiterhin haben NiCd-Zellen günstige Eigenschaften bei Temperaturen unter 0 °C.
Beide Eigenschaften sind bei sicherheitskritischen Anwendungen von Bedeutung, so dass hier in vielen Fällen Lithium- oder NiMH-Akkumulatoren nicht geeignet sind.
Entsorgung

Aufgrund der Giftigkeit des Cadmiums dürfen NiCd-Akkus nicht über den Hausmüll entsorgt werden. Es gibt für sie besondere Rücknahmesysteme, in Deutschland etwa betrieben durch die Stiftung Gemeinsames Rücknahmesystem Batterien.
NiCd-Akkus lassen sich bei ordnungsgemäßer Entsorgung gut wiederverwerten. Das Cadmium kann durch Destillation zurückgewonnen werden, da es einen wesentlich niedrigeren Siedepunkt als die anderen Bestandteile des Akkumulators hat (in der Regel Nickel und Stahl).[6][7]
Anwendung
Offene Zellen
- Starterbatterien für Verbrennungsmotoren und Traktionsbatterien für Elektrofahrzeuge
- Unterbrechungsfreie Stromversorgung (USV) (Notstromversorgung)
- Grubenlampen
- Zentrale Stromversorgungssysteme für Notbeleuchtung
Gasdichte Zellen
- Verbraucherbereich allgemein (Spielzeug, Fotoapparate, Elektrische Werkzeuge, Fernbedienungen usw.)
- Notbeleuchtung (Einzelbatterieleuchten)
Siehe auch
Literatur
- Lucien F. Trueb, Paul Rüetschi: Batterien und Akkumulatoren – Mobile Energiequellen für heute und morgen. Springer, Berlin 1998, ISBN 3-540-62997-1
- Thomas B. Reddy (Hrsg.): Linden's Handbook of Batteries. 4. Auflage. McGraw-Hill, New York 2011, ISBN 978-0-07-162421-3:
- Chapter 19: John K. Erbacher: Industrial and Aerospace Nickel-Cadmium Batteries
- Chapter 20: R. David Lucero: Vented Sintered-Plate Nickel-Cadmium Batteries
- Chapter 21: Joseph A. Carcone: Portable Sealed Nickel-Cadmium Batteries
- Claus Daniel, Jürgen O. Besenhard: Handbook of Battery Materials. Wiley-VCH, Weinheim 2011, ISBN 3-527-32695-2.
- Kapitel 2.2. Der Nickel-Cadmium-Akkumulator. In: P. Birke, M. Schiemann: Akkumulatoren: Vergangenheit, Gegenwart und Zukunft elektrochemischer Energiespeicher, H. Utz Verlag, München 2013, ISBN 978-3-8316-0958-1, S. 119–146
Weblinks
- Stiftung Gemeinsames Rücknahmesystem Batterien
- BMZ: Nicht alle Ladegeräte sind gleichwertig - Höhere Akkuleistung durch richtiges Laden (28. Nov. 2012)
Einzelnachweise
- ↑ Ernst Grimsehl, Walter Schallreuter, Rolf Gradewald: Lehrbuch der Physik. Band 2: Elektrizitätslehre. Teubner, 1954, ISBN 3-322-00756-1, S. 217.
- ↑ Patent DE602702: Galvanisches Element, insbesondere elektrischer Akkumulator. Veröffentlicht am 14. September 1934.
- ↑ Pressemeldung des Europäischen Parlaments
- ↑ service.projektlabor.tu-berlin.de/Akkumulator.PDF (Seite 9) Veröffentlicht am 25. April 2004
- ↑ VARTA: Gasdichte Ni-Cd-Akkumulatoren. VARTA Batterie AG (Hrsg.), Hannover.
- ↑ Stiftung gemeinsames Rücknahmesystem Batterien:Der Batteriebegriff ( vom 28. September 2007 im Internet Archive) (mit Erläuterung zum Recycling von Batterien, Stand: 17. September 2007)
- ↑ umweltbundesamt.de/das-neue-batteriegesetz Veröffentlicht am 17. Dezember 2020
Auf dieser Seite verwendete Medien
Autor/Urheber: Later versions were uploaded by Cepheiden, Alex42., Lizenz: CC BY-SA 2.0 de
Vergleich der Leistungs- und Energiedichten einiger Energiespeicher
Disassembled Ni-Cd AA cell. 1:outer metal casing (also negative terminal) 2: separator (between electrodes) 3: positive electrode 4: negative electrode with current collector (metal grid, connected to metal casing). Everything is rolled. Construction is very similar to ni-mh cell.
Autor/Urheber: LordOider, Lizenz: CC0
Ein Nickel-Cadmium-Akkumulator mit Piktogrammen zum Recycling. Dieser Akku-Pack besteht aus vier Mignon-Zellen.
Autor/Urheber: Claus Ableiter, Lizenz: CC BY-SA 3.0
Elektroantrieb der PSA Group Citroen/Peugeot: 20 kW bei 5500 Umdrehungen/Minute Gleichstrommotor, 91 km/h, Kraftübertragung mit Festübersetzung, im Hintergrund Nickel-Cadmium-Akkumulator: Kapazität 100 Ah, 120 Volt, 300 kg; Bordladegerät max. 3 kW entspricht Zugewinn 15 km Reichweite je Stunde; für Peugeot 106 Electrique, Citroen Saxo Electrique (die beiden meistverkauften), Citroen AX Electrique und die Transporter Citroen Belingo Electrique und Peugeot Partner Electrique, insgesamt über 10.000 Exemplare, bis zum Verbot der Nickel-Cadmium-Batterie, die sehr langlebig und kältefest ist. Aufgenommen im Museum Autovision, Altlußheim
Autor/Urheber: Henry Mühlpfordt / *File:Galvanic Cell.svg: Gringer, Lizenz: CC BY-SA 3.0
Galvanische Zelle