Neuroendokriner Tumor

Neuroendokrine Tumoren (NET), auch neuroendokrine Neoplasien (NEN) genannt, sind bösartige Tumoren, die ihren Ursprung im Neuroektoderm haben. In der Immunhistochemie gleichen sie endokrinen Drüsen.
Vorkommen
Epitheliale neuroendokrine Tumoren kommen vor allem im Verdauungstrakt und in der Bauchspeicheldrüse vor. Für neuroendokrine Tumoren im Magen und Darm ist auch die alte Bezeichnung Karzinoid (karzinomähnlicher Tumor) noch sehr verbreitet. Dieser sollte wie auch der Begriff APUDom (amine precursor uptake and decarboxylation) nicht mehr verwendet werden. Das kleinzellige Bronchialkarzinom und das Merkelzell-Karzinom der Haut zählen ebenfalls zu den neuroendokrinen Tumoren. Eng verwandt sind die nervenähnlichen Neuroblastome, Phäochromozytome, und Paragangliome. 75 % aller neuroendokrinen Tumoren sind im gastroenteropankreatischen System lokalisiert (Gastroenteropankreatischer Neuroendokriner Tumor – Abk. GEP-NET).[1]
Die GEP-Tumoren entwickeln sich aus endokrinen (hormonproduzierenden) Zellen, die überall im Verdauungssystem oder damit zusammenhängenden Stellen des Körpers vorkommen und die Aufgabe haben, bestimmte Stoffe zu produzieren, die den Verdauungsprozess steuern.
Von ihren Eigenschaften her besitzen diese Zellen Ähnlichkeiten mit Nervenzellen und von ihrer Funktion her zählen sie zu den inneren Drüsen. Daher werden sie neuroendokrine Zellen genannt.
Historie
Die Erstbeschreibung von neuroendokrinen Tumoren geht zurück auf Otto Lubarsch.[2] Zwanzig Jahre darauf wurde erstmals der Begriff Karzinoid von Siegfried Oberndorfer genutzt, um die neu entdeckte Form von Tumoren im Verdauungstrakt von den wesentlich aggressiveren Adenokarzinomen abzugrenzen.[3] In den darauffolgenden Jahren konnte der neuroendokrine Ursprung der Tumorzellen erhärtet werden.[4]
Epidemiologie
Neuroendokrine Tumoren des Magen-Darm-Traktes und der Bauchspeicheldrüse (GEP-NET, für Gastro-Entero-Pankreatische Neuroendokrine Tumoren, früher Karzinoide genannt), treten etwa ein- bis zweimal pro 100.000 Einwohner und Jahr auf.[5] Neuroendokrine Tumoren betreffen vorwiegend Patienten im Alter von 50 bis 70 Jahren; Frauen und Männer etwa gleich häufig. Neben den zufälligen (sporadischen) Erkrankungsfällen gibt es zwei Formen von erblichen multiplen endokrinen Neoplasien.
Hormonproduktion
Etwa 30–50 % der neuroendokrinen Tumoren produzieren hormonell wirksame Aminabkömmlinge, die auch von normalen neuroendokrinen Zellen hergestellt werden, wie etwa Gastrin aus der Magenschleimhaut, Vasoaktives intestinales Peptid aus dem Zwölffingerdarm, Insulin und Glucagon aus der Bauchspeicheldrüse. Die überschießende Hormonkonzentration dieser sogenannten „funktionell aktiven“ Tumoren kann charakteristische Symptome erzeugen. So verursacht ein Gastrin produzierender neuroendokriner Tumor, das Gastrinom, das Zollinger-Ellison-Syndrom (Übersäuerung, Magengeschwüre), VIP-produzierende Tumoren verursachen schwere Durchfälle, Glucagonome erhöhten Blutzucker, und Insulinome verursachen gefährliche Hypoglykämien. Ein wichtiges Anzeichen für Tumoren des Dünndarms ist das Serotonin-assoziierte Karzinoid-Syndrom (Bauchkrämpfe, Durchfälle, Flushs, Herzschäden).
Diagnostik
Endokrin aktive Tumoren (funktionelle NET) können frühzeitig aus den klinischen Symptomen vermutet und durch gezielte Laboruntersuchungen (etwa bei histologisch gesicherten NEN die Bestimmung von Chromogranin A im Serum[6]) des Blutes nachgewiesen werden. Inaktive Tumoren (nicht-funktionelle NET) werden oft erst spät durch ihre Größe oder infolge von Metastasen auffällig. Bildgebende Verfahren können die Lage des Tumors aufdecken: Sonographie, Computer- und Kernspintomographie, oder auch spezielle Szintigraphien wie die Somatostatin-Rezeptor-Szintigrafie mit Indium-111 oder MIBG-Szintigrafie. Neu entwickelt ist die Positronenemissionstomographie mit radioaktiv markiertem DOPA bzw. Edotreotid (DOTATOC), deren Sensitivität und Spezifität der klassischen Szintigraphie mit Somatostatinanaloga um bis zu 30 % überlegen ist.[7][8]
Klassifikation
Die Weltgesundheitsorganisation teilt seit 2010 die neuroendokrinen Tumoren nach ihrem Grading in drei Stufen ein (1a = gutartig (benigne), 1b = niedrig maligne (bösartig), 2 = hochmaligne). Eine spezifische TNM-Klassifikation wurde bereits in den Jahren 2006/07 von der ENETS (European Neuroendocrine Tumor Society) vorgeschlagen. Im Jahr 2012 hat die ENETS eine revidierte Fassung der Klassifikation der neuroendokrinen Tumoren herausgegeben.[9] Die Einteilung des Tumors nach Geschwindigkeit der Zellteilung, der Proliferation erfolgt anhand des Ki-67-Index: Grad 1 (Proliferationsindex < 2 %), Grad 2 (Proliferationsindex 2 bis 20 %) oder einem neuroendokrinen Karzinom (>20 %). Diese Unterscheidung, ebenso wie das hierzu ergänzende TNM-Staging sind wichtige prognostische Faktoren, die auch die weiteren therapeutischen Schritte maßgeblich beeinflussen.[9] 2019 wurde seitens der WHO eine Anpassung der Graduierung neuroendokriner Neoplasien (NEN) vorgenommen. Bei hochproliferativen Tumoren (>20 % Proliferationsindex) wird neu zwischen neuroendokrinen Tumoren (NET) G3 und Neuroendokrinen Karzinomen (NEC) unterschieden,[10] sodass die Einteilung neuroendokriner Neoplasien (NEN) nunmehr nach neuroendokrinen Tumoren (NET G1, G2, G3) und schlecht differenzierten neuroendokrinen Karzinomen (NEC) erfolgt. Neuroendokrine Karzinome werden nicht länger graduiert, da sie per Definition hochproliferativ sind. Sie werden jedoch nach groß- und kleinzelligem Typ unterschieden.[11] Neben NET und NEC gibt es außerdem MiNEN (gemischt neuroendokrine, nicht neuroendokrine Neoplasien).[12]
Immunhistochemie
Die Zellen neuroendokriner Tumoren exprimieren in der immunhistochemischen Färbung in der Regel die Proteine Synaptophysin, Neuronenspezifische Enolase, 5-Hydroxyindolylessigsäure (5-HIAA) im Urin und Chromogranin A.
Therapie
An erster Stelle der Behandlung der gastrointestinalen neuroendokrinen Tumoren kann die Operation stehen. Auch sehr große oder metastasierte Tumoren werden in der Regel operiert, um die Tumorlast zu verringern (debulking). Dies ist vom Stadium, der Primärlokalisation des Tumors sowie dem Stadium des Fortschreitens der Metastasen abhängig.[9] Anschließend kann eine primäre Chemotherapie im Falle eines Pankreas-NET (genannt auch PPom, abgeleitet von „Pankreatisches Polypeptid“) folgen (Streptozotocin/5FU bei Neuroendokrinen Tumoren, G1-2, Etoposid, Cisplatin bei neuroendokrinem Karzinom, G3). Interferon wurde früher bei Patienten mit niedrigem Grading genutzt, um das Wachstum des Tumors zu verlangsamen. Heutzutage stehen jedoch weitaus modernere und zielgerichtete Substanzen wie die Somatostatin-Analoga Lanreotid und Octreotid im Falle einer geringen Tumorlast zur Verfügung. Klinische Studien konnten das progressionsfreie Intervall bei Patienten mit einem niedrig proliferativen Pankreas-NET signifikant verbessern.[13] Verschiedene Antikörper und Thalidomid sind Gegenstand von Vorstudien und stehen nicht für die Patientenbehandlung zur Verfügung. Effektive prädiktive Biomarker sind allerdings nicht etabliert.[14]
Als besonders zielgerichtete Alternative gilt die Radionuklidtherapie (auch PRRT genannt): Da das Hormon Somatostatin automatisch zu den Tumoren und ihren Metastasen wandert, werden die zusätzlich einzunehmenden Somatostatin-Analoga mit radioaktiver Strahlung versetzt – so erzielt man eine punktuelle Strahlentherapie, die Tumoren im Wachstum hemmen oder sogar verkleinern kann.[15] Ein mit Iod-131 markiertes MIBG und ein mit Yttrium-90 markiertes Edotreotid (DOTATOC) sind noch in der klinischen Entwicklung und nicht zugelassen. Aufgrund von Patentstreitigkeiten sind die zu einer Radiopeptidtherapie (RPT) genutzten Peptide, z. B. DOTATOC, DOTANOC, DOTATATE in Deutschland verbreitet. 2011 bestand ein Patentrecht auf das Peptid DOTATOC, weswegen manche Therapiezentren auf die Anwendung dieses Peptides verzichten. Alternativ kann diese Therapieform auch mit Lutetium-177-DOTATATE genutzt werden. Der Vorteil von Lutetium-177 liegt bei kleineren Tumoren in der kürzeren Reichweite und verminderten toxischen Wirkung auf das Nierengewebe.[16] Die RPT hat Einzug in die Richtlinien der ENETS gefunden, jedoch gibt es keine prospektiven randomisierten Studien, die den Vorteil dieser Therapieform gegenüber anderen Ansätzen klar aufzeigen könnten. Moderne Ansätze sind zielgerichtete Therapien, welche Signalkaskaden der Tumoren fokussiert modulieren. Die beiden aktuell (Stand 2021) zugelassenen Medikamente sind Tyrosinkinase-Inhibitoren wie Sunitinib oder mTOR-Inhibitoren, wie Everolimus. Beide Substanzen haben seit 2011 eine Zulassung für die Therapie des NET des Pankreas. Es gibt zunehmend Bestrebungen, neue personalisierte Therapien bei neuroendokrinen Tumoren anzuwenden,[17] unter anderem die Kombination von Drug-Screening-Plattformen und patientenderivierten ex vivo Zellkulturen, welche relevante Aspekte des ursprünglichen Tumorgewebes aufweisen.[18][19]
Siehe auch
- Netzwerk Neuroendokrine Tumoren
Literatur
- N. Begum u. a.: Neuroendocrine tumours of the GI tract – data from the German NET Registry. In: Zentralblatt für Chirurgie. Band 139, 2014, S. 276–283.
- D. J. Kwekkeboom: Treatment with the radiolabeled somatostatin analog [177Lu-DOTA 0, Tyr3]octeotate: toxicity, efficacy, and survival. In: J Clin Oncol. Band 26, 2008, S. 2124–2130.
- J. Strosberg, G. El-Haddad, E. Wolin, A. Hendifar, J. Yao, B. Chasen, E. Mittra, P. L. Kunz, M. H. Kulke, H. Jacene, D. Bushnell, T. M. O'Dorisio, R. P. Baum, H. R. Kulkarni, M. Caplin, R. Lebtahi, T. Hobday, E. Delpassand, E. Van Cutsem, A. Benson, R. Srirajaskanthan, M. Pavel, J. Mora, J. Berlin, E. Grande, N. Reed, E. Seregni, K. Öberg, M. Lopera Sierra, P. Santoro, T. Thevenet, J. L. Erion, P. Ruszniewski, D. Kwekkeboom, E. Krenning: Phase 3 trial of 117Lu-Dotatate for midgut neuroendocrine tumors. In: N Engl J Med. Band 376, 2017, S. 125–135.
- T. Brabander, W. A. Van Der Zwan, J. J. M. Teunissen, B. L. R. Kam, E. P. Krenning, D. J. Kwekkeboom, R. A. Feelders, W. W. De Herder, C. H. J. Van Eijck, G. J. H. Franssen: Long-term efficacy, survival, and safety of [177Lu-DOTA A0, Tyr3]octeotate in patients with gastroenteropancreatic and bronchial neuroendocrine tumors. In: Clin Cancer Res. Band 23, 2017, S. 4617–4624.
Weblinks
- European Neuroendocrine Tumor Society
- Deutsches NET-Register
- Netzwerk Neuroendokrine Tumoren (Selbsthilfeorganisation)
Einzelnachweise
- ↑ U.-F. Pape, M. Böhmig u. a.: Diagnostik und Therapie gastroenteropankreatischer neuroendokriner Tumore aus internistischer Sicht. In: Der Onkologe. Band 6, Nummer 7, 2000, S. 105–113, ISSN 0947-8965, doi:10.1007/s007610050036
- ↑ Otto Lubarsch: Ueber den primären Krebs des Ileum nebst Bemerkungen über das gleichzeitige Vorkommen von Krebs und Tuberculose. In: Archiv für pathologische Anatomie und Physiologie und für klinische Medicin. Band 111, Nr. 2, 1. Februar 1888, ISSN 0720-8723, S. 280–317, doi:10.1007/BF01966242 (springer.com [abgerufen am 21. Januar 2018]).
- ↑ S. Oberndorfer: Karzinoide Tumoren des Dünndarms. In: Frankf Z Pathol. Nr. 1, 1907, S. 425–429.
- ↑ Günter Klöppel: Oberndorfer and His Successors: From Carcinoid to Neuroendocrine Carcinoma. In: Endocrine Pathology. Band 18, Nr. 3, 1. September 2007, ISSN 1046-3976, S. 141–144, doi:10.1007/s12022-007-0021-9 (springer.com [abgerufen am 21. Januar 2018]).
- ↑ Tumorzentrum Freiburg:Kodierhilfe des Krebsregisters. ( des vom 9. Oktober 2007 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. 2007, (PDF-Datei)
- ↑ David Binas, A.-K. Schubert, D. Wiese und andere: Perioperatives Management bei Patienten mit Karzinoidsyndrom/Neuroendokriner Neoplasie. In: Anästh Intensivmed. Band 61, 2020, S. 16–24, hier S. 20.
- ↑ I. Buchmann, M. Henze u. a.: Comparison of 68Ga-DOTATOC PET and 111In-DTPAOC (Octreoscan) SPECT in patients with neuroendocrine tumours. In: European journal of nuclear medicine and molecular imaging. Band 34, Nummer 10, Oktober 2007, S. 1617–1626, ISSN 1619-7070. doi:10.1007/s00259-007-0450-1. PMID 17520251.
- ↑ Y. Krausz, N. Freedman u. a.: 68Ga-DOTA-NOC PET/CT imaging of neuroendocrine tumors: comparison with ¹¹¹In-DTPA-octreotide (OctreoScan®). In: Molecular imaging and biology. Band 13, Nummer 3, Juni 2011, S. 583–593, ISSN 1860-2002. doi:10.1007/s11307-010-0374-1. PMID 20652423.
- ↑ a b c M. Pavel, E. Baudin u. a.: ENETS Consensus Guidelines for the management of patients with liver and other distant metastases from neuroendocrine neoplasms of foregut, midgut, hindgut, and unknown primary. In: Neuroendocrinology. Band 95, Nummer 2, 2012, S. 157–176, ISSN 1423-0194. doi:10.1159/000335597. PMID 22262022.
- ↑ Kuno Lehmann: Neuroendokrine Tumoren. In: Swiss Med Forum. Nr. 23, 5. Juni 2019 (medicalforum.ch [abgerufen am 22. März 2022]).
- ↑ Iris D. Nagtegaal, Robert D. Odze, David Klimstra, Valerie Paradis, Massimo Rugge: The 2019 WHO classification of tumours of the digestive system. In: Histopathology. Band 76, Nr. 2, 13. November 2019, ISSN 0309-0167, S. 182–188, doi:10.1111/his.13975, PMID 31433515, PMC 7003895 (freier Volltext) – (wiley.com [abgerufen am 22. März 2022]).
- ↑ Klaire Exarchou, Nathan A. Stephens, Andrew R. Moore, Nathan R. Howes, D. Mark Pritchard: New Developments in Gastric Neuroendocrine Neoplasms. In: Current Oncology Reports. Band 24, Nr. 1, 1. Januar 2022, ISSN 1534-6269, S. 77–88, doi:10.1007/s11912-021-01175-y (springer.com [abgerufen am 22. März 2022]).
- ↑ U. F. Pape, U. Berndt u. a.: Prognostic factors of long-term outcome in gastroenteropancreatic neuroendocrine tumours. In: Endocrine-Related Cancer. Band 15, Nummer 4, Dezember 2008, S. 1083–1097, ISSN 1351-0088. doi:10.1677/ERC-08-0017. PMID 18603570.
- ↑ Anja Rinke, Christoph J. Auernhammer, Lisa Bodei, Mark Kidd, Sebastian Krug: Treatment of advanced gastroenteropancreatic neuroendocrine neoplasia, are we on the way to personalised medicine? In: Gut. 9. März 2021, ISSN 0017-5749, doi:10.1136/gutjnl-2020-321300, PMID 33692095 (bmj.com [abgerufen am 2. Juni 2021]).
- ↑ Neuroendokrine Neoplasien. In: Amboss. Abgerufen am 24. April 2023.
- ↑ Trojaner gegen Krebs – Peptidrezeptor-Radionukleid-Therapie soll helfen. Bei: 3sat.de Sendung nano, vom 4. Februar 2011.
- ↑ Katharina Detjen, Linda Hammerich, Burcin Özdirik, Münevver Demir, Bertram Wiedenmann: Models of Gastroenteropancreatic Neuroendocrine Neoplasms: Current Status and Future Directions. In: Neuroendocrinology. Band 111, Nr. 3, 2021, ISSN 0028-3835, S. 217–236, doi:10.1159/000509864, PMID 32615560 (karger.com [abgerufen am 2. Juni 2021]).
- ↑ Simon L. April-Monn, Philipp Kirchner, Katharina Detjen, Konstantin Bräutigam, Mafalda A. Trippel, Tobias Grob, Cyril Statzer, Renaud S. Maire, Attila Kollàr, Aziz Chouchane, Catarina A. Kunze, David Horst, Martin C. Sadowski, Jörg Schrader, Ilaria Marinoni, Bertram Wiedenmann, Aurel Perren: Patient derived tumoroids of high grade neuroendocrine neoplasms for more personalized therapies. In: npj Precision Oncology. Band 8, Nr. 1, 1. März 2024, ISSN 2397-768X, S. 1–14, doi:10.1038/s41698-024-00549-2, PMID 38429350, PMC 10907580 (freier Volltext) – (nature.com [abgerufen am 6. März 2024]).
- ↑ Simon Leonhard April-Monn, Tabea Wiedmer, Magdalena Skowronska, Renaud Maire, Marco Schiavo Lena: Three-Dimensional Primary Cell Culture: A Novel Preclinical Model for Pancreatic Neuroendocrine Tumors. In: Neuroendocrinology. Band 111, Nr. 3, 2021, ISSN 0028-3835, S. 273–287, doi:10.1159/000507669, PMID 32241015 (karger.com [abgerufen am 2. Juni 2021]).
Auf dieser Seite verwendete Medien
Ga-68-Dotatoc PET/CT Untersuchung eines neuroendokrinen Tumors; im CT alleine können die Metastasen meist nicht erkannt werden.
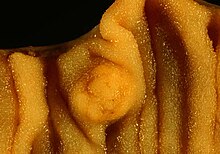
The photo shows the same case presented in Image:Multiple Carcinoid Tumors of the Small Bowel 1.jpg.
The medium close-up photo above shows a segmental small bowel resection en face, the long axis of the bowel oriented horizontally in the frame. One of the carcinoids is present centrally. Note that the tumor effaces the mossy, villous surface of the mucosa only to a mild degree.
The photos were taken with a Nikon FE2 and 50-something mm Nikkor macro lens with Elite ISO 100 daylight film and a blue color compensation filter. For the middle photo, I found that shading some of the illumination on one side helped to bring out the villous texture of the mucosa.
Photograph by Ed Uthman, MD. Public domain. Posted 28 Oct 99
