Neodym
| Eigenschaften | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | ||||||||||||||||
| Name, Symbol, Ordnungszahl | Neodym, Nd, 60 | |||||||||||||||
| Elementkategorie | Lanthanoide | |||||||||||||||
| Gruppe, Periode, Block | La, 6, f | |||||||||||||||
| Aussehen | silbrigweiß, gelblicher Farbton | |||||||||||||||
| CAS-Nummer | ||||||||||||||||
| EG-Nummer | 231-109-3 | |||||||||||||||
| ECHA-InfoCard | 100.028.281 | |||||||||||||||
| Massenanteil an der Erdhülle | 22 ppm (33. Rang)[1] | |||||||||||||||
| Atomar[2] | ||||||||||||||||
| Atommasse | 144,242(3)[3] u | |||||||||||||||
| Atomradius (berechnet) | 185 (206) pm | |||||||||||||||
| Kovalenter Radius | 201 pm | |||||||||||||||
| Elektronenkonfiguration | [Xe] 4f4 6s2 | |||||||||||||||
| 1. Ionisierungsenergie | 5.5250(6) eV[4] ≈ 533.08 kJ/mol[5] | |||||||||||||||
| 2. Ionisierungsenergie | 10.783(20) eV[4] ≈ 1040.4 kJ/mol[5] | |||||||||||||||
| 3. Ionisierungsenergie | 22.09(4) eV[4] ≈ 2130 kJ/mol[5] | |||||||||||||||
| 4. Ionisierungsenergie | 40.60(4) eV[4] ≈ 3920 kJ/mol[5] | |||||||||||||||
| 5. Ionisierungsenergie | 60.0(3) eV[4] ≈ 5790 kJ/mol[5] | |||||||||||||||
| Physikalisch[2] | ||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Kristallstruktur | hexagonal | |||||||||||||||
| Dichte | 7,003 g/cm3 (25 °C)[6] | |||||||||||||||
| Magnetismus | paramagnetisch (χm = 3,6 · 10−3)[7] | |||||||||||||||
| Schmelzpunkt | 1297 K (1024 °C) | |||||||||||||||
| Siedepunkt | 3303 K[8] (3030 °C) | |||||||||||||||
| Molares Volumen | 20,59 · 10−6 m3·mol−1 | |||||||||||||||
| Verdampfungsenthalpie | 289 kJ·mol−1[8] | |||||||||||||||
| Schmelzenthalpie | 7,1 kJ·mol−1 | |||||||||||||||
| Schallgeschwindigkeit | 2330 m·s−1 bei 293,15 K | |||||||||||||||
| Spezifische Wärmekapazität | 190 J·kg−1·K−1 | |||||||||||||||
| Elektrische Leitfähigkeit | 1,56 · 106 S·m−1 | |||||||||||||||
| Wärmeleitfähigkeit | 17 W·m−1·K−1 | |||||||||||||||
| Chemisch[2] | ||||||||||||||||
| Oxidationszustände | +2, +3, +4 | |||||||||||||||
| Normalpotential | −2,32 V (Nd3+ + 3 e− → Nd) | |||||||||||||||
| Elektronegativität | 1,14 (Pauling-Skala) | |||||||||||||||
| Isotope | ||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | ||||||||||||||||
| NMR-Eigenschaften | ||||||||||||||||
| ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Neodym (Nomenklaturempfehlung war zeitweise Neodymium) ist ein chemisches Element mit dem Elementsymbol Nd und der Ordnungszahl 60. Im Periodensystem steht es in der Gruppe der Lanthanoide und zählt damit auch zu den Metallen der Seltenen Erden. Die Elementbezeichnung leitet sich von den griechischen Worten νέος neos ‚neu‘ und δίδυμος didymos ‚Zwilling‘ (als Zwilling von Lanthan) ab. Das Metall wird in Form der Legierung Neodym-Eisen-Bor für starke Permanentmagnete verwendet.
Geschichte

1838 entdeckte Carl Gustav Mosander in Cerit ein neues Element, das er Lanthan nannte. Mosander untersuchte das Lanthan weiter und konnte 1840 amethystfarbenes Lanthansulfat in zwei Fraktionen teilen. Zum einen erhielt er farblose Kristalle, für die er den Namen Lanthan beibehielt, und zum anderen rote Kristalle eines weiteren Elementes. Für dieses wählte er den Namen Didym nach dem griechischen δίδυμος, ‚Zwilling‘.[10] Während er Lanthanoxid in sehr guter Reinheit gewinnen konnte, gelang ihm dies beim Didym nicht. Mosander vermutete, dass Didym ein Doppelsalz mit einem anderen Element, wahrscheinlich Lanthan, bildete, konnte die Bestandteile aber nicht trennen.[11]
Marc Delafontaine verglich 1878 Didym, das aus Samarskit gewonnen wurde mit dem aus Cerit extrahierten. Dabei erkannte er, dass die Absorptionsspektren unterschiedlich waren, dass Didym also eine Mischung mehrerer Elemente sein musste.[12] 1879 konnte Paul Émile Lecoq de Boisbaudran das Samarium aus Didym isolieren.[13][14] Sowohl Per Teodor Cleve als auch Bohuslav Brauner versuchten, das Atomgewicht des Didyms zu bestimmen. Dabei stellten sie fest, dass bei fraktionierter Kristallisation verschiedene Fraktionen unterschiedliche Gewichte von 142 bis 146 aufwiesen, also verschiedene Elemente enthalten sein mussten.[15]
Schließlich gelang es 1885 Carl Auer von Welsbach, Didym durch fraktionierte Kristallisation der Ammonium-Didym-Nitrate (NH4)2Di(NO3)5 · 4H2O in zwei verschiedene Salze zu trennen. Eines der Elemente zeigte sowohl in Lösung als auch in verschiedenen Salzen eine grüne Farbe, während das andere eine rosafarbene Lösung und amethystfarbene Kristalle bildete. Ein weiterer, von Auer von Welsbach gefundener Unterschied war es, dass das „grüne Element“ ein zweites, schwarzbraunes, leicht zum grünen Sesquioxid reduzierbares Oxid bildete, was das zweite Element nicht machte. Er nannte das erste Element auf Grund der typischen Farbe nach dem griechischen πράσινος prásinos, ‚grün‘ Praseodym (der „grüne Zwilling“), das zweite nach dem griechischen νεοσ neos ‚neu‘ Neodym (der „neue Zwilling“).[16][17]
Die Darstellung metallischen Neodyms gelang 1903 Wilhelm Muthmann durch Elektrolyse geschmolzenem Neodym(III)-chlorids. Für das Metall konnte er ein spezifisches Gewicht von 6,9563 und eine Schmelzpunkt von 840 °C bestimmen.[18]
Erstmals verwendet wurde Neodym 1927, als die Auergesellschaft zum 70. Geburtstag von Carl Auer von Welsbach zwei Glasvasen herstellte, die mit Praseodym und Neodym grün beziehungsweise violett gefärbt waren.[19] Ab 1929 stellte Moser unter dem Markennamen Alexandrit auch kommerziell Vasen her, die mit Neodym gefärbt waren. Dieser Name wurde gewählt, weil neodymhaltiges Glas ähnlich wie Alexandrit einen Farbwechsel zeigt.[20][21]
Vorkommen
Neodym kommt in der Natur nicht elementar vor, sondern nur in chemischen Verbindungen. Meist ist es in Mineralien vergesellschaftet mit anderen Lanthanoiden, als Beispiele:
Der wichtigste Lieferant mit 91 % der Weltproduktion ist China.[22][23] Das führt dort zu erheblichen Umweltproblemen. „Bei der Trennung des Neodyms vom geförderten Gestein entstehen giftige Abfallprodukte, außerdem wird radioaktives Uran und Thorium beim Abbauprozess freigesetzt. Diese Stoffe gelangen zumindest teilweise in das Grundwasser, kontaminieren so Fauna und Flora erheblich und werden für den Menschen als gesundheitsschädlich eingestuft“.[24] Weitere wirtschaftlich verwertbare Vorkommen finden sich in Australien, hier vor allem im Northern Territory, das von Arafura Resources ausgebeutet wird.
Gewinnung und Herstellung
Wie bei allen Lanthanoiden werden zuerst die Erze durch Flotation angereichert, danach die Metalle in ihre Halogenide umgewandelt und durch fraktionierte Kristallisation, Ionenaustausch oder Extraktion getrennt. Im Fall von Neodym erfordert die Herstellung jedoch besonders komplexe Extraktions- und Reinigungstechniken. Es wird typischerweise aus Mineralien wie Basalt und Fluorkarbonaten gewonnen. Zunächst werden die Mineralien chemisch behandelt und anschließend durch Lösungsmittel-Extraktion getrennt, wobei Neodym von anderen Seltenerdelementen separiert wird. Danach erfolgt eine weitere Verfeinerung mittels Fällung und Ionenaustausch. Schließlich wird durch ein Reduktionsverfahren metallisches Neodym gewonnen.[25]
Nach einer aufwendigen Abtrennung der Neodymbegleiter kann das Oxid mit Fluorwasserstoff zu Neodym(III)-fluorid umgesetzt und anschließend mit Calcium unter Bildung von Calciumfluorid zu Neodym reduziert werden. Calciumreste und Verunreinigungen trennt man durch Umschmelzen im Vakuum ab.
Dieses Verfahren wurde in China um 1984 durch Schmelzflusselektrolyse eines Gemisches aus Neodymfluorid, Neodymoxid und Lithiumfluorid abgelöst. Formal entspricht dieses Verfahren dem Hall-Héroult-Prozess, das elementare Neodym wird jedoch an einer senkrecht stehenden Wolfram-Kathode abgeschieden, welche von einer ringförmigen Graphit-Anode umgeben ist. Das schmelzflüssige Neodym wird in einer Molybdänwanne aufgefangen, aus der es manuell in eine Barrengussform gegossen wird. Jede solche Elektrolyse-Zelle wird als Einkammer-Elektrolysezelle betrieben. Über den tatsächlichen Betrieb der Zellen in den chinesischen Betrieben sind keine überprüfbaren Angaben bekannt.
Die chinesische Regierung hat angekündigt, schärfere Umweltauflagen einzuführen und stärker gegen illegale Minen vorzugehen. Anfang Juni 2011 scheint es zu einer ersten Umsetzung dieser Absicht gekommen zu sein. Laut Berichten der Financial Times erhält der staatseigene Produzent (Baotou Steel Rare Earth) das Monopol für den Abbau und die Aufbereitung der Seltenen Erden. 35 lizenzierte Betriebe werden geschlossen und entschädigt, neun weitere nicht lizenzierte Betriebe sollen geschlossen und nicht entschädigt werden.[26] In den USA wird derzeit (Stand: 2014) das Bergwerk Mountain Pass in Kalifornien und in Australien das Bergwerk Mount Weld reaktiviert. Beiden Minen werden vom Öko-Institut e. V. akzeptable Umweltschutzsysteme bescheinigt. Allerdings gibt es auch Vorhaben zum kombinierten Abbau Seltener Erden in Grönland, bei denen die giftigen Rückstände in Seen verklappt werden sollen.[27]
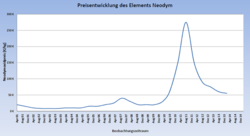
Die Jahresproduktion wurde 2012 auf 21.000 t geschätzt, davon kommen 91 % aus China.[23] Laut USGS lag der Preis für 1 kg Neodym 2001 unter 10 USD.[28] Der Preis stieg bis 2010 auf 80 USD und erreichte 2011 den Höchststand mit 244 USD je kg. Danach ging er wieder zurück und lag 2013 bei 65 USD je kg.[29] Im März 2022 stieg der Preis auf 380 bis 390 US-Dollar/kg. Seit August liegt der Preis bei etwas über 200 US-Dollar/kg.[30]
Rein theoretisch kann Neodym recycelt werden, allerdings findet diese Anwendung auf dem kommerziellen Markt bisher wenig bis keine Anwendung, auch wenn Länder ohne Monopolstellung sich unabhängiger machen können. Ein solches Recycling, aus Elektroschrott etwa, fällt unter das Urban Mining.
Im Labor ist eine Reindarstellung des Metalls als Pulver möglich.
- Möglicher Weg, um Neodym aus Neodym-Eisen-Bor-Magnete darzustellen/zu isolieren …
- … und das hier entstandene Produkt – Neodym-Metall-Pulver
- Preisentwicklung Neodym-Oxid (Quelle: Sachwerte Einkaufsgemeinschaft, Stand 10. März 2014)
Eigenschaften

Physikalische Eigenschaften

Das silbrigweiß glänzende Metall gehört zu den Lanthanoiden und Metallen der Seltenen Erden. Es ist an der Luft etwas korrosionsbeständiger als Europium, Lanthan, Cer oder Praseodym, bildet aber leicht eine rosaviolette Oxidschicht aus, welche an der Luft abblättern kann.
Chemische Eigenschaften
Bei hohen Temperaturen verbrennt Neodym zum Sesquioxid Nd2O3. Mit Wasser reagiert es unter Bildung von Wasserstoff zum Neodymhydroxid Nd(OH)3. Mit Wasserstoff setzt es sich zum Hydrid NdH2 um. Neben der Hauptwertigkeit/Oxidationszahl +3 kommen unter besonderen Bedingungen auch die Oxidationszahlen +2 und +4 vor.
Isotope
Es gibt fünf stabile Neodymisotope: Nd‑142, ‑143, ‑145, ‑146 und ‑148. Das Isotop 144Nd ist der leichteste Alphastrahler (abgesehen von einigen Kernen mit extremem Protonenüberschuss) und zerfällt mit der extrem langen Halbwertszeit von 2.29e15 Jahren zu 140Ce, einem Nuklid mit der „magischen“ Neutronenzahl 82. Noch größer ist mit 1.1e19 Jahren die Halbwertszeit von 150Nd, das durch doppelten Betazerfall zu 150Sm wird.
Verwendung
- Neodym-Eisen-Borverbindungen zur Herstellung stärkster Magnete. Sie werden genutzt für Kernspintomographen, Mikromotoren und Festplatten (Positionierung der Schreib-/Leseköpfe), Dauermagnet-Rotoren (z. B. Schritt- und Servomotoren), effiziente permanenterregte Synchronmaschinen z. B. in einigen Windkraftanlagentypen[31] (rund einem Sechstel[27]), zum Antrieb von Elektro- und Hybridfahrzeugen sowie als Modellbau-Antriebe, Linearmotoren für Positionierachsen (z. B. CNC-Maschinen), hochwertige Lautsprecher und Kopfhörer. Gegenüber den Samarium-Cobalt-Magneten sind sie stärker und wesentlich preiswerter, aber auch wesentlich empfindlicher gegen Hitze. Für heutige Windenergieanlagen mit permanenterregten Generatoren wird ein mittlerer spezifischer Bedarf von Neodym in Höhe von 201,5 kg/MW bei Anlagen mit Direktantrieb (getriebelos), 49,6 kg/MW bei Anlagen mit Getrieben mittlerer Geschwindigkeit und 24,8 kg/MW bei Anlagen mit Getrieben hoher Geschwindigkeit ermittelt.[32]
- Neodymsalze zum Färben von Emaille
- Blaue Porzellanfarbe
- Neodym(III)-oxid zur Glasfärbung. Es erzeugt sehr warme violette bis weinrote und graue Töne. Solche Gläser besitzen scharfe Absorptionsbanden und werden in der Astronomie zum Kalibrieren benutzt.
- Entfärben von eisenhaltigem Glas
- UV-absorbierende Gläser (Sonnenschutzglas)
- Bestandteil des industriell weitverbreiteten Neodym-YAG-Lasers
- Neodymoxiddotiertes Bariumtitanat für Kondensator-Dielektrika
- Wegen seiner pyrophoren Eigenschaften als Legierungspartner mit Cer in Feuersteinen
- Zur Herstellung von Neodym-katalysiertem Polybutadienkautschuk (Nd-PBR)
- Neodym hat bei Temperaturen von flüssigem Helium eine ungewöhnlich hohe spezifische Wärmekapazität, weshalb es in kryogenen Kühlern nützlich ist.[33][34]
- Seit Jahren werden auf dem Markt Decken, Matten und andere Produkte mit Neodym verkauft, die aufgrund ihrer starken magnetischen Wirkung angeblich heilende Eigenschaften bei vielen Beschwerden haben. Allerdings hat diese Form der Magnettherapie keine wissenschaftliche Grundlage. In manchen Fällen kann ihre Anwendung sogar schädlich sein.[35]
Verbindungen
Oxide
- Neodym(III)-oxid (Nd2O3)
Halogenide
- Neodym(II)-fluorid (NdF2)
- Neodym(II)-chlorid (NdCl2)
- Neodym(II)-bromid (NdBr2), nur wasserfrei
- Neodym(II)-iodid, (NdI2)
- Neodym(II,III)-bromid (Nd4Br9), nur wasserfrei
- Neodym(III)-fluorid (NdF3)
- Neodym(III)-chlorid (NdCl3), wasserfrei
- Neodym(III)-bromid (NdBr3), wasserfrei, zwei Modifikationen
- Neodym(III)-iodid (NdI3), wasserfrei
Andere Verbindungen
- Neodym(III)-acetat (Nd(C2H3O2)3)
- Neodymcarbid (NdC2)
- Neodym(III)-nitrat (Nd(NO3)3 · 6 H2O)
- Neodym(III)-sulfat (Nd2(SO4)3 · 8 H2O)
- Neodym(III)-sulfid (Nd2S3)
- Neodym(III)-sulfat-Oktahydrat
- Neodym(III)-chlorid
- Neodym(III)-sulfat, -nitrat und -chlorid in Lösung
Sonstige Stoffe
Neodym-Eisen-Bor (Nd2Fe14B) ist der Werkstoff, aus dem derzeit die stärksten Dauermagnete hergestellt werden können. Sie erreichen eine Remanenzflussdichte von bis zu 1,4 Tesla. Die Koerzitivfeldstärke HcJ schwankt im Bereich von 870 bis 2750 kA/m.
Weblinks
- Eintrag zu Neodym. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Januar 2015.
- metallisch blankes Neodym
Einzelnachweise
- ↑ Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Neodym) entnommen.
- ↑ CIAAW, Standard Atomic Weights Revised 2013.
- ↑ a b c d e Eintrag zu neodymium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: National Institute of Standards and Technology, Gaithersburg, MD. doi:10.18434/T4W30F (physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- ↑ a b c d e Eintrag zu neodymium bei WebElements, www.webelements.com, abgerufen am 11. Juni 2020.
- ↑ N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 1579.
- ↑ Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑ a b Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337; doi:10.1021/je1011086.
- ↑ a b Eintrag zu Neodym, Pulver in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2025. (JavaScript erforderlich)
- ↑ Carl Gustav Mosander: Ueber die das Cerium begleitenden neuen Metalle Lanthanium und Didymium, sowie über die mit der Yttererde vorkommenden neuen Metalle Erbium und Terbium. In: Annalen der Physik und Chemie. Band 60, 1843, S. 297–315 (online auf Wikisource).
- ↑ Levy Tansjö: Carl Gustav Mosander and his research of rare earths. In: C.H. Evans (Hrsg.): Episodes from the History of the Rare Earth Elements. Band 15, Kluwer Academic Publishers 1996, ISBN 978-94-009-0287-9, S. 42–49.
- ↑ M. Delafontaine: La didyme de la cérite est probablement un mélange de plusiers corps. In: Comptes Rendus. Band 78, 1878, S. 634–635 (Digitalisat auf Gallica).
- ↑ Paul Émile Lecoq de Boisbaudran: Recherches sur le samarium, radical d’une terre nouvelle extraite de la samarskite. In: Comptes Rendus. Band 89, 1879, S. 212–214 (Digitalisat auf Gallica).
- ↑ F. Szabadvary, C. Evans: The 50 Years following Mosander. In: C.H. Evans (Hrsg.): Episodes from the History of the Rare Earth Elements. Band 15, Kluwer Academic Publishers 1996, ISBN 978-94-009-0287-9, S. 59–60.
- ↑ Roland Adunka, Mary Virginia Orna: Carl Auer von Welsbach: Chemist, Inventor, Entrepreneur. Springer, 2018, ISBN 978-3-319-77904-1, S. 37–39.
- ↑ Carl Auer v. Welsbach: Die Zerlegung des Didyms in seine Elemente. In: Monatshefte für Chemie. 6 (1), 1885, S. 477–491; doi:10.1007/BF01554643.
- ↑ Gerd Meyer: Die (ungleichen) Didymium-Zwillinge: Praseodym und Neodym. In: Chemie in unserer Zeit. 2001, Band 35, Nummer 2, S. 116–123, doi:10.1002/1521-3781(200104)35:2<116::AID-CIUZ116>3.0.CO;2-5.
- ↑ W. Muthmann, L. Weiss: I. Untersuchungen über die Metalle der Cergruppe. In: Justus Liebig s Annalen der Chemie. 1904, Band 331, Nummer 1, S. 1–46 doi:10.1002/jlac.19043310102.
- ↑ Roland Adunka, Mary Virginia Orna: Carl Auer von Welsbach: Chemist, Inventor, Entrepreneur. Springer, 2018, ISBN 978-3-319-77904-1, S. 37–39.
- ↑ Jan Mergl, Lenka Merglová Pánková: Moser 1857-2017. 1. Auflage, Moser, ISBN 978-80-270-1135-3, S. 123 (online).
- ↑ Alexandrit Glass. In: Charles Bray: Dictionary of Glass: Materials and Techniques. University of Pennsylvania Press, 2001, ISBN 978-081-2-23619-4, S. 22.
- ↑ Justin Rowlatt: Neither rare, nor earths. 23. März 2014 (bbc.com [abgerufen am 8. Juni 2019]).
- ↑ a b Neodymium. setis.ec.europa.eu, archiviert vom (nicht mehr online verfügbar) am 5. März 2016; abgerufen am 26. August 2015 (englisch).
- ↑ Das schmutzige Geheimnis sauberer Windräder. In: Panorama. 28. April 2011.
- ↑ Neodym: Element-Eigenschaften und Verwendungen. Abgerufen am 13. Juni 2025 (englisch).
- ↑ Michelle Röttger: China säubert den Markt für Seltene Erden. (Studie) In: Financial Times. 9. Juni 2011, S. 2, archiviert vom am 11. Juni 2011; abgerufen am 26. Juni 2011.
- ↑ a b Mandy Schoßig: Seltene Erden – Daten & Fakten. Öko-Institut e. V., Berlin, Januar 2011.
- ↑ Scientific Investigations Report 2012–5188 - Metal Prices in the United States Through 2010. (PDF 2,4 MB, S. 143 (137) Figure 6.) USGS, abgerufen am 26. August 2015 (englisch).
- ↑ Congressional Research Service - Rare Earth Elements: The Global Supply Chain. (PDF 603 kB, S. 11 (7) Figure 3) www.fas.org, 16. Dezember 2013, abgerufen am 26. August 2015 (englisch).
- ↑ Tagesaktueller Neodym-Preis, auf neodym-preis.de, abgerufen am 26. September 2023
- ↑ Ca. 2 t Neodymium werden für jede Windturbine benötigt: "Around two tonnes of neodymium are needed for each wind turbine".
- ↑ Antwort auf die mündliche Anfrage: Neodym in Windrädern | Nds. Ministerium für Umwelt, Energie und Klimaschutz. Abgerufen am 14. September 2023.
- ↑ M. G. Osborne, I. E. Anderson, K. A. Gschneidner, M. J. Gailloux, T. W. Ellis: Centrifugal Atomization of Neodymium and Er3Ni Regenerator Particulate. In: Advances in Cryogenic Engineering Materials: Volume 40, Part A. Springer US, Boston, MA 1994, ISBN 978-1-4757-9053-5, S. 631–638, doi:10.1007/978-1-4757-9053-5_80.
- ↑ Neodymium: Properties and Applications. Abgerufen am 13. Juni 2025 (englisch).
- ↑ J. A. MARRAHÍ: El engaño de la magnetoterapia. 1. Juni 2012, abgerufen am 13. Juni 2025 (spanisch).
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Hexagonale dichteste Kugelpackung, schematisch gezeichnet
Autor/Urheber: Bahmtec, Lizenz: CC BY-SA 3.0
Kristalle von Neodym(III)-sulfat-Octahydrat
Karl Auer von Welsbach (1858-1929)
Autor/Urheber: W. Oelen, Lizenz: CC BY-SA 3.0
Neodymium sulfate, nitrate, and chloride solutions in normal sunlight
Autor/Urheber: FlorianRost, Lizenz: CC BY-SA 4.0
Synthesizing/recyling of the element neodymium from neodymium-magnets
Autor/Urheber: Twitchykraut, Lizenz: CC BY-SA 4.0
Preisentwicklung Neodymoxid
Neodymium chloride hexahydrate (fume cupboard light)
Autor/Urheber: Der ursprünglich hochladende Benutzer war Tomihahndorf in der Wikipedia auf Deutsch, Lizenz: CC BY-SA 3.0
neodymium
- Bildbeschreibung: Neodym unter Argongas
- Quelle: Foto aus meiner Elementesammlung
- Fotograf: Tomihahndorf
- Datum: März 2006