Nematophage Pilze
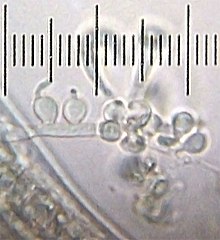
Nematophage Pilze sind eine Sondergruppe karnivorer Pilze, die auf Fadenwürmer als Beute spezialisiert sind. Es sind etwa 160 Arten bekannt.
Abgrenzung und Fangorgane
Dabei wird unterschieden zwischen Raubpilzen sowie endoparasitären Nematophagen. Räuberische und endoparasitäre Pilze teilen einige Merkmale miteinander, die eine taxonomische Abgrenzung voneinander erschweren und gelegentlich sogar unmöglich machen (bei der Gattung Nematoctonus zum Beispiel, in der sich beide Lebensweisen finden).
Als räuberisch werden in der Literatur einhellig ausschließlich jene Arten verstanden, die spezielle Fangorgane an externen Hyphen aufweisen. Diese Fangorgane sind in rund 80 % aller Fälle Klebefallen (z. B. bei Zoophagus insidans), an deren Klebfäden sich gelegentlich auch Rädertierchen verfangen können und zu 20 % Fangringe, z. B. bei der Art Zoophagus tentaclum. Hier bilden sich aus Hyphen kleine Schlingen, in denen sich z. B. Fadenwürmer verfangen können. Die Schlingfallen können kontraktil sein, durch Berührungsreize zieht sich die Schlinge zu und verhindert ein Entkommen der Beute. Sie lassen sich noch feiner unterscheiden:
- Klebefallen
- Einfache klebrige Fanghyphen
- Klebrige Fanghyphenfortsätze
- Klebrige Fangnetze
- Klebrige Fangknoten
- Fangringe
- Kontraktile Fangringe
- Nichtkontraktile Fangringe
Selten verfügen Arten auch über gleich zwei verschiedene Fallentypen, so z. B. Dactylaria candida oder Arthrobotrys botryospora.
Die Methode des Fangs durch Fangringe ist evolutionär recht alt, wie der Fund eines – mit den heutigen Arten nicht näher verwandten – 100 Millionen Jahre alten nematophagen Pilzes in einem Bernsteinstück deutlich machte.[1]
Raubpilze (Prädatoren)
Raubpilze sind aktiv Fadenwürmer fangende Pilze mit speziellen Fangvorrichtungen, entweder Klebefallen, an denen die Beute haften bleibt, oder Ringfallen, in denen die Nematoden beim Durchkriechen hängen bleiben. Nach dem Fang wächst der Pilz in den Nematoden hinein und zersetzt ihn allmählich durch Enzyme von innen heraus; die freigesetzten Nährstoffe werden absorbiert.
Durch das häufige Vorkommen in stickstoffarmen Böden ist es wahrscheinlich, dass wie auch bei den meisten fleischfressenden Pflanzen die Beute weniger zur Gewinnung von Stoffwechselenergie, sondern mehr zum Ausgleich des Stickstoffhaushalts gefangen wird.
Auch Ständerpilze wie der Schopftintling (Coprinus comatus) oder der Austern-Seitling (Pleurotus ostreatus) können Nematoden fangen und verdauen. Sie bilden kleine kugelige Strukturen mit dornigen Auswüchsen. Durch diese scheiden sie ein Toxin aus, welches Nematoden unbeweglich macht. Die Nematoden werden schließlich vom Myzel besiedelt und innerhalb weniger Tage verdaut.[2][3][4]
Endoparasitäre Nematophagen
Endoparasitäre Nematophagen fangen Nematoden nicht, sondern wachsen vom Sporenstadium an in der Nematode heran und verdauen diese allmählich von innen her. Infiziert werden die Nematoden durch die orale Aufnahme der Sporen oder durch Sporen, die sich außen an die Nematoden anheften und später in den Wurm einwachsen. Eine weitere Infektionsweise findet sich bei der Gattung Haptoglossa: dieser obligate Parasit hat Sporen, deren Plasmainhalt bei Kontakt mit einem Nematoden in den zukünftigen Wirt geschossen wird. Nachdem die Sporen keimen, bilden sie ein Hyphengeflecht im Nematoden, welches später die Cuticula durchbricht und Konidien als neue Sporenträger bildet. In den zersetzten Nematoden können sich außerdem Dauersporen bilden.
Systematik
Die Mehrheit aller in diesem Sinne räuberisch lebenden Pilze gehört zur Ordnung der Moniliales in der Klasse der Deuteromycetes, einige wenige finden sich allerdings auch in der Familie der Zoopagaceae (Zygomycetes) und bei den Ständerpilzen (Basidiomycetes).
Einsatz im Pflanzenschutz
Aufgrund ihrer Effektivität sollen nematophage Pilze auch im Pflanzenschutz gegen pflanzenpathogene Nematoden eingesetzt werden, die Anwendungen befinden sich allerdings noch in der Erprobung (z. B. Paecilomyces).
Nachweise
- Asmus Dowe: Räuberische Pilze und andere pilzliche Nematodenfeinde, A. Ziemsen Verlag, Wittenberg, 1987, ISBN 3740300426
Einzelnachweise
- ↑ Alexander R. Schmidt, Heinrich Dörfelt & Vincent Perrichot: Carnivorous fungi from Cretaceous amber. In: Science, Band 318, Nr. 5857, S. 1743, 14. Dezember 2007 doi:10.1126/science.1149947.
- ↑ Luo, Hong; Mo, Minghe; Huang, Xiaowei; Li, Xuan; Zhang, Keqin: Coprinus comatus: A basidiomycete fungus forms novel spiny structures and infects nematode, in: Mycologia, 2004, Vol. 96, Ss. 1218–1224, PDF Online.
- ↑ Binh-Nguyen Truong, Koei Okazaki, Toshimitsu Fukiharu, Yuko Takeuchi, Kazuyoshi Futai, Xuan-Tham Le, Akira Suzuki: Characterization of the nematocidal toxocyst in Pleurotus subgen. Coremiopleurotus. In: Mycoscience, Band 48, Nr. 4, 2007, S. 222–230, (PDF).
- ↑ R. G. Thorn, G. L. Barron: Carnivorous Mushrooms. In: Science. Band 224, Nr. 4644, 6. April 1984, ISSN 0036-8075, S. 76–78, doi:10.1126/science.224.4644.76 (science.org [abgerufen am 15. Oktober 2022]).
Weiterführende Literatur
- Barron, G. L. (1977): The Nematode-Destroying Fungi. Topics in Mycobiology No. 1; Canadian Biological Publications; Guelph, Ont./Ca
- Dürschner, Ulrike (1983): Pilzliche Endoparasiten an beweglichen Nematodenstadien. Mitteilungen aus der Biologischen Bundesanstalt für Land- und Forstwirtschaft; Heft 217
Weblinks
- Ausführliche Website über Nematophage Pilze
- PDF bei www.bba.de (4,67 MB)
- Video: Nematophage Pilze. Institut für den Wissenschaftlichen Film (IWF) 1995, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.3203/IWF/C-1851.
Auf dieser Seite verwendete Medien
Autor/Urheber: Bob Blaylock, Lizenz: CC BY-SA 3.0
A dead nematode with fungus growing out of it. I sent this image to an apparent expert on nematophagous fungi, and he identified it as Harposporium anguillulae. See this page on the Nematophagous Fungi Guide. This image was taken using my 60× objective and 15× eyepiece. The numbered ticks on the scale are 20 microns apart. The scale of the full-sized version of this image is such that each pixel represents an area that is a 0.0464-micron square.
