Natriumthiosulfat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Natriumthiosulfat | ||||||||||||||||||
| Andere Namen | Natriumhyposulfit (veraltet) | ||||||||||||||||||
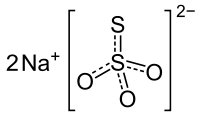
| Summenformel | Na2S2O3 | ||||||||||||||||||
| Kurzbeschreibung | farb- und geruchlose, salzig-bitter schmeckende Kristalle[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | V03AB06 | ||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | |||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | Zersetzung ab 300 °C[4] | ||||||||||||||||||
| Löslichkeit | gut in Wasser (701 g·l−1 bei 20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Natriumthiosulfat (Na2S2O3) ist das stabile Natriumsalz der in freiem Zustand instabilen Thioschwefelsäure.
Gewinnung und Darstellung
Natriumthiosulfat wird durch Erhitzen von fein verteiltem Schwefel in einer Natriumsulfitlösung unter Druck hergestellt:[2]
Alternativ kann das Natriumsulfit auch mit Natriumdisulfid umgesetzt[2]
oder durch Oxidation von Sulfiden und Polysulfiden synthetisiert werden.
Durch die Reaktion von schwefliger Säure mit Natronlauge, Schwefelwasserstoff und Schwefeldioxid entsteht ebenfalls Natriumthiosulfat:[5]
Eigenschaften

Natriumthiosulfat bildet unter Normalbedingungen mit fünf Äquivalenten Kristallwasser farblose Natriumthiosulfat-Pentahydrat-Kristalle (Na2S2O3·5H2O), welche gut wasserlöslich sind. Beim Lösungsvorgang kühlt sich die Flüssigkeit stark ab, da die Hydratationsenthalpie kleiner ist als die Gitterenergie und die fehlende Wärmemenge dem System entzogen wird.
Die Pentahydrat-Kristalle haben einen Schmelzpunkt von 48,5 °C, die Schmelze kann wie bei Natriumacetat unterkühlt werden, und gibt beim Erstarren eine große Menge von Kristallisationsenthalpie ab.
Wasserfreies Natriumthiosulfat tritt in vier polymorphen Kristallformen auf.[3] Die bei Raumtemperatur stabile α–Form kristalliert in einem monoklinen Kristallgitter. Bei 330 °C wandelt sie sich in die trikline β–Form um. Diese bildet beim weiteren Erhitzen bei 388 °C eine kubische γ–Form. Alle Phasenübergänge sind reversibel und die Formen stehen enantiotrop zueinander. Eine metastabile orthorhombische α'–Form kann durch die Dehydratisierung des Pentahydrats oder Abkühlung der β–Form erhalten werden. Diese wandelt sich um 155 °C exotherm in die α–Form um und steht somit monotrop zu dieser. Die γ–Form zersetzt sich ab 444 °C in einer exothermen Reaktion zu Natriumsulfat und Natriumpentasulfid.[3]
Wird zur wässrigen Natriumthiosulfat-Lösung Säure hinzugefügt, so scheidet sich nach kurzer Zeit Schwefel in Form einer gelblichen Trübung aus. Die freigesetzte, instabile Thioschwefelsäure (H2S2O3) zerfällt nämlich rasch zu Schwefel und Schwefeldioxid:
Natriumthiosulfat ist ein Reduktionsmittel und reagiert daher leicht mit dem Oxidationsmittel Kaliumpermanganat.
Verwendung
Technisch
Natriumthiosulfat dient in der Analogfotografie als Fixiersalz. Die wasserunlöslichen Silberhalogenide (AgCl, AgBr) werden durch eine Fixiersalzlösung aufgelöst. Durch die Bildung des wasserlöslichen Natriumdithiosulfatoargentat(I)-Komplexes wird der entwickelte Film lichtunempfindlich:
Im Bergbau dient dieselbe Reaktion zur Extraktion von Silberchlorid aus Silbererzen. In der Galvanotechnik wird Natriumthiosulfat zur Herstellung von Gold- und Silberbädern verwendet.
Natriumthiosulfat dient als Antichlor zum Beenden von Bleich- oder Desinfektionsprozessen mit Chlor. Dabei wird das Chlor zu Chlorid (bzw. Salzsäure) reduziert, und es entsteht Hydrogensulfat:[6]
Im Chemielabor muss bei der Handhabung von Brom ausreichend Thiosulfatlösung bereitgehalten werden, um eventuelle Kontaminationen zu beseitigen.[7] Die Reaktion verläuft analog zum Chlor.
In der Analytischen Chemie wird es in der Iodometrie z. B. zur Bestimmung der Iodzahl verwendet. Dabei wird Thiosulfat zu Tetrathionat oxidiert:[6][8]
- .
Natriumthiosulfat-Pentahydrat wird in sogenannten Wärmekissen eingesetzt. Durch das Biegen eines Metallplättchens entsteht ein Kristallisationskeim, der die exotherme Kristallisation auslöst. Die Regeneration des Kissens erfolgt durch Erwärmen in kochendem Wasser, wobei die Kristalle wieder geschmolzen (gelöst) werden.
Medizinisch
Eine Verwendung von Natriumthiosulfat in der Medizin ist die Therapie von Cyanidvergiftungen. Dazu wird das Natriumthiosulfat intravenös injiziert.[9] Aus dem Cyanid wird weniger gefährliches Thiocyanat gebildet.
Natriumthiosulfat ist Hauptbestandteil und Wirkstoff des Fertigarzneimittels Pedmarqsi. Es ist das bislang einzige zugelassene Arzneimittel für die Prävention eines durch eine cisplatinhaltige Chemotherapie verursachten Hörverlusts bei Kindern und Jugendlichen im Alter von 1 Monat bis einschließlich 17 Jahren mit lokalisierten, nicht metastasierten, soliden Tumoren. Zulassungsstudien zufolge reduziert die Anwendung von Natriumthiosulfat das Risiko einer durch Cisplatin verursachten Ototoxizität um fast 50 %.[10][11] In Großbritannien empfahl das National Institute for Health and Care Excellence (NICE) im Januar 2025 die Anwendung im Rahmen der geltenden Zulassung, unter Verweis auf den ungedeckten medizinischen Bedarf und die sozialen Folgen eines frühen Hörverlusts.[12]
Sonstiges
Die Reaktion von Salzsäure mit Natriumthiosulfat wird als Schulversuch zur Bestimmung der Abhängigkeit der Reaktionsgeschwindigkeit von der Temperatur verwendet.[13]
Einzelnachweise
- ↑ Eintrag zu SODIUM THIOSULFATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- ↑ a b c d e Eintrag zu Natriumthiosulfat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. März 2021.
- ↑ a b c d e f Heike von Benda, Klaus von Benda: Zur Polymorphie des Na2S2O3 in Z. Naturforsch. 34B (1979) 957–968, pdf.
- ↑ a b c d Eintrag zu Natriumthiosulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Dezember 2019. (JavaScript erforderlich)
- ↑ Wolfram Felber, Claus Räthe: Laborpraxis für Chemieberufe. 1. Auflage. VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1987, ISBN 3-342-00163-1, S. 317 f.
- ↑ a b A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 594.
- ↑ Eintrag zu Brom in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. Februar 2024. (JavaScript erforderlich)
- ↑ A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 670 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Natriumthiosulfat. In: Fachinformation. Dr. Franz Köhler Chemie, Alsbach 2006.
- ↑ Penelope R. Brock, Rudolf Maibach, Margaret Childs, Kaukab Rajput, Derek Roebuck: Sodium Thiosulfate for Protection from Cisplatin-Induced Hearing Loss. In: New England Journal of Medicine. Band 378, Nr. 25, 21. Juni 2018, S. 2376–2385, doi:10.1056/nejmoa1801109.
- ↑ Zusammenfassung der Merkmale des Arzneimittels Pedmarqsi, abgerufen am 21. Februar 2025
- ↑ Cost-effectiveness estimates, Website des NICE (englisch), abgerufen am 21. Februar 2025.
- ↑ Die Abhängigkeit der Reaktionsgeschwindigkeit von der Temperatur. (PDF) Die Reaktion von Salzsäure mit Natriumthiosulfat bei verschiedenen Temperaturen. In: Untrerichtsmaterialien Chemie. Abgerufen am 13. Mai 2024.
Auf dieser Seite verwendete Medien
Sodium thiosulfate, structural formula

