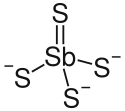
Natriumthioantimonat(V)
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Natriumthioantimonat(V) | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | Na3SbS4·9 H2O | |||||||||||||||
| Kurzbeschreibung | hellgelbe Kristalle mit unangenehmem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 481,10 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | 1,86 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | 87 °C[1] | |||||||||||||||
| Siedepunkt | 234 °C (Zersetzung)[1] | |||||||||||||||
| Löslichkeit | mäßig in Wasser (330 g·l−1 bei 20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Natriumthioantimonat(V) (auch Schlippe'sches Salz nach dem Chemiker Johann Karl Friedrich von Schlippe[2], von diesem ursprünglich als Schwefelspießglanznatron bezeichnet) ist das Natriumsalz der Thioantimon(V)-säure und tritt kristallwasserhaltig als Nonahydrat mit der Summenformel Na3SbS4· 9 H2O auf.
Gewinnung und Darstellung
Natriumthioantimonat(V)-Nonahydrat wird bei Erhitzung einer wässrigen Suspension von Stibnit mit Natronlauge und Schwefel gebildet. Hierbei wird die Antimon(III)-Verbindung des Stibnits zu einer Antimon(V)-Verbindung oxidiert und der Schwefel zu Sulfid reduziert.[3] Nach Abkühlung der Lösung kristallisiert das hellgelbe Schlippe'sche Salz aus. Die Gleichung für diese Reaktion lautet:
Eine alternative Darstellungsmethode geht von in Salzsäure gelöstem Antimon(III)-chlorid SbCl3 oder Antimon(III)-oxid Sb2O3 aus, in das Schwefelwasserstoffgas eingeleitet wird.[4]
Eigenschaften
Natriumthioantimonat(V) liegt in Form von licht- und luftempfindlichen, hellgelben Kristallen mit unangenehmem Geruch vor. In Wasser ist es sehr leicht löslich, wobei seine wässrige Lösung stark alkalisch reagiert.[1] Mit Säuren erhält man daraus das als Pigment Goldschwefel verwendete Antimon(V)-sulfid, Sb2S5.
Verwendung
Natriumthioantimonat(V) wird zur Herstellung von Antimon(V)-sulfid (auch Goldschwefel genannt) verwendet und wurde früher bei der Vulkanisierung von Kautschuk verwendet.
Einzelnachweise
- ↑ a b c d e f g h Datenblatt Natriumthioantimonat(V)-Nonahydrat bei Merck, abgerufen am 14. April 2011.
- ↑ Schweiggers Journal 1822, Nr. 33.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 821.
- ↑ G. Jander, E. Blasius: Einführung in das anorganisch chemische Praktikum (qualitative Analyse), 13. Auflage, S. Hirzel Verlag, Stuttgart 1990, ISBN 3-7776-0449-6, S. 482.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Struktur des Na+-Ions
Die Zahl 3
Struktur des Tetrathioantimonat-Anions