Natriumarsenid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| _ Na+ _ As3− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Natriumarsenid | |||||||||||||||
| Andere Namen | Trinatriumarsenid | |||||||||||||||
| Verhältnisformel | AsNa3 | |||||||||||||||
| Kurzbeschreibung | braun violetter Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 143,89 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest[1] | |||||||||||||||
| Dichte | 2,36 g·cm−3[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Natriumarsenid ist eine anorganische chemische Verbindung des Natriums aus der Gruppe der Arsenide. Neben Na3As sind noch weitere Natriumarsenide wie NaAs bekannt.[5]
Gewinnung und Darstellung
Natriumarsenid kann durch Reaktion von Natriumdampf mit Arsen bei 180 bis 200 °C gewonnen werden.[6]
Eigenschaften
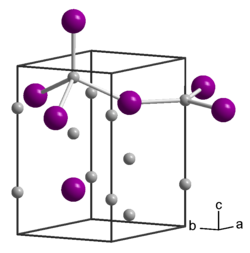
Natriumarsenid ist ein braun-violetter Feststoff. Er besitzt eine hexagonale Kristallstruktur mit der Raumgruppe P63/mmc (Raumgruppen-Nr. 194) und den Gitterparametern a =4,874 Å und c = 8,515 Å.[7] Die Struktur enthält zwei kristallographisch verschiedene Na-Atome; eines ist trigonal-planar von As-Atomen umgeben, das andere tetraedrisch. Andere Literaturquellen berichten von einer Struktur vom Anti-Tysonit-Typ[1] mit der P63cm (Nr. 185).[8] Bei Kontakt mit Wasser bildet sich Arsenwasserstoff.[9][10]
Einzelnachweise
- ↑ a b c J. D. Smith: The Chemistry of Arsenic, Antimony and Bismuth: Pergamon Texts in Inorganic Chemistry. Elsevier, 2013, ISBN 978-1-4831-8754-9, S. 559 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Norbert Auner, Wolfgang A. Herrmann, Uwe Klingebiel: Synthetic Methods of Organometallic and Inorganic Chemistry, Volume 2, 1996: Volume 2: Groups 1,2, 13 and 14. Georg Thieme Verlag, 2014, ISBN 3-13-179171-3, S. 40 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Arsenverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. Juli 2024. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Arsenverbindungen, mit Ausnahme der namentlich in diesem Anhang bezeichneten im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 27. Juli 2024. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ J. Songster, A. D. Pelton: The As-Na (arsenic-sodium) system. In: Journal of Phase Equilibria. 14, 1993, S. 240, doi:10.1007/BF02667819.
- ↑ William A. Hart, O. F. Beumel, Thomas P. Whaley: The Chemistry of Lithium, Sodium, Potassium, Rubidium, Cesium and Francium: Pergamon Texts in Inorganic Chemistry. Elsevier, 2013, ISBN 978-1-4831-8757-0, S. 439 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ H.J. Beister, K. Syassen, J. Klein: Phase transition of Na3As under pressure. In: Zeitschrift für Naturforschung B. 45, 1990, S. 1388–1392 (PDF, freier Volltext).
- ↑ Bodie Douglas, Shi-Ming Ho: Structure and Chemistry of Crystalline Solids:. Springer Science & Business Media, 2007, ISBN 978-0-387-36687-6, S. 323 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Amit Arora: Text Book Of Inorganic Chemistry:. Discovery Publishing House, 2005, ISBN 978-81-8356-013-9, S. 521 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Peter Hafner, Klaus-Jürgen Range: Na3As revisited: high-pressure synthesis of single crystals and structure refinement. In: Journal of Alloys and Compounds. 216, 1994, S. 7, doi:10.1016/0925-8388(94)91033-2.
Auf dieser Seite verwendete Medien
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Autor/Urheber: Andif1, Lizenz: CC BY-SA 4.0
Unit cell of Na3As|Created using Diamond 4. Data from Beister, H J; Syassen, K; Klein, J, Phase transition of Na3As under pressure, Zeitschrift fuer Naturforschung, Teil B. Anorganische Chemie, Organische Chemie (42,1987-) , 45, 1388-1392 (1990)




