N-Hydroxymaleinimid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | N-Hydroxymaleinimid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H3NO3 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 113,07 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | löslich in Tetrahydrofuran, N,N-Dimethylformamid, Pyridin, Methanol, Ethanol[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
N-Hydroxymaleinimid ist ein ungesättigtes cyclisches Imid, dessen Stickstoffatom eine Hydroxygruppe trägt. Wie im Maleinimid und in N-Alkyl- und N-Arylmaleinimiden bewirken die beiden der Doppelbindung benachbarten Carbonylgruppen einen stark elektronenziehenden Effekt, wodurch auch N-Hydroxymaleinimid zu einem sehr reaktiven Dienophil in Diels-Alder-Reaktionen wird.[2]
Herstellung
Frühere Synthesen von N-Hydroxymaleinimid nutzen auch die Diels-Alder-Reaktion der Ausgangsverbindung Maleinsäureanhydrid mit Furan zum Diels-Alder-Addukt exo-3,6-Epoxy-1,2,3,6-tetrahydrophthalsäureanhydrid zur Einführung einer Schutzgruppe für die aktivierte Doppelbindung im Maleinsäureanhydrid.[3]
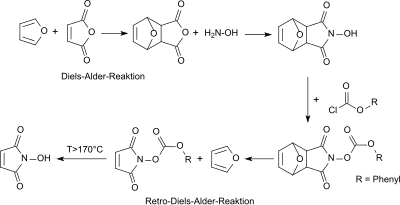
Nach Umsetzung des primären Addukts mit Hydroxylamin wird die reaktive N-Hydroxygruppe mit Phenylchloroformat umgesetzt und so mit der Phenyloxycarbonyl-Schutzgruppe versehen. Zunächst wird durch Erhitzen bei Temperaturen unterhalb 170 °C in einer Retro-Diels-Alder-Reaktion Furan abgespalten, bei weiterer Temperaturerhöhung erfolgt auch die Abtrennung der Phenyloxycarbonylgruppe und das Zielprodukt N-Hydroxymaleinimid fällt in geringen Gesamtausbeuten von ca. 12 % an.[4] Eine Variante nutzt die Trimethylsilylgruppe aus dem Reagenz 1,2-Bis(trimethylsilyl)harnstoff als Schutzgruppe für die N-Hydroxygruppe, die hydrolytisch abgespalten werden kann.[5]

Über die erhaltenen Reinheiten des Endprodukts werden in beiden Veröffentlichungen keine Angaben gemacht.
Der naheliegende Syntheseweg zum N-Hydroxymaleimid, ausgehend von Maleinsäureanhydrid und Hydroxylamin, führt in der ersten Stufe zur Maleinmonohydroxamsäure, die mit wasserentziehenden Mitteln, wie z. B. Acetanhydrid oder POCl3 nicht zum N-Hydroxymaleimid cyclisiert werden konnte.[4]

Eigenschaften
N-Hydroxymaleinimid fällt bei der Synthese als hellgelber bis brauner Feststoff an, der als hygroskopisch, korrosiv, sowie luft- und feuchtigkeitsempfindlich beschrieben ist.[2] Nach Umkristallisation aus n-Hexan-THF wird es als weiße, kristalline Substanz erhalten. Die Substanz reagiert in wässriger Lösung sauer, da die beiden Carbonylgruppen im N-Hydroxymaleimid-Molekül das Wasserstoffatom der N-Hydroxygruppe aktivieren. Die Aktivierung der Doppelbindung führt wiederum zu leichter Addition von Nucleophilen, wie z. B. Amino- und insbesondere Thiolgruppen.
Anwendungen
N-Hydroxymaleinimid wurde als Dienophil zur Synthese der ersten Stufe neuer Anxiolytika und Antidepressiva eingesetzt.[6]

Die Neigung von N-Hydroxymaleinimid zu Diels-Alder-Reaktionen mit Furanen lässt sich auch zum Aufbau thermisch reversibel vernetzter Polymere nutzen, z. B. zur reversiblen Verkapselung elektronischer Komponenten.[7]
Die Acidität der N-Hydroxygruppe kann man sich zum Aufbau von vernetzten Organosiloxanen, bei denen ein Zusatz von N-Hydroxymaleinimid die Vernetzung bei Raumtemperatur verlangsamt.[5]
Die hohe Acidität zusammen mit der ausgeprägten thermischen Stabilität der N-Hydroxymaleinimid-Strukturen machen diese zu interessanten Ausgangsmaterialien für polymere Photoresists mit hoher Auflösung und der Möglichkeit der Entwicklung mit wässrig-alkalischer Medien. Allerdings lässt sich N-Hydroxymaleinimid als 1,2-disubstituiertes Ethylen mit einem aktivierten Wasserstoff an der N-Hydroxygruppe radikalisch nicht zu Homopolymeren mit höheren Molmassen polymerisieren.
Von mehreren untersuchten Schutzgruppen an der aciden N-Hydroxygruppe hat sich insbesondere die Isopropyloxycarbonyl-Gruppe bewährt. Die geschützten N-Hydroxymaleimide können mit AIBN in 1,4-Dioxan-Lösung radikalisch zu Homopolymeren und Copolymeren mit z. B. Styrol mit brauchbaren Molmassen (Mn>10,000) polymerisiert werden.[8]

Die Isopropyloxycarbonyl-Schutzgruppe lässt thermolytisch bei 205 °C abspalten, wobei Poly-N-Hydroxymaleimid entsteht, das sich in Methanol, und wässrig-alkalischen Medien löst, aber in vielen organischen Lösungsmitteln unlöslich ist. Copolymere mit dem N-Hydroxymaleimid-Monomer besitzen außerordentlich hohe Glasübergangstemperaturen von 240 °C und sind in basischen Medien löslich, was auf ihre Eignung als Photoresistmaterialien schließen lässt.
N-Hydromaleinimid ist das Ausgangsmaterial zur Herstellung so genanntem polymerem N-Hydroxysuccinimid, d. h. zur Gewinnung fester Träger für Aktivester zur Peptidsynthese. Ein Weg geht aus von durch Blanc-Reaktion gewonnenem chlormethyliertem Polystyrol, das mit Thioharnstoff und anschließender alkalischer Hydrolyse des entstandenen Isothioharnstoffs zum entsprechenden Thiol reagiert. Die Thiolgruppe addiert leicht an die aktivierte Doppelbindung des N-Hydroxymaleimids zum über eine Thioetherfunktion polymerfixierten H-Hydroxysuccinimid.[9]

Ein völlig anderer Weg führt über die Diels-Alder-Vorstufe des N-Hydroxymaleinimids (chemisch korrekt: exo-N-Hydroxy-7-oxabicyclo[2.2.1]hept-5-en-2,3-dicarboximid), die mithilfe von Carbodiimiden, wie z. B. Diisopropylcarbodiimid zur glatten Umsetzung mit Carbonsäuren aktiviert werden kann. Die entstehenden Aktivester können mit Grubbs-Katalysatoren und einem bifunktionellen Vernetzer durch ring-öffnende Metathese-Polymerisation (ROMP) zu unlöslichen Polymeren umgesetzt werden, die mit primären und sekundären Aminoverbindungen unter schonenden Bedingungen in hohen Ausbeuten zu Amiden reagieren.
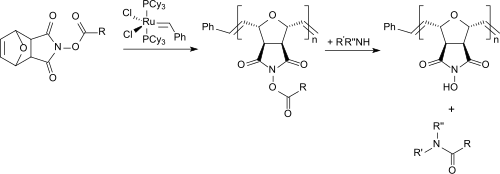
Das polymere N-Hydroxysuccinimid kann durch einfache Filtration zurückgewonnen werden.[10] Diese Route erlaubt auch die Herstellung von polymerfixierten aktivierten Mosher-Estern aus Mosher-Säure, mit denen chirale Amine in die diastereomeren Amide überführt werden,[11] an denen ohne vorhergehende aufwendige Reinigung mittels 1H-NMR-Spektroskopie der Enantiomerenüberschuss stereospezifischer Reaktionen bestimmt werden kann.[12]
Einzelnachweise
- ↑ a b c d Datenblatt N-Hydroxymaleinimid bei Sigma-Aldrich, abgerufen am 28. Mai 2015 (PDF).
- ↑ a b c d B. Bessières, N-Hydroxymaleinimide, e-EROS Encyclopedia of Reagents for Organic Synthesis, 2008, doi:10.1002/047084289X.rn00820
- ↑ J.V. Staros: N-Hydroxysuccinimide active esters: Bis(N-hydroxysulfosuccinimide) esters of two dicarboxylic acids are hydrophilic, membrane-impermeant protein cross-linkers. In: Biochemistry. Band 21, Nr. 17, 1982, S. 3950–3955, doi:10.1021/bi00260a008.
- ↑ a b D.P. Vanderbilt, Bifunctional synzymes via alternating copolymerization, Ph.D. Thesis, University of Florida, 1982
- ↑ a b Patent EP0123321: Verfahren zum Vernetzen von Organopolysiloxanmassen. Angemeldet am 26. April 1984, veröffentlicht am 27. März 1987, Anmelder: Wacker-Chemie GmbH, Erfinder: U. Michel, J. Radecker.
- ↑ J. Kossakowski, M. Krawiecka: Synthesis of new N-substituted cyclic imides with an expected anxiolytic activity. Derivatives of N-Hydroxy-1-methoxybicyclo[2.2.2]oct-5-ene-2,3-dicarboximide. In: Acta Polon. Pharm., Drug Res. Band 60, Nr. 3, 2003, S. 177–182 (PDF).
- ↑ Patent US6271335B1: Method of making thermally removable polymeric encapsulants. Angemeldet am 18. Januar 2000, veröffentlicht am 7. August 2001, Anmelder: Sandia Corp., Erfinder: J.H. Small, D.A. Loy, D.R. Wheeler, J.R. McElhanon, R.S. Saunders.
- ↑ K.-D. Ahn, C. G. Wilson: Synthesis of polymers having N-Hydroxymaleimide units by thermolysis of N-(Isopropyloxycarbonyloxy)maleimide polymers. In: Bull. Korean Chem. Soc. Band 16, 1995, S. 443–449 (PDF).
- ↑ M. Adamczyk, J.R. Fishpaugh, P.G. Mattingly: Preparation and use of N-hydroxysuccinimidyl active ester resins. In: Tetrahedron Lett. Band 40, Nr. 3, 1999, S. 463–466, doi:10.1016/S0040-4039(98)02425-3.
- ↑ A.G.M. Barrett, S.M. Cramp, R.S. Roberts, F.J. Zécri: A ROMPGEL-Supported N-Hydroxysuccinimide: A Host of Acylations with Minimal Purification. In: Org. Lett. Band 2, Nr. 2, 2000, S. 261–266, doi:10.1021/ol991208w.
- ↑ G.R. Sullivan, J.A. Dale, H.S. Mosher: Correlation of configuration and fluorine-19 chemical shifts of α-methoxy-α-trifluoromethylphenyl acetate derivatives. In: J. Org. Chem. Band 38, Nr. 12, 1973, S. 2143–2147, doi:10.1021/jo00952a006.
- ↑ T. Arnauld, A.G.M. Barrett, B.T. Hopkins, F.J. Zécri: Facile and purification free synthesis of Mosher amides utilizing a ROMPgel supported reagent. In: Tetrahedron Lett. Band 42, Nr. 46, 2001, S. 8215–8217, doi:10.1016/S0040-4039(01)01724-5.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Polymerfixiertes N-Hydroxysuccinimid über Thioladdition
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Polymerfixiertes N-Hydroxysuccinimid über ringöffnende Metathesepolymerisation (ROMP)
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Synthese des N-Hydroxymaleinimids über Trimethylsilyl-Schutzgruppe
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Reaktion von Maleinsäureanhydrid mit Hydroxylamin zur Hydroxamsäure
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Aufbau und thermische Spaltung von Maleinimidpolymeren
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Strukturformel von N-Hydroxymaleinimid
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Synthese von N-Hydroxymaleinimid über Diels-Alder und Retro-Diels-Alder
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Erste Stufe zu Anxiolytica mit N-Hydroxymaleimid-Struktur









