N-Heterocyclische Carbene

N-Heterocyclische Carbene oder abgekürzt NHC (gelegentlich auch Arduengo-Carbene) sind eine Gruppe von organischen chemischen Verbindungen. Es handelt sich hier um elektronenreiche, aromatische oder ungesättigte heterocyclische Verbindungen, die stabile Carbene ausbilden können.
Sie wurden von Anthony J. Arduengo 1991 entdeckt.[1] Vermutet wurde ihre Existenz schon um 1960 durch Hans-Werner Wanzlick.
Struktur und Stabilität

Die hohe Stabilität von NHCs im Vergleich zu anderen Carbenen wird vor allem durch die −I und +M -Effekte der benachbarten Heteroatome verursacht. Die Elektronendichte des leeren p-Orbitals am Kohlenstoff wird so erhöht. Neben Stickstoff können auch Schwefel oder Sauerstoff das Carben stabilisieren. NHCs mit Imidazol als Grundgerüst werden zusätzlich durch ihre Aromatizität stabilisiert.
Bildung
Freie Carbene werden meistens durch die Deprotonierung von Imidazolium-Salzen bzw. den entsprechenden kationischen Vorläuferverbindungen erhalten. Typischerweise werden dabei starke Basen wie beispielsweise Natriumhydrid oder Alkoholate verwendet.
Dimerisierung
Manche NHCs dimerisieren zu Tetraaminoethylen-Derivaten. Sie stehen in einem chemischen Gleichgewicht, dem sogenannten Wanzlick-Gleichgewicht, mit den entsprechenden Carbenen.[2] Anders als zunächst vermutet spielt dieses Gleichgewicht für die meisten NHCs keine Rolle.

Anwendung
NHCs spielen eine wichtige Rolle als Liganden für Metallkomplexe. Durch ihre Eigenschaften als starke sigma-Donoren und ihre kinetische Inertheit stellen sie eine beliebte Alternative für Phosphine besonders für Übergangsmetallkatalysen dar. Übergangsmetall-NHC-Komplexe sind oft temperaturstabiler und weniger oxidationsempfindlich als Phosphinkomplexe. Die Steuerungsfunktion der NHCs bei katalytischen Verfahren (Organometall-Katalyse) wurde von Wolfgang A. Herrmann an der Technischen Universität München im Jahre 1994 entdeckt, der daraufhin diese den Phosphinen in ihrer Wirksamkeit oftmals überlegene variantenreiche Ligandenfamilie systematisch entwickelte.[3][4][5]
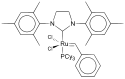
Ein bekanntes Beispiel für die Anwendung von Übergangsmetall-NHC-Komplexen in der Katalyse ist der Olefinmetathese-Katalysator der zweiten Generation von Robert H. Grubbs.[6][7]

Eine weitere wichtige Eigenschaft ist die Befähigung der NHC zur Ausbildung von Charge-Transfer-Komplexen.
Literatur
- Dieter Enders, Oliver Niemeier, Alexander Henseler: Chemical Reviews. 107, Nr. 12, 2007, S. 5606–5655.
- Silvia Díez-González (Hrsg.): N-Heterocyclic Carbenes: From Laboratory Curiosities to Efficient Synthetic Tools, RSC catalysis series, Royal Society of Chemistry 2010
- Matthew N. Hopkinson, Christian Richter, Michael Schedler, Frank Glorius: An Overview of N-Heterocyclic Carbenes. In Nature 510, 2014, S. 485–496, doi:10.1038/nature13384
- Eintrag zu N-heterocyclische Carbene. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. April 2014.
- T. Dröge, F. Glorius: Das Maß aller Ringe – N-heterocyclische Carbene. In: Angew. Chem. 122, 2010, S. 7094–7107, doi:10.1002/ange.201001865.
- F. Ekkehardt Hahn, Mareike C. Jahnke: Heterocyclische Carbene – Synthese und Koordinationschemie. In: Angew. Chem. 120, 2008, S. 3166–3216, doi:10.1002/ange.200703883.
- Wolfgang A. Herrmann, Christian Köcher: N-Heterocyclic Carbenes. In: Angew. Chem. Int. Ed. Engl. 36 (20), 1997, S. 2162–2187, doi:10.1002/anie.199721621.
- Silvia Díez-González, Nicolas Marion, Steven P. Nolan: Chem. Rev. 109, Nr. 8, 2009, S. 3612–3676.
Einzelnachweise
- ↑ A. J. Arduengo III., R. L. Harlow, M. J. Kline: A stable crystalline carbene. In: J. of the Am. Chem. Soc. Band 113, 1991, 113, S. 361–363.
- ↑ Volker P. W. Böhm, Wolfgang A. Herrmann: The Wanzlick Equilibrium. In: Angewandte Chemie. 2000, 39, S. 4036–4038, doi:10.1002/1521-3773(20001117)39:22<4036::AID-ANIE4036>3.0.CO;2-L.
- ↑ W. A. Herrmann, M. Elison, J. Fischer, Ch. Köcher, G. R. J. Artus: Metallkomplexe heterocyclischer Carbene – ein neues Katalysator-Strukturprinzip in der homogenen Katalyse Angew. Chem., 107 (1995) S. 2602–2605, doi:10.1002/ange.19951072124.
- ↑ W. A. Herrmann: N-Heterocyclic Carbenes – A New Concept in Organometallic Catalysis, Angew. Chem. Int. Ed. Engl., vol. 41 (2002), pg. 1290-1309, doi:10.1002/1521-3773(20020415)41:8<1290::AID-ANIE1290>3.0.CO;2-Y.
- ↑ DE 19815275B4 (Erf. W. A. Herrmann, W. Schattenmann, Th. Weskamp), Aventis/Evonik Degussa GmbH, Prior. 6. April 1998.
- ↑ R. H. Grubbs: Handbook of Metathesis. Wiley-VCH, 2003. ISBN 3-527-30616-1
- ↑ R. H. Grubbs, Trnka T.M.: Ruthenium-Catalyzed Olefin Metathesis. In: Ruthenium in Organic Synthesis (S.-I. Murahashi, Ed.), Wiley-VCH, 2004. doi:10.1002/3527603832.ch6.
Auf dieser Seite verwendete Medien
Autor/Urheber: Dissolution, Lizenz: CC BY-SA 3.0
Wanzlick_equilibrium Lemal Hahn 1999
NHC general structure
chemical structure of Grubbs Catalyst 2nd Generation.svg