N-Carbonsäureanhydrid-Methode
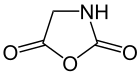
Oxazolidin-2,5-dion, |
Die N-Carbonsäureanhydrid-Methode (auch NCA-Methode oder Leuchs-Methode) ist eine Synthese der Organischen Chemie.[1][2] Hermann Leuchs (1879–1945) beschreibt die Methode erstmals 1906 als intramolekulare Bildung von α-Aminosäure-N-carboxyanhydriden (NCAs oder auch Leuchs’sche Anhydride) ausgehend von N-Alkoxycarbonylaminosäurechloriden.[3][4]
Übersichtsreaktion
Leuchs setzte ursprünglich N-Alkoxycarbonylaminosäuren, wie die Gylcincarbonsäure, mit Thionylchlorid zu den jeweiligen Säurechloriden um.[2] Die bei dieser Herstellung von Säurechloriden entstehenden gasförmigen Nebenprodukte bieten dabei den Vorteil, dass eine Aufarbeitung des Produkts nicht erforderlich ist.[2][4] Beispielsweise würde bereits die Destillation des Aminosäurechlorids zur Zersetzung des Produkts führen.[2][4] Leuchs Methodik zur Herstellung von NCAs beschreibt die anschließende intramolekulare Cyclisierung des Aminosäurechlorids unter leichter Erwärmung im Vakuum und Abspaltung eines Alkylchlorids.[2] Im Folgenden wird die Leuchs-Methode exemplarisch an der Synthese von Oxazolidin-2,5-dion dargestellt:
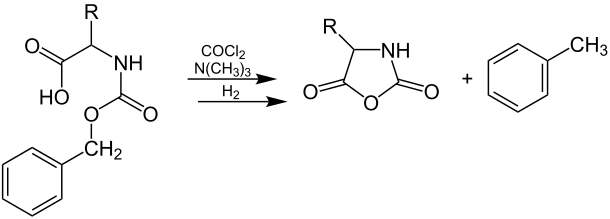
Neuere Quellen berichten auch über die Synthese von NCAs ausgehend von Phosgen, Diphosgen, Triphosgen, Phosphortribromid oder Phosphorpentachlorid anstelle von Thionylchlorid.[5] Die Verwendung dieser Reagenzien ermöglicht beispielsweise die Durchführung der Reaktion mit Aminosäuren ohne Schutzgruppen bei höheren Temperaturen.[2][5] Im Folgenden wird die Synthese von NCAs über die Reaktion von N-Benzyloxycarbonylaminosäuren mit Phosgen in Triethylamin dargestellt (wobei R ein Wasserstoffatom oder organischer Rest sein kann):[2]
Reaktionsmechanismus
Der Reaktionsmechanismus findet in der Literatur keine Erwähnung und wird demnach an dieser Stelle nicht weiter thematisiert.
Atomökonomie und Verwendung von NCAs
Die Vorbereitung der Aminosäuren, beispielsweise zu den entsprechenden Chloriden, führt zur Entstehung von Nebenprodukten, wie Säureabfällen, zudem wird der Einsatz von Reagenzien erfordert. Die Atomeffizienz ist im Rahmen der Präparation der Edukte bereits nicht optimal. Die mögliche Entstehung halogenierter Nebenprodukte sorgt zusätzlich für keine absolute Atomeffizienz.
Trotz nicht optimaler Atomeffizienz werden im Rahmen dieser Methode jedoch reaktive Produkte, die sich durch eine aktivierte Carboxygruppe auszeichnen und somit eine gute Verwendung im Rahmen von Peptid-Synthesen finden können, synthetisiert.[1] So entwickelte J. Leggett Bailey 1949 eine Peptid-Synthese, basierend auf der Verwendung von NCAs.[6]
Einzelnachweise
- ↑ a b Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine. Verlag Chemie, Weinheim, S. 164–166, 1982, ISBN 3-527-25892-2.
- ↑ a b c d e f g Hans Rytger Kricheldorf: α-Aminoacid-N-Carboxy-Anhydrides and Related Heterocycles. Syntheses, Properties, Peptide Synthesis, Polymerization. Springer Verlag, Berlin Heidelberg, 1987, S. 1–4, DOI: 10.1007/978-3-642-71586-0, ISBN 978-3-642-71588-4 (Druck), ISBN 978-3-642-71586-0 (Online).
- ↑ Fritz Kröhnke: Hermann Leuchs. 1879–1945. In: Chemische Berichte. Band 85, Nr. 11, 1952, S. 55–89, DOI:10.1002/cber.19520851102.
- ↑ a b c Hermann Leuchs: Ueber die Glycin-carbonsäure. In: Berichte der deutschen chemischen Gesellschaft. Band 39, Nr. 1, 1906, S. 857–861, DOI: 10.1002/cber.190603901133.
- ↑ a b Renée Wilder, Shahriar Mobashery: The Use of Triphosgene in Preparation of N-Carboxy-α-amino Acid Anhydrides. In: Journal of Organic Chemistry. Band 57, Nr. 9, 1992, S. 2755–2756, DOI:10.1021/jo00035a044.
- ↑ J. Leggett Bailey: A new Peptide Synthesis. In: Nature. Band 164, Nr. 4177, 1949, S. 889, DOI:10.1038/164889a0.