Multiple Chemikalien-Sensitivität
| Klassifikation nach ICD-10 | |
|---|---|
| T78.4 | Allergie, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |
Die Multiple Chemikalien-Sensitivität oder Vielfache Chemikalienunverträglichkeit (abgekürzt MCS von englisch Multiple Chemical Sensitivity) ist eine chronische Multisystem-Erkrankung mit zum Teil starken Unverträglichkeiten von vielfältigen flüchtigen Chemikalien, wie etwa Duftstoffen, Zigarettenrauch, Lösemitteln oder Abgasen. Die Konzentrationen dieser symptomauslösenden Stoffe liegen weit unterhalb der Schwellkonzentration, die bei gesunden Personen Reizungen oder toxische Wirkung ausweisen. MCS wird von zahlreichen internationalen Fachverbänden wie der WHO oder der AMA nicht als eigenständiges Krankheitsbild anerkannt. In Deutschland wurde die ICD-10-GM-Klassifizierung unter T78.4 durch das Deutsche Institut für Medizinische Dokumentation und Information festgelegt.[1]
Definition und Grundlagen
Synonym oder im gleichen Zusammenhang werden Bezeichnungen wie Multiple Chemical Sensitivity-Syndrom (MCS-Syndrom), multiple Chemikaliensensitivität, multiple Chemikalienunverträglichkeit, multiple Chemikalienüberempfindlichkeit, vielfache Chemikaliensensitivität, chemische Mehrfachempfindlichkeit, Idiopathic Environmental Intolerances (IEI), idiopathische umweltbezogene Unverträglichkeiten, idiopathische Umwelt-Unverträglichkeit, idiopathische Chemikaliensensitivität, Umweltkrankheit, Ökosyndrom benutzt.
Aus dem Jahr 1999 stammen die MCS-Konsensus-Kriterien nach Bartha et al.[2]
- Die Symptome sind reproduzierbar mit wiederholten chemischen Expositionen.
- Der Krankheitsverlauf ist chronisch.
- Symptome werden durch niedrige Expositionsniveaus ausgelöst, die von anderen Personen im Allgemeinen toleriert werden bzw. vor Beginn der Erkrankung toleriert wurden.
- Die Symptome bessern sich oder vergehen ganz, wenn die Auslöser gemieden bzw. entfernt werden.
- Die Auslösung der Symptome erfolgt durch verschiedene chemisch miteinander nicht verwandte Stoffe.
- Mehrere Organe oder Organsysteme sind von Symptomen betroffen. [Hinzugefügt 1999]
Nach Martin Pall sind die von Cullen festgelegten Kriterien zu überarbeiten. So stehen heutzutage zahlreiche diagnostische Labortests zur Verfügung. Auch sollten die durch Überempfindlichkeit des zentralen Nervensystems ausgelösten Symptome berücksichtigt werden.[3]:46[4]
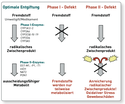
Der Krankheitsverlauf gliedert sich in zwei Phasen: Während der Sensibilisierungsphase I kommt es durch Einwirkung einer oder mehrerer Chemikalien zu einer unspezifischen Herabsetzung der Empfindlichkeit zu Chemikalien. In der Sensibilisierungsphase II treten Symptome bei erneuter Exposition bereits bei geringen Chemikalienkonzentrationen auf. Die Dauer vom ersten Kontakt bis zur Krankheit kann 2 bis 4,3 Jahre beantragen. Die auslösenden Substanzen von Phase I und II müssen nicht identisch sein. Phase I kann durch einen Stoff hoher Konzentration oder mehrere niedrig konzentrierte Stoffgemische initialisiert werden.[3]:46/47 Objektivierbare Laborbefunde können mittels Basophilen-Degranulations-Test (BDT) oder dem Lymphozytentransformationstest ermittelt werden.
Krankheitsbild
MCS-Betroffene haben meist eine Vielzahl unspezifischer Beschwerden wie Atemnot, Augenbrennen, diffuse Schmerzen, Haut- und Schleimhautprobleme, Konzentrationsstörungen, Kopfschmerzen, Magen-Darm-Beschwerden, chronische Müdigkeit, Muskelschwäche, Ödeme, Verlust an Merkfähigkeit, Schwindel, Angstgefühle oder Depressionen. Hinzu kommen häufig Geruchsempfindlichkeit, Geschmacksstörungen, Ohrgeräusche (Tinnitus), abnehmendes Leistungsvermögen sowie Erschöpfungsgefühl.[3]:16/17 Die Beschwerden dauern über sechs Monate an. In der Regel nehmen die Symptome mit der Zeit zu, ebenso die Anzahl der Substanzen, die von den Betroffenen als auslösend wahrgenommen werden.[5]
In Studien zeigte sich bei MCS-Erkrankten eine höhere Infektanfälligkeit, Textil-Unverträglichkeiten sowie eine signifikant gesteigertes Belästigungsgefühl durch Emissionen von Baumaterialien, Wand- und Bodenbelägen, Anstrichen, Möbel, Dentalwerkstoffe, Bedarfsgegenstände samt Umweltchemikalien an als die Kontrollgruppe. Eine psychosoziale Ursache wurde seitens der Patienten negiert.[3]:17
Unverträglichkeiten gegenüber flüchtigen und gasförmigen Arzneimittel führen zu einer Einschränkung der medizinischen Behandlungsmöglichkeiten. So werden Narkosemittel und Anästhetika wie Thiopental, Lidocain oder Morphin schlecht bzw. gar nicht vertragen. Die Applikation dieser Stoffe kann daher zu Verengung der oberen Luftwege mit Atemnot, Störungen im Herz-Kreislauf-System, orthostatische Intoleranz, länger andauernde Panikattacken, Schüttelanfälle, Muskel- und Extremitätenschmerzen, Müdigkeit, Schwächegefühl, Erschöpfungsgefühl sowie Übelkeit mit Brechreiz führen. Um diese Symptome zu umgehen, wird mit verminderter Dosis operiert und die erhöhte Schmerzbelastung des Patienten zwangsweise in Kauf genommen.[3]:18
MCS kann in vier Schweregrade eingeteilt werden, wobei zu beachten gilt, dass Symptome dennoch sehr unterschiedlich stark ausgeprägt vorliegen können. Beim höchsten Schweregrad treten Symptome wie schwere Erschöpfung, allgemeine Schwäche, Konzentrations- und Gedächtnisstörungen sowie Muskelschmerzen in den Vordergrund. Die Patienten sind in diesem Stadium arbeitsunfähig und im täglichen Lebensunterhalt stark eingeschränkt. Sind die Patienten, z. B. aus finanziellen Gründen nicht in der Lage, ihr Umfeld, insbesondere die Wohnung, entsprechend teils mehrfach zu sanieren, kann dies dazu führen, dass tägliche Dinge wie Einkaufen, Essenszubereitung und Körperhygiene nicht mehr selbstständig durchgeführt werden können. Dieses Endstadium entspricht Pflegestufe II bis III. in diesem Zusammenhang ist von einer erhöhten Suizidalität auszugehen.[3]:19/20
Prävalenz
Es wurden für mehrere Länder Prävalenzen für Überempfindlichkeiten gegenüber Chemikalien publiziert. In den meisten Studien wurde zwischen einer „Chemikalien-Intoleranz“ (CI) mit moderatem gesundheitlichen Einfluss und der schweren Ausprägung mit täglichen Symptomen und weitreichenden gesundheitlichen Auswirkungen (MCS) unterschieden. Die Angaben für die Prävalenz der MCS liegen zwischen 0,5 % und 3,9 %.[6][7]
- 5 % (Deutschland)
- 0,9 % (Australien)
- 3,7 % (Schweden)
- 3,8 % (Japan)
- 3,9 % (USA)
Vor allem in den Vereinigten Staaten gab es Studien zur Abklärung und Abgrenzung vom MCS mit symptomatisch ähnlichen Krankheitsbildern wie chronisches Erschöpfungssyndrom, chronische Virusinfektionen, Fibromyalgie oder andere rheumatische Erkrankungen, Autoimmunerkrankungen, Allergien und Asthma.
Moderate Chemikalien-Intoleranzen treten bei 9 bis 33 % der untersuchten Bevölkerungen auf. Die Ergebnisse von drei Studien liegen mit 15 bis 16 % sehr dicht beieinander. Die Zahlen decken sich auch mit Angaben von Jugendlichen.[8]
Ursachen
Risikofaktoren
Durch Kontakt mit vielfältigen, umweltbedingten Expositionsfaktoren kommt es zu einer gesteigerten Häufigkeit an chronisch entzündlichen Erkrankungen wie MCS. Neben Schadstoff- und Schimmelpilzbelastungen kommen zunehmend elektromagnetische Felder durch den Mobilfunkausbau in Spiel.[3]:3
Einige Bereiche im Alltag bergen ein besonderes gesundheitliches Risiko:[3]:3/4
- chemisch ungebundene Weichmacher (hauptsächlich Phthalate) in Lebensmittelverpackungen, Spielwaren für Kinder oder medizinischen Utensilien wie Infusionsbesteck oder Katheter. Als Weichmacher in Verpackungsfolien lagern sich Phthalate leicht in Lebensmittel mit hohem Fettgehalt ein.
- Begasung von Frachtcontainern bei Überseetransporten mit Pestiziden/halogenierten Kohlenwasserstoffen wie Dibromethan oder Dichlorethan
- Anwendung von Insektiziden/Pyrethroide im privaten Bereich aber auch in Flugzeugkabinen oder Bahnwaggons
- einfacher Zugang zu toxischen Pestiziden, Desinfektionsmitteln und Bioziden in Reinigungsmitteln in Super- und Drogeriemärkten
- Belastung von Lebensmitteln mit bis zu 16 verschiedenen Pestiziden, um die Grenzwerte einzuhalten. Dennoch kommt es oft zur Überschreitung dieser Grenzen.
- synthetische Duftstoffe in Seifen, Wasch-, Spül- und Reinigungsmitteln
- Computer samt elektronischen Geräten mit Flammschutzmitteln wie Diphenylether, Tetrabrombisphenol A oder Trialkylphosphate, die beim Betrieb ausgasen
- ausgasende Flammschutzmittel, Insektizide und Fungizide sowie Weichmacher und Kunststoff-Monomere in Bodenbelägen, Möbeln und Textilien. Beispielsweise sind Phthalate chemisch ungebunden, gasen daher in geringen Mengen ständig aus und können sich ähnlich wie PCB oder Dioxine anreichern bzw. an Wandoberflächen niederschlagen. Bei ansteigenden Temperaturen (z. B. Heizen im Winter) verdampfen sie wieder und führen zu einer kurzzeitig hohen Exposition.
- zunehmender Anteil an Aromastoffen, Emulgatoren, Farbstoffen, synthetischen Süßstoffen und Zucker in industriellen Lebensmitteln
- Ausbau an Müllverbrennungsanlagen sowie Verbrennung von Sondermüll in Müllheizkraftwerken, welche im Idealfall die Grenzwerte gerade noch einhalten. Geringe Abgabemengen von chlorierten Dioxinen und Biphenylen an die Umwelt sind zwar erlaubt, jedoch kommt es auf ein Jahr hochgerechnet auf Anreicherungen im Grammbereich. Die Stoffe lagern sich beim Menschen im Fettgewebe ein, die Akkumulation wird durch die chemische Stabilität begünstigt und sie haben zudem eine hohe Halbwertszeit.
- Herstellung und Verwendung persistenter organischer Schadstoffe sowie CMR-Stoffe
- Holzschutzmittel (Lindan) im Wohnraum
Es gibt eine Vielzahl von Studien zur MCS-Prävalenz in Kollektiven, die nach erhöhten Schadstoffexpositionen erkrankten. Die prozentualen Anteile von Personen mit nachfolgenden chemischen Intoleranzen bzw. MCS lagen in diesen Kollektiven zwischen 25 % und 60 %.[9]
MCS tritt häufiger bei Personen mit zusätzlichen chronischen Erkrankungen auf. Hier wird eine Vulnerabilität der Betroffenen vermutet:
- Asthma und hyperreagibles Bronchialsystem
- allergische Disposition
- andere Intoleranzen (Nahrungsmittel, Medikamente)
- posttraumatische Belastungsstörung
- psychosozialer Stress
- ängstliche Disposition oder Angststörungen
- weibliches Geschlecht
Das MCS-Risiko ist überproportional erhöht, wenn mehrere der Risikofaktoren vorliegen (z. B. Lösemittel-Exposition, allergische Disposition und Stress).[10] Einkommen, soziale Stellung oder ethnische Zugehörigkeit beeinflussen die MCS-Häufigkeit dagegen nicht.[11]
Arbeits- oder umweltbedingte Störung
MCS als arbeits- oder umweltbedingte Störung (mit möglicher genetischer Beteiligung), wie: Vergiftung, Fehlfunktion von Nerven-, Immun-, Hormonsystem oder Atemwegen, Herabsetzung nervlicher Auslöseschwellen für Missempfindungen, Schmerzen und Fehlfunktionen. Chemische Auslöser von MCS können u. a. Lösungsmittel, Pestizide, bestimmte Metalle und ihre Legierungen, Verbrennungsprodukte und andere Schadstoffgemische sein.[12]
Multifaktorielle und mehrstufige Störung
Nach einer Initialexposition gegenüber meist neurotoxischen Schadstoffen treten zunächst oft unspezifische Symptome einer neurotoxischen Wirkung auf (z. B. Lösemittel-Syndrom), dieser Effekt sollte nach Expositionsende überwiegend reversibel sein. Durch zusätzliche Stressoren (z. B. psychosozialer Stress, Angst) oder bei empfindlichen Bevölkerungsgruppen (z. B. multiple Allergien, Asthma) und langen Expositionszeiten geht die Störung über Jahre in eine chronische Form über, bei der zunehmend weniger Chemikalien ausreichen, um die Symptome zu erzeugen (= bio-psycho-soziales Modell).[12][10]
Psychogenes Modell
Dass umweltmedizinische Patienten so oft psychiatrische Diagnosen erhalten, liegt in der Natur der Exposition begründet. So führen neurotoxische Schadstoffe, und das sind die häufigsten in unserem direkten Umfeld, den o. g. unspezifischen Symptomen, welche aber auch zu hohen Scores in psychometrischen Fragebögen führen. Die Frage „Umweltmedizin oder Psychiatrie“ wurde daher schon vielfach diskutiert.[13][14][15][16]
Studien zeigen eine hohe psychosomatische Komorbidität von langjährigen MCS-Patienten.[17][18][19] Allerdings leiden die Patienten im Durchschnitt schon mehr als 8 bis 10 Jahre an ihren Symptomen, bevor MCS erkannt wird. Es ist also die Frage, ob die MCS durch psychische Störungen (mit)verursacht wird oder ob die schwere Belastung durch die MCS die Ursache für nachfolgende psychische Störungen ist (oder beides).[20]
Studien mit Personen mit beginnenden chemischen Intoleranzen fanden lediglich eine leichte Erhöhung für ängstliche Tendenzen bei den Betroffenen. Jedoch haben die Betroffenen häufiger Asthma, ein hyperreagibles Bronchialsystem und Allergien. Nach Caress u. a. wiesen vor der Entwicklung der MCS nur 1,4 % der Betroffenen eine manifeste psychische Erkrankung auf.[21][22][23][24][25][26]
Unter kontrollierten Bedingungen durchgeführte Provokationstests erlauben keine auf spezifische Chemikalieneinwirkung zurückgehende Unterscheidung zwischen langjährig von MCS betroffenen Patienten und Vergleichspopulationen.[27][28] Dies konnte jedoch bei noch gesunden Probanden mit chemischer Sensitivität nachgewiesen werden.[29]
Pathomechanismus
Es gibt zwei toxikologische Ansätze zur Erklärung des Pathomechanismus von MCS: das Modell der neurogenen und das Modell der chemischen Entzündung.
Neurogene Entzündung
Eine Chemikalien-Exposition kann bei Patienten stattfinden, ohne dass diese einen störenden Geruch wahrnehmen.[3]:62 Dies führt zu Veränderungen von Hirnfunktionen: Es kommt zu einer verminderten Durchblutung des Temporallappens, den beiden Schläfenregionen und den präfortalen Bereichen der Großhirnrinde. Bei chronische erkrankten Patienten zeigt sich diese Störung permanent. Bei weiterer Exposition von auslösenden Stoffen kommt es bei ihnen zu einer zusätzlich verminderten Durchblutung des Riechhirns im rechten und linken Hippocampus, im rechten Parahippocampus, im rechten Mandelkern (Amygdala), im rechten Thalamus und in der rechten unteren Hirnrinde. Bei gesunden Patienten sind andere Regionen von einer verminderten Durchblutung betroffen.[3]:64
Flüchtige, organische Verbindungen führen zudem zu verlängerten Reaktions- und Reflexzeiten, einem gestörten Gleichgewichtssinn, Nachlassen des Farbunterscheidungsvermögens sowie der kognitiven Leistungen.[3]:66
Ein direkter Transport von Chemikalien über das olfaktorische System konnte bei Ratten nachgewiesen werden.[30] Hierbei wirken Schadstoffe direkt auf das Gehirn, da die Blut-Hirn-Schranke umgangen wird: Von der Riechschleimhaut zum Bulbus olfactorius / 1. Hirnnerv, weiter zur Amygdala und schließlich ins limbische System und über den Thalamus zum Frontalcortex.[3]:68/69
Durch wiederholte Erregung dieses Nervensystems kommt es insbesondere im limbischen System zu einer Sensibilisierung, infolge derer die Schwelle für nachfolgende Reaktionen auf Chemikalien herabgesetzt wird. Dies führt wiederum zu einer unspezifischen Reaktionsbereitschaft gegenüber Substanzen, denen man bisher noch nicht ausgesetzt war.[3]:70/71
Nach Exposition von MCS-Patienten mit flüchtigen, organischen Verbindungen steigen die Werte des Nervenwachstumsfaktors und des vasoaktiven Peptids über den ohnehin schon erhöhten Grundwert.[31] Bei Patienten mit allergischen Ekzemen oder allergischer Dermatitis ist dies nicht der Fall. Dies ermöglicht die Abgrenzung zwischen neurogener Entzündung und atopischem bzw. allergischem Formenkreis.[3]:77
TRP-Rezeptoren
Die Bindung bestimmter Fremd- oder Schadstoffe an Chemo- bzw. Nozizeptoren sensibler C-Fasern in Haut, inneren Organen und Schleimhäuten der Atemwege führt zu deren Erregung und der Weiterleitung dieses Signals zum Zentralen Nervensystem. Die bedeutendsten Nozizeptoren sind die Vanilloid- und die TRP-Rezeptoren. Aktiviert werden diese durch Capsaicin, reaktive Sauerstoffverbindungen, flüchtige Pilzgifte vom Typ der Dialdehyde (z. B. Isovalleral) oder flüchtige, organische Ausgasungen. Die Rezeptoren sind somit für die Auslösung in Phase II und bei der Ausprägung der Symptome von Phase I mitverantwortlich.[3]:73 Die von den Rezeptoren erregten C-Fasern senden das Signal ans Rückenmark und die Medulla. Infolgedessen wird Glutamat ausgeschüttet und damit der NMDA-Rezeptor aktiviert. Dieser wird phosphoryliert und damit permanent in einen aktivierten Zustand versetzt, sodass es zu einer erhöhten Reizempfindlichkeit bei gleichbleibendem Stimulus kommt. Einige der so aktivierten Nervenzellen geben Substanz P ins ZNS und Peripherie ab. Substanz P ist wiederum für die Auslösung von Entzündungs- und Schmerzreaktionen verantwortlich.[3]:73
Das Krankheitsbild der Fibromyalgie wird durch selbigen Mechanismus mitverursacht.[3]:73/74
Der TRPA1-Rezeptor, eine Untergruppe der TRP-Rezeptoren, ist ein Chemorezeptor, der durch Stoffe wie Allicin Gingerol, Senföl, Zimtaldehyd, Allylisothiocyanat und durch Isovalleral gereizt wird. Zudem bindet er Schadstoffe wie Acrolein, Isothiocyanate, weitere organische Reizstoffe in Abgasen und verschiedene Aldehyd-Bestandteile des Zigarettenrauchs, aber auch Metabolite verschiedener Medikamente sowie 4-Hydroxynonenal.[32] Man geht davon aus, dass die aus Polyurethanschäumen ausdünstenden Isocyanate über den TRP-Rezeptor wirken.[3]:74 In Tierversuchen konnte gezeigt werden, dass die kovalente Bindung am TRPA1-Rezeptor Entzündungs- und Schmerzreaktionen hervorrufen.[33] Die kovalente Bindung kommt dadurch zustande, dass elektrophile Stoffe mit einer SH-Gruppe eines Cysteinrestes am TRPA1-Rezeptor interagieren. Solche Stoffe kommen vermehrt in Zigarettenrauch, Smog aber auch Brandrauch vor und sind bei einer Rauchvergiftung ursächlich für lebensgefährliche Atemnot. Ferner gehören zu dieser Stoffgruppe auch alle Produkte des oxidativen Stresses und der Lipidperoxidation.[3]:74 Infolge der kovalenten Bindung bleibt der Rezeptor auch noch nach Einwirken der Stoffe in seinem aktivierten Zustand, was wiederum zur Herabsetzung der Empfindlichkeitsschwelle führt. Die Symptome dieser Empfindlichkeitsreaktion, insbesondere auf organische Lösungsmittel und einige Pestizide[34], sind auf die Funktion der TRP-Rezeptoren zurückzuführen und erinnern an eine Rhinitis oder Asthma. Daher spricht man hierbei von einem „Reactive Airway Dysfunction Syndrome“ (RADS).[35] Allerdings fehlen bei dieser Form des Asthmas allergenspezifische Antikörper oder T-Lymphozyten: Aktivierte Effektorzellen des Immunsystems (z. B. Mastzellen) sind nachweisbar.[3]:75/76
Neben dem TRPA1-Rezeptor können chemische Stoffe auch direkt im Gehirn am TRPV1-Rezeptor wirken. Die dadurch erhöhte Glutamatausschüttung führt wiederum zur Aktivierung der NMD-Rezeptoren und damit letztendlich zur Ausbildung von Entzündungsprozessen.[36] Solche chronischen Entzündungen induzieren Gene zur Synthese neuer TRPV1-Rezeptoren an sensorischen Nervenfasern der Luftwege und führen damit wiederum zur gesteigerten Reizempfindlichkeit gegenüber chemischen Substanzen.[37]
NMDA-Rezeptoren
Die durch Glutamat verursachte Aktivierung des NMDA-Rezeptors führt zur verstärkten Bildung von Stickstoffmonoxid (NO), einem Auslöser von Entzündungsreaktionen.[38] Daher kann man bei MCS oder auch CFS erhöhte Parameter des NO-Stoffwechsels wie z. B. Citrullin, Citrullin-gebundene Peptide oder gesteigerte NO-Konzentrationen in der Ausatmungsluft feststellen.[3]:87
An der Entstehung von MCS sind drei NO-Synthasen beteiligt: die neutrale NOS (nNOS), die endotheliale NOS (eNOS) und die induzierbare NOS (iNOS). Sie werden alle unter anderem durch Calcium aktiviert, dass durch den aktivierten NMDA-Rezeptor in die Zelle geströmt ist. Insbesondere die iNOS zeigt bei Entzündungen eine vielfach gesteigerte Aktivität.[3]:88
Stickstoffmonoxid reagiert mit Superoxidradikalen und anderen reaktiven Sauerstoffverbindungen zu Peroxynitrit, einem starken Oxidans, das insbesondere die Superoxiddismutase (SOD) hemmt. Folglich kommt es durch die Anreicherung der ROS wiederum zu einer vermehrten Bildung von Stickstoffmonoxid. Es entstehen in der Funktion eingeschränkte Mitochondrien sowie Strukturschäden und Entzündungen im Gehirn und Nervensystem.[3]:88 Die erhöhte Chemikaliensensibilität im limbischen System ist auf die Hirnregionen beschränkt, in denen NMDA-Rezeptoren vorkommen.[39] Die durch den NO-Peroxinitrit-Zyklus hervorgerufene Störung des Energiestoffwechsels verursacht eine Überempfindlichkeit der NMDA-Rezeptoren gegenüber weiteren Reizen. Dies geschieht durch Erniedrigung des Membranpotentials.[40][41]
Die SH-Gruppe des Cysteins ist der Hauptangriffspunkt von Stickstoffmonoxid[42]; die Bildung dieser Nitrosylverbindungen ist meist reversibel. Peroxynitrit reagiert hingegen mit der OH-Gruppe von Tyrosin zu Nitrotyrosin in einem irreversiblen Vorgang.[43] Die Blockade des Tyrosins führt zu Funktionsstörungen der Schilddrüse und damit zur Blockade der Bildung von Schilddrüsenhormonen. Bei vielen chronischen, entzündlichen Erkrankungen wie Arteriosklerose, multiple Sklerose, amyotropische Lateralsklerose oder Morbus Parkinson sind die Nitro- und Nitrotyrosinkonzentrationen erhöht. Auch Melatonin wird nitrosiert.[44] Ferner oxidiert Peroxynitrit SH-Gruppen von Enzymen.[45] Durch den aktivierten NMDA-Rezeptor und die dadurch induzierte iNOS kommt es somit im Gehirn zur verstärkten Bildung von Peroxynitrit mit der damit verbundenen Nitrierung von Tyrosin und Oxidation von SH-Gruppen in Proteinen.[3]:90 Ein Beispiel hierfür wäre die Glutathion-S-Transferase, deren aktives Zentrum durch Nitrierung des Tyrosins gehemmt wird.[46] Folglich können Entgiftungsreaktionen nur noch vermindert stattfinden. Ferner werden Enzyme zur Biosynthese von Dopamin und Serotonin, die Tyrosinhydroxylase und die Tryptophanhydroxylase gehemmt.[47] Der so entstandene Mangel an Dopamin und Serotonin verursacht Leitsymptome von MCS und CFS, wie z. B. Depression und chronische Erschöpfung. Der durch die gehemmte Serotoninsynthese verursachte Mangel an Melatonin führt zu Schlafstörungen.[3]:90
Peroxynitrit hat eine zentrale Funktion bei etlichen zellschädigenden Prozessen bei akuten und chronischen Krankheiten wie Schlaganfall, Myokardinfarkt, chronische Herzinsuffizienz, Diabetes, Krebs, neurodegenerative Krankheiten und chronische Entzündungskrankheiten.[48] Es oxidiert wichtige Substanzen des Stoffwechsels, wie Vitamin C, Glutathion, ungesättigte Fettsäuren, Cholesterin, Tocopherol, Lycopin, Coenzym Q10, wodurch diese unwirksam werden. Dies führt zum oxidativen Stress.[3]:90
Die Bindung von Glutamat an den NMDA-Rezeptor verstärkt die Bildung von ROS, Stickstoffmonoxid, Peroxynitrit und schädigt die Zellmembran durch Lipid-Peroxidation, was zur Auslösung der Apoptose führt.[49] Die Folge sind Funktionsstörungen im Gehirn, Muskulatur, der Retina der Augen, Darmschleimhaut und Immunsystem.[3]:90 Wenn sich das Gehirn noch im Stadium der Entwicklung und Differenzierung befindet, wird die Ausreifung der Nervenzellen sowie deren Wachstum gehemmt. Dies kann zur permanenten Beeinträchtigungen der geistigen Leistungsfähigkeit bei Kindern führen.[3]:91
Sowohl Stickstoffmonoxid als auch Peroxynitrit hemmen in den Mitochondrien den Atmungsstoffwechsel und Energiehaushalt.[50] Stickstoffmonoxid hemmt die Eisen-Schwefel-Zentren der Komplexe I, II und IV der Atmungskette und dadurch deren Funktion beim Elektronentransport.[51] Durch den so entstandenen Mangel an Adenosintriphosphat kommt es zum „Energiemangelsyndrom“ respektive „Mitochondrienkrankheit“, da ATP-abhängige Ionenpumpen (z. B. Na-K-ATPase) der Nervenzellen nur noch eingeschränkt arbeiten können oder gar vollständig gehemmt sind.[52] Auch kann es zu Weiterleitungsstörungen von Nervenerregungen entlang der Axonfasern kommen. Daraus resultieren die Symptome der peripheren und zentralen Polyneuropathie und Enzephalopathie.[3]:90
Das Energiemangelsyndrom selbst zeigt sich in Symptomen wie extremer Müdigkeit, kurzzeitiger, komaartiker Tiefschlaf nach den Mahlzeiten in Verbindung mit unkontrolliertem Speichelfluss und starkem Schnarchen, schnelle Erschöpfung bei geistig-körperlicher Betätigung sowie Muskelschwäche mit Lactazidose. Das Syndrom kennzeichnet sich durch eine aerob verlaufende Glykolyse: Durch Schädigung der mitochondrialen Enzyme kann der von der Glukose abgespaltete Wasserstoff nicht mehr oxidiert werden. Das Elektron wird daher ohne Beteiligung von NADH direkt auf Sauerstoff übertragen, sodass vermehrt Sauerstoffradikale und Superoxide entstehen. Dies führt zu genotoxischen und entzündungsauslösenden Reaktionen wie Radikalkettenreaktionen mit ungesättigten Fettsäuren der Membran (Lipidperoxidation).[3]:92 Parkinson und Chorea Huntington sind typische Vertreter von Erkrankungen infolge des Energiemangelsyndroms.[53]
Pestizide vom Typ organischer Phosphorsäureester (Organophosphate) haben eine neurotoxische Wirkung[54] und hemmen im Nervensystem und Gehirn das Enzym Acetylcholinesterase. Dadurch wird der Neurotransmitter Acetylcholin nicht mehr abgebaut, sodass Acetylcholin verstärkt muscarinische und nicotinische Rezeptoren im Nervensystem und Gehirn aktiviert. Somit kommt es zur gesteigerten Glutamatausschüttung und der NMDA-Rezeptor-Aktivierung.[3]:99 Organophosphate sind außerdem in Weichmachen, Flammschutzmittel, oder Baustoffen aus Kunststoff wie Schallschutz- und Wärmedämmplatten, in Polster- und Montageschäumen sowie in elektronischen Geräten enthalten. Durch diese breite Anwendung gelangen die Schadstoffe in die Luft von Innenräumen, reichern sich im Hausstaub an und gelangen von dort schließlich in den menschlichen Organismus.[3]:100
Pestizide der Gruppe der Pyrethroide greifen an den Natriumionenkanälen in Membranen von Nervenzellen im Gehirn an, die ebenfalls den NMDA-Rezeptor tragen. Nach einer erfolgten Erregung der Zelle verlangsamen sie das Schließen der Natriumkanäle, sodass es zur Verstärkung der NMDA-Rezeptoren kommt.[55]
GABA-Rezeptoren
Nervengifte, insbesondere chlorierte Kohlenwasserstoffinsektizide wie Hexachlorcyclohexan, Lindan, Chlordan, Deildrin, Aldrin und Toxaphen, aber auch verschiedene Wirkstoffe sorgen für eine nicht-kompetitive Hemmung an den GABAa-Rezeptoren.[56][57][58] Bei wiederholter Exposition in niedrigen Konzentrationen können neurotoxische Insektizide wie Endosulfan, Chlordimeform, Amitraz, Chlorpyrifos und Lindan epilepsieähnliche Anfälle auslösen. Mit jeder Exposition sinkt die Konzentratsionsschwelle eines erneuten Anfalls.[3]:102 Durch Gabe von NMDA-Antagonisten kann dies vermindert oder ganz verhindert werden.[3]:103
Durch Bindung an die Picrotoxin-Bindungsstelle des GABA-Rezeptors durch Pestizide wie Lindan oder Dieldrin kommt es zum Chlorideinstrom und dadurch zur Funktionshemmung des GABA-Rezeptors.[59][57] Durch Hemmung der GABA-Rezeptoren ist die Regulation der Nervenaktivität durch negative Rückkopplung blockiert, sodass es zu einer gesteigerten Nervenaktivität und somit zur Glutamat-Ausschüttung kommt.[3]:102
Chemische Entzündung
Bei Exposition MCS-erkrankter Personen mit Chemikalien - insbesondere Duftstoffe - schütten basophile Granulozyten erhöhte Mengen an Histamin aus.[3]:109 Die basophilen Granulozyten besitzen die oben erwähnten TRPV1-Rezeptoren sowie weitere TRP-Rezeptoren.[60]
Des Weiteren entwickelten MCS-Erkrankte nach Exposition mit flüchtigen Chemikalien Symptome einer starken Rhinitis, also Schnupfen mit erhöhter Schleimsekretion. In dieser Nasenspülflüssigkeit konnte hierbei, im Gegensatz zu gesunden Probanden, Histamin und einige Entzündungsmarker wie Zytokine, Interferone und Stickstoffmonoxid nachgewiesen werden.[61][62][63] Vergleichbare Reaktionen konnten in Zellkulturen durch Exposition mit Substanzen von Pilzen und Mikroorganismen aufgezeigt werden.[64]
Reaktive Sauerstoffspezies (ROS)
Reaktive Sauerstoffspezies können durch Einwirkung von Fremd- und Schadstoffen entstehen. So gibt es etwa einen Zusammenhang der Wirkung von 7,12-Dimethylbenzo(a)anthracen und einer Erhöhung der ROS in Ratten-Follikelzellen, bevor diese zur Apoptose übergehen. Eine Zugabe von Glutathion kann die Apoptose in den Zellkulturen verhindern.[65]
Im Lungengewebe kann Feinstaub die Bildung von reaktiven Sauerstoffspezies verursachen; insbesondere eine Inhalation von schwermetallhaltigem Staub führt, im Vergleich zur Kontrollgruppe, zu einer signifikant erhöhten Sauerstoffradikalbildung in den Immunzellen der Lunge.[66][67][68] An der Oberfläche der Partikel gebundene Stoffe, wie etwa Chinone, können den oxidativen Stress weiter fördern.[69] In Tierversuchen mit Ratten konnten diese Feinstaubpartikel in Leber, Herz und Gehirn nachgewiesen werden.[70] Durch die Wirkung der Cyclooxigenasen infolge der Einwirkung von Feinstaub, wie etwa Dieselruß- oder Kohlenstoffpartikel, entstehen schließlich reaktive Sauerstoffspezies.[71] Dies geschieht durch die Aktivierung des Gens für die Cyclooxigenasen-2 in Makrophagen im Gewebe der Lungenbläschen. Die vermehrt gebildete ROS verstärkt nun über den Induktionsfaktor NF-κB Entzündungsreaktionen in der Lunge.[72]
Im Immunsystem liegt die physiologische Funktion der ROS darin, Krankheitserreger abzutöten und über NF-κB eine Entzündung auszulösen. Ist die Entzündung allerdings chronisch, greifen ROS Zellen und Gewebe des eigenen Körpers an.[56]
In Tiermodellen konnte gezeigt werden, dass eine Reduktion der ROS zu einem Rückgang von 8-Hydroxyguanin, einem Indikator für die oxidative Schädigung der DNS, geführt hat. Ferner gab es, im Vergleich zur Kontrollgruppe, weniger Herzschäden oder arteriosklerotische Gefäßveränderungen – auch in fortgeschrittenem Alter.[73][74]
Durch Oxidation von SH-Gruppen unter Einwirkung von ROS lagern sich Membranproteine zusammen. Auf Grund der nun vorhandenen kovalenten Disulfidbrücken sind die Membranproteine in ihrer Beweglichkeit eingeschränkt.[75] Die Lipidmoleküle der Doppellipidschicht besitzen nun eine weniger geordnete Anordnung[76], sodass die Membran für Ionen wie Wasserstoff oder Kalium durchlässiger ist.[3]:117
Durch ROS induzierte NO-Synthasen bilden vermehrt Stickstoffmonoxid und dieses wiederum, zusammen mit ROS, Peroxinitrit. Peroxinitrit löst die Ketterreaktion der Lipidperoxidation aus. Dieser Vorgang wird als nitrosativer Stress bezeichnet.[3]:113 Neben Peroxinitrit sind weitere Sauerstoffradikalbildner wie Adriamycin, Paraquat, Nitrofurantoin oder Paracetamol Auslöser der Lipidperoxidation. Bei der Metabolisierung von Paracetamol zu N-Acetyl-p-benzochinonimin wird das Superoxidanion •O2− gebildet; bei der Metabolisierung von Tetrachlormethan wird das Trichlormethyl-Radikal (•CCl2) oder das Trichlormethyl-Peroxyradikal (CCl2OO•) gebildet.[3]:117
Die Lipidperoxidation kann insbesondere im Gehirn großen Schaden anrichten. Dies liegt daran, dass das Gehirn eine relativ geringe antioxidative Kapazität[77] sowie einen hohen Sauerstoffbedarf hat. Dieser Bedarf geht mit einer höheren Produktion von Sauerstoffradikalen in den Mitochondrien einher.[3]:118 Besonderes anfällig für die Lipidperoxidation sind die in den Membranen der Nervenzellen des Gehirns vorliegenden mehrfach ungesättigten Fettsäuren.[78] Sollte dieser Mechanismus des oxidativen Stresses nicht mehr mit Glutathion unterbunden werden, trägt dies zu degenerativen Prozessen bei, was letzendes zu Demenz und Alzheimer führen kann.[77]
Eine Proteindomäne des p66Shc-Proteins produziert unter Zuhilfenahme von Kupfer Wasserstoffperoxid. Außerdem verbinden sich bei zellulärem Stress vier p66Shc-Moleküle über Cystein-Cystein-Wechselwirkungen zu einem stabilen Komplex, welcher für ein Zerplatzen der Mitochondrien sorgt und damit die Apoptose auslöst. Sowohl Glutathion, als auch Thioredoxin, können die Aktivität von p66Shc hemmen.[79]
Die Apoptose einer Nervenzelle im Gehirn sorgt zudem für die Apoptose der präsynaptischen (vorangeschalteten) Nervenzelle. Die Ursache hierfür besteht darin, dass die lebenserhaltende Rückwirkung der postsynaptischen Zelle auf die präsynaptische durch Wachstumshormone nicht mehr gegeben ist.[38] Infolgedessen breiten sich Degenerationsprozesse weit über die einst betroffene Zelle aus.[3]:133
Im menschlichen Organismus gibt es ein empfindliches Verhältnis zwischen reduzierenden und oxidierenden Substanzen. Durch oxidativen Stress wird dieses Redoxgleichgewicht in Richtung Oxidation verschoben, was zu einer Umsteuerung in Richtung pathogener Vorgänge führt. Durch ein Übermaß an oxidierenden Substanzen lagern sich etwa Lymphozyten leichter an die Endothelzellen der Blutgefäße an und fördern dort entzündungsauslösende Vorgänge.[3]:115 Das zelluläre Redoxpotential verschiebt sich von etwa −0,24 V an der Mitochondrienmembran hin zu positiven Werten. Der Wert im mit Sauerstoff gesättigten Blutplasma beträgt 0,22 V. Auf Grund des engen Zusammenhanges mit Entzündungen wird dies auch als Entzündungssyndrom bezeichnet.[3]:118
Um den Mangel an reduzierende SH-Gruppen wie in Cystein oder Glutathion auszugleichen, versucht der Zellstoffwechsel den Cysteinmangel durch Neusynthese aus Methionin auszugleichen. Da jedoch die Mitochondrienfunktion gestört ist, gibt es zu wenig NADH, sodass Methyl-Tetrahydrofolsäure nicht aus Folsäure regeneriert werden kann. Durch den Mangel an Methyl-Tetrahydrofolsäure kann Homocystein nicht zu Methionin umgewandelt werden; es kommt zur Anreicherung von Homocystein und ist damit ein Kennzeichen für chronisch entzündliche Prozesse, respektive oxidativen Stress.[80]
ROS gelten als Auslöser für die Bildung von Faktoren wie den Hitzeschockproteinen. Schad- und Fremdstoffe induzieren die HSP-Gruppe 60/65, die normalerweise als Schutzsystem gegen physikalische und chemische Stressreize fungieren.[3]:131 In mononukleären Zellen des peripheren Blutes von MCS-Patienten konnte eine starke Steigerung der HSP-60-Expression nachgewiesen werden.[81]
NF-κB und Zytokine
Oxidativer und nitrosativer Stress, insbesondere ROS, aktivieren den Transkriptionsfaktor NF-κB, wodurch zahlreiche Entzündungsmechanismen in Gang gesetzt werden. In Tierversuchen konnte nachgewiesen werden, dass – nach 6-stündiger Verabreichung von Kohlenstaub mit der Konzentration 300 µg/m³ über die Atemluft – der oxidative Stress gestiegen war und die Wanderung der NF-κB-Untereinheiten B50 und B65 in den Zellkern begonnen hat. Diese Untereinheiten sorgen für eine erhöhte Synthese der mRNA an den Stellen der DNS, die für entzündungsfördernde Zytokine (Interferon-γ, TNF-α, Interleukin-6) codieren.[82]
Die Synthese von NF-κB ist in den Zellen des Immunsystems bei MCS-Patienten im Vergleich zu Kontrollpersonen bis zu 10-mal höher.[83] Zudem beleibt NF-κB auf Grund der ROS permanent aktiv, was zu einem Übermaß proinflammatorischer Zytokine führt.[3]:121 Interferon-γ-Wete sind bei MCS-Patienten bereits vor einer Provokationsbelastung erhöht; bei Exposition kommt es zum weiteren Anstieg. Die Sekretion von Interleukin-10 durch periphere Lymphozyten ist hingegen sowohl vor, als auch nach einer Provokationsbelastung um mehr als die Hälfte vermindert. Interleukin-10 vermindert normalerweise mittels negativer Rückkopplung die Entzündungsreaktionen.[3]:124
Diagnostik
Allgemeines
Die umweltmedizinische Diagnostik besteht aus folgenden drei Abschnitten:
1. Umweltmedizinische Sozialanamnese
Hierbei wird das gesamte Umfeld des Patienten in Bezug auf Schadstoff-Exposition näher betrachtet. Dazu gehört das Wohn-, Arbeits bzw. Ausbildungsumfeld, Zahnwerkstoffe im Dentalbereich (auch Implantate und Wurzelfüllmaterialien), Genussmittelkonsum (Rauchen, Alkohol), Ernährungsgewohnheiten, Freizeitverhalten bzw. Sport/körperliche Betätigung und sonstige Faktoren wie soziale Verhältnisse, Einkommen, Familie oder mögliche Stressfaktoren.[3]:252
2. Ausschlussdiagnostik
Symptome, welche eine andere als umweltbedingte Ursache haben, müssen von entsprechenden Fachärzten (z. B. Internisten, Neurologen, Psychiater, Kardiologen, HNO-Ärzte, Urologen etc.) untersucht werden. Erst wenn Umweltfaktoren als Ursache nicht ausgeschlossen werden können, erfolgt die umweltmedizinische Labordiagnostik; zur Beurteilung des gesamten Krankheitsbildes sind die Ergebnisse anderer medizinischer Fachrichtungen dennoch wichtig und erforderlich.[3]:252/253
3. Umweltmedizinisches Monitoring und Labordiagnostik
Dieser Punkt wird in mehrere Teilbereiche untergliedert:[3]:253–256
- äußere Belastung: Analytik/Umweltmonitoring; qualitativer und quantitativer Nachweis von Schadstoffen im Umfeld des Patienten
- innere Belastung: Analytik/Biomonitoring: Nachweis von Fremd- und Schadstoffen samt deren Metaboliten in Körperproben des Patienten (Blut, Serum, Speichel, Urin, Haare, Fettgewebe etc.)
Leider liefert das Biomonitoring häufig keine aussagekräftige Ergebnisse. Dafür gibt es mehrere Gründe:- Metabolite sind oft nur wenige Tage nach Exposition nachweisbar. Daher wird versucht, chemisch veränderte Proteine nachzuweisen, was auch noch Monate nach einer Exposition möglich ist. Eine länger zurückliegende Exposition kann nicht mehr erfasst werden.
- Fettlösliche Stoffe können sich im Fettgewebe und/oder Gehirn zu hohen Konzentrationen anreichern, ohne im Blut oder Urin nachweisbar zu sein
- Für viele Schadstoffe (z. B. etwa 50 % der Pestizide, die in der Landwirtschaft genutzt werden) gibt es noch keine Analyseverfahren. Aufgrund des fehlenden Nachweises kann hierbei statt MCS fälschlicherweise eine psychische Erkrankung diagnostiziert werden.
- Auch ohne Überschreitung toxikologischer Grenz- und Richtwerte kann eine chronische Exposition der Schadstoffe zu nachhaltigen Störungen funktioneller Regelkreise führen.
- Aus diesen Gründen sollte - sofern begründeter Verdacht auf eine chronische Langzeiteinwirkung von Chemikalien besteht - dem Effektmonitoring Vorrang gewährt werden.
- biologisches Effektmonitoring: Nachweis von Auswirkungen bzw. den Effekten von Schadstoffen auf den Patienten
Dazu gehören physiologische, immunologische, neurologische, endokrine oder metabolische Veränderungen wie z. B. Antikörper, Veränderung des Hormonhaushaltes, sensibilisierte Lymphozyten, Änderung im peripheren und zentralen Nervensystem, systemisch entzündliche Reaktionen samt deren Marker (Zytokine), immunologische Sensibilisierung Typ I und Typ IV - Suszeptibilitäts-Monitoring: Mittels biochemischer Labordiagnostik kann die individuelle Empfindlichkeit gegenüber Umweltfaktoren ermittelt werden. Dazu zählen unter anderem genetische Polymorphismen für Enzyme der Phase I und II des Entgiftungssystems (Cytochrom-P450-Monooxygenasen, Glutathiontransferasen, N-Acetyl-Transferasen, Catechol-O-Methyltransferasen, UDP-Glucuronosyltransferasen und Superoxiddismutase[84]).
Der Nachweis von Störungen der Blut-Hirn-Schranke ist ebenfalls hier einzuordnen.
Provokationstests
Bei den Provokationstests werden Patienten einer niedrigen Chemikalien-Exposition ausgesetzt und mit nicht sensibilisierten Kontrollprobanden verglichen. Alternativ misst man Neuropeptide und Zytokine, die infolge einer Chemikalieneinwirkung im Blut nachweisbar sind. Bei betroffenen Patienten ist der Blutwert signifikant höher als bei den Kontrollpersonen. So zeigt sich beispielsweise bei flüchtigen organischen Verbindungen eine Erhöhung der Serum-Konzentration der Entzündungsmarker Substanz P, vasoaktives intestinales Peptid, Nerven-Wachstumsfaktor und Histamin.[85]
Die Vorgehensweise dieser Testart ist jedoch aus medizinethischer Sicht kritisch zu betrachten, da hierbei den Teilnehmern der Untersuchung Schaden hinzugefügt werden muss.[3]:256
Immunologische In-vitro-Testsysteme
Gegenüber den Provokationstests haben diese Testsystem den Vorteil, dass man die Reaktion von Zellen des Immunsystems analysieren kann, ohne den Patienten selbst den Schadstoffen aussetzen zu müssen. Es gibt verschiedene Arten von Tests, den Immuntoleranztest (ITT) und den Lymphozytentransformationstest (LTT).[3]:256/257
Beim Immuntoleranztest wird die Reaktion der Immunzellen eines Patienten auf diverse Stressoren getestet, indem man sie einem Schadstoffgemisch als Marker sowie einem Influenza-Virus-Antigen als Kontrolle aussetzt und die dadurch freigesetzte Menge an Zytokinen Il-2, IFN-𝛾, Il-10, TNF-𝞪 und IL-1β. MCS-Patienten weißen hierbei einen signifikanten Anstieg von IFN-𝛾 und/oder TNF-𝞪 auf. Der ITT eignet sich somit als Basistest zur Erkennung einer Immunregulationsstörung. Ebenso kann MCS von CFS abgegrenzt werden: Bei MCS liegt eine hohe Konzentration an IFN-𝛾 sowie eine geringe an Il-2; bei CFS genau umgekehrt.[3]:257
Zur Differentialdiagnostik wird der Lymphozytentransformationstest empfohlen. Zeigen sich im ITT und LTT auf eine bestimmte Chemikalie positive Ergebnisse, ist von einer chronisch-allergischen Typ-IV-Sensibilisierung auszugehen. Sollte jedoch nur der ITT positiv, liegt MCS als Erkrankung vor.[3]:257
Stufendiagnostik und Immunstatus
Durch Anwendung der Stufendiagnostik kann mittels klinisch-internistischen sowie Entzündungsparametern MCS gegenüber verschiedenen Allergien und Infektionskrankheiten abgegrenzt werden. Die Stufen umfassen:
- Stufe: Differentialblutbild, Blutkörperchen-Senkungsgeschwindigkeit, Immunelektrophorese der Serum-Eiweiße, quantitative Immunglobuline mit IgE und Urinstatus
- Stufe: C-reaktives Protein (CRP), Malondialdehyd, Homocystein, IgG-Subklassen und TNF-𝞪
- Stufe: LTT, ITT, Zytokine, Autoantikörper und Neopterin
- Stufe: Weitere Teste zur genaueren Abklärung, siehe: Klinische Labordiagnostik
Stufen 1 und 2 dienen zur Differenzierung zwischen akuter und chronischer Entzündung sowie bakterielle oder virale Infektion. Bei Verdacht auf eine entsprechende Infektion sind Bakterien bzw. Virusspezifische Erregernachweise durchzuführen. Stufe 3 grenzt das umweltmedizinische Krankheitsbild ein.[3]:259
Die oben genannten Laborparameter können im Rahmen eines Immunstatus ermittelt werden; die Untersuchung kann in unterschiedlich großem Umfang erfolgen. Beispiele hierfür sind: Immunphänotypisierung der T-Zell-Unterklassen CD4-TH1 und CD4-TH2, Verhältnis der CD4-T-Helferzellen zu den zytotoxischen CD8-T-Zellen bzw. der CD4/CD8-Quotient, Anzahl/Konzentration der NK- und B-Zellen, Bestimmung der Aktivierungsmarker auf den T-Lymphozyten (CD25, CD29, CD69, CD71, HLA-DR) für Erkenntnisse zum Aktivierungszustand des zellulären Immunsystems, Bestimmung der regulatorischen T-Zellen zur Erkennung eines überaktiven Immunsystems, Bestimmung des Zytokinmusters im Serum oder IgE-Bestimmungen zum Ausschluss einer Typ-1-Sensibilisierung.[3]:259/260
Zum Immunstatus werden folgende immunologischen Test empfohlen: Bestimmung des Verhältnisses von immunologisch geprägten CD4-Gedächtniszellen zu naiven CD4-Helferzellen sowie der CD8-Effektorzellen zu nativen CD8-Zellproduktion. Beide Quotienten steigen bei chronisch-entzündlichen Multisystemerkrankungen auf das 1,5-fache des Normwertes. Des Weiteren sollte der Anteil nicht mehr teilungsfähiger T8-Lymphozyten mit dem Oberflächenantigen CD57 im Verhältnis zur Gesamtzahl der T8-Lymphozyten bestimmt werden. Diese Zellen können nach spezifischer Aktivierung die Apoptose auslösen, sind Anzeichen für eine chronische Aktivierung des Immunsystems und zeigen das Endstadium degenerativer Erkrankungen an.[3]:261
Klinische Labordiagnostik
Es gibt verschiedene Marker für MCS und andere umweltbedingte Erkrankungen. Im Folgenden werden die zu bestimmenden Parameter eingeteilt in Entgiftungskapazität, Belastungsparameter, Parameter für oxidativen und nitrosativen Stress, antioxidative Kapazität und Stresshormon-Status.
- Entgiftungskapazität:[3]:263 Gehalt des reduzierten Glutathions, Superoxid-Dismutase, Glutathion-Peroxidase, Glutathion-S-Transferase in Erythrozyten, Coffein-Speicheltest
- Belastungsparameter:[3]:264/265 Hitzeschock-Protein HSP60 (bei MCS-Patienten erhöht), Mercaptursäuren, NF-kB-Aktivierung, 37 kDa RNase-L-Protein, Stress-Status s. u., Homocystein, Neopterin. Substanz P, Nerven-Wachstumsfaktor und das vasoaktive intestinale Peptid sind bei Patienten mit chronischem MCS permanent erhöht. Bei Provokation mit VOC-Substanzen kommt es im Vergleich zu Allergie-Patienten zu einer signifikanten Steigerung.
- Parameter für oxidativen und nitrosativen Stress:[3]:265/266 Bestimmung von NO und Peroxynitrit sowie der Aktivität und Enzymkonzentration der nNOS und iNOS (NO-Synthasen), 8-Hydroxy-2-Desoxyguanosin, intrazelluläres Adenosintriphosphat, Bestimmung des S100-Hirnschrankenproteins, des Lactat/Pyruvat-Verhältnisses, des zellulären Redoxpotenzials und der oxidativen Belastung bzw. der Antioxidantienstatus sowie Malondialdehyd (im Urin) samt 3-Nitrotyrosin, Nitrophenylessigsäure, Citrullin und Methylmalonsäure
- Parameter der antioxidativen Kapazität:[3]:266/267 Vitamin E, Vitamin C, beta-Carotin, Coenzym Q10, Selen. Diese antioxidativ wirksamen Vitamine oder Enzymbestandteile dienen als Radikalfänger oder Reduktionsmittel, um Sauerstoffradikalverbindungen (ROS) zu entgiften. Bei chronischen Umwelterkrankungen sind diese Parameter meist erniedrigt.
- Stresshormon-Status:[3]:267 Cortisol-Tagesprofil (Morgen-Peak fehlt bei chronischen Multisystem- und CFS-Erkrankten), Melatonin-Tages- und Nachtprofil (nächtliche Peak fehlt bei Erkrankten), Dehydroepiandrosteron
Bildgebende Verfahren
Bildgebende Verfahren dienen der Ermittlung von Funktionsstörungen des Gehirns bzw. funktionaler Hirnzentren. Einzelphotonen-Emissionscomputertomographie (SPECT) und Positronen-Emissions-Tomographie (PET) sind in der Umweltmedizin zwei weit verbreitete Methoden. Mittels SPECT konnte aufgezeigt werden, dass eine Exposition gegenüber Formaldehyd, Lösungsmitteln, Pentachlorphenon, Organophosphat-Pestiziden und Quecksilber eine Schädigung dopaminerger D2-Rezeptoren der Basalganglien zur Folge hat. Dies wiederum führt zu Einschränkungen des prozeduralen Gedächtnisses, der motorischen Koordination sowie der Feinmotorik.[3]:268
Psychologische Testverfahren
Psychologische und psychometrische Testverfahren und Befragungsbögen können Auskunft über Störungen von Hirnfunktionen geben. Beispiel hierfür wäre der Chemical Odor Sensitivity Scale, auch COSS-Test genannt.[3]:269
Therapie
Die wirksamste Behandlungsmethode ist die Expositionskarenz.[3]:350 Sofern eine ausreichende Aufnahme von Glutathion, Vitamin E, Vitamin C, α-Li-ponsäure, Riboflavin, Pyridoxin, Folsäure, Coenzym Q10, langkettigen Omega-3-Fettsäuren, Curcumin, Vitamin B12, Vitamin D durch eine ausgewogene Ernährung nicht garantiert werden kann, sollte die antioxidative Therapie mittels Substitution angestrebt werden.[3]:351–363[86] Da es sich bei den Substanzen meist um Nahrungsergänzungsmittel handelt, werden die Kosten hierfür von den gesetzlichen Krankenversicherungen nicht übernommen.[87] Es gibt hierbei jedoch zugelassene Ausnahmen zum gesetzlichen Verordnungsausschluss, welche in Anlage I der Arzneimittel-Richtlinie (OTC-Übersicht) aufgelistet werden.[88]
Private Krankenversicherungen müssen hingegen, gemäß einem Urteil des OLG Frankfurt, die Kosten der orthomolekularen Therapie übernehmen bzw. sich daran beteiligen.[89] Die Therapieform gelte als alternative Behandlungsmethode und sei folglich eine medizinisch notwendige Heilbehandlung.[89]
Bei Amalgamfüllungen in Zähnen oder ähnlicher Schwermetallbelastung sollte die Quelle beseitigt und mit einer Chelattherapie (mit DMSA, DMPS, Tiopronin o. Ä.) begonnen werden.[90]
Allgemein wird weiterhin eine verständnisvolle und unterstützende Behandlungsweise empfohlen. Psychologisch-psychiatrische Therapieansätze eignen sich bei psychischen Folgeerkrankungen. Patienten bewerteten eine stützende psychotherapeutische Behandlung dann als wirksam, wenn sie die Vermittlung von Bewältigungsstrategien zum Ziel haben. Als „eher schädigend“ wird aufgrund von Intoleranzreaktionen die Einnahme von Psychopharmaka beschrieben. Für die Patienten steht oft die Informationsvermittlung als Hilfe zum „Coping“ sowie die Vermittlung verträglicher Therapien für Begleiterkrankungen und eine verträgliche Ernährung im Vordergrund.
Studien zum Nachweis der Wirksamkeit alleiniger Psychotherapie stehen bisher aus.[91][92][93]
Folgen
Im fortgeschrittenen Stadium führt MCS zur völligen Arbeitsunfähigkeit sowie zum weitgehend vollständigem Verlust sämtlicher Lebensqualität. Der Krankheitsverlauf ist chronisch und geht oft mit Intoleranzen gegenüber Nahrungsmitteln und Medikamenten einher. Zum einen führt dies zu Fehl-/Mangelernährung, zum anderen können dadurch Begleiterkrankungen ggf. nicht richtig behandelt werden. Dies kann zu Missbrauch von Schmerztabletten und schließlich zur Medikamentenabhängigkeit führen.
MCS führt, auf Grund von entgegengebrachtem Unverständnis, in der Familie, im Freundeskreis oder am Arbeitsplatz zu Konflikten, in schwersten Formen zu sozialer Isolation.
In den USA ist MCS seit 1992 und in Deutschland seit 1996 als Behinderung anerkannt.[94] Leichte Formen von MCS sind mit mindestens GdB 50 einzustufen; schwere Verlaufsformen mit Gdb bis zu 100.[95]
Geschichte
Nachdem in den 1980er und 1990er Jahren polarisiert darüber diskutiert worden war, ob die MCS der Toxikologie oder der Psychosomatik zuzuordnen sei, setzte sich damals ein multifaktorielles Störungsmodell durch, welches Aspekte beider Felder in einem „bio-psycho-sozialen“ Modell berücksichtigt. Hier halfen insbesondere Studien weiter, in denen die Risikofaktoren der MCS in ihrer frühen Form untersucht wurden. Die voll ausgeprägte MCS zieht eine Vielzahl an Problemen nach sich, die eine Verzerrung von Studienergebnissen bewirkt.[21][96][97]
Zur Abgrenzung von MCS gegenüber psychosomatischen Störungen galten bis 1993 die von Cullen 1987 festgelegten Kriterien[98][99]:
- Die Störung tritt im Zusammenhang mit einer dokumentierbaren Umweltexposition, Verletzung oder Krankheit auf,
- die Symptome betreffen mehr als ein Organsystem,
- Symptome treten als Reaktion auf vorhersagbare (Umwelt-)Reize auf und lassen wieder nach,
- Symptome werden durch Exposition gegenüber Chemikalien unterschiedlicher Strukturklassen und toxikologischer Wirkmechanismen hervorgerufen,
- Symptome werden durch nachweisbare Expositionen ausgelöst (wenn auch auf niedrigem Niveau),
- Expositionen, die Symptome hervorrufen, müssen sehr niedrig sein, d. h. weit unterhalb der durchschnittlichen Expositionsmenge, von der bekannt ist, dass sie beim Menschen eine schädliche Wirkung hat
- Kein allgemein akzeptierter labormedizinischer Test der Organfunktion kann die Symptome erklären [bis dato, 1987]
Einige Autoren, welche eine psychische Genese der MCS vermuten, schlugen die Bezeichnung „idiopathic environmental intolerances“ (IEI), „idiopathische (d. h. ohne erkennbare Ursache entstandene), umweltbezogene Unverträglichkeiten“ vor. Dieser Begriff umfasse über die bisher MCS zugeordneten Symptome hinaus eine Reihe ähnlicher gesundheitlicher Störungen und vermeide eine Festlegung bezüglich der vermuteten Ursache, die durch den wissenschaftlichen Kenntnisstand nicht gerechtfertigt sei.[92]
Literatur
- S. M. Caress, A. C. Steinemann, C. Waddick: Symptomatology and etiology of multiple chemical sensitivities in the southeastern United States. In: Archives of Environmental and Occupational Health. (2002); 57, S. 429–436.
- Innenraumbelastungen und Sick Building Syndrom. UNI-Saarland (PDF, 1,4 MB)
- William J. Rea: Chemical Sensitivity. Volume 1–4, Lewis Publishers; Volume 1, ISBN 0-87371-541-1; Volume 2, ISBN 0-87371-963-8; Volume 3, ISBN 0-87371-964-6; Volume 4, ISBN 0-87371-965-4.
- Hans-Ulrich Hill, Wolfgang Huber, Kurt E. Müller: Multiple Chemikalien-Sensitivität (MCS). Ein Krankheitsbild der chronischen Multisystemerkrankungen (CMI). Umweltmedizinische, toxikologische und sozialpolitische Aspekte – Ein Blick auf den aktuellen Forschungsstand. 3. Auflage. Shaker, Aachen 2010, ISBN 978-3-8322-9046-7.
- A. L. Davidoff, P. M. Keyl, W. Meggs: Development of multiple chemical sensitivities in laborers after acute gasoline fume exposure in an underground tunneling operation. In: Archives of Environmental and Occupational Health. (1998); 53, S. 183–189.
- S. Reid, M. Hotopf, L. Hull, K. Ismail, C. Unwin, S. Wessely: Multiple Chemical Sensitivity and Chronic Fatigue Syndrome in British Gulf War Veterans. In: American Journal of Epidemiology. (2001); 153, S. 604–609.
- Stellungnahme des Vorstandes des dbu („Deutscher Berufsverband der Umweltmediziner“) zur MCS-Multicenter-Studie, Auszug online auf der Website des UMG Verlages
- Martin L. Pall: Explaining „Unexplained Illnesses“. Disease Paradigm for Chronic Fatigue Syndrome, Multiple Chemical Sensitivity, Fibromyalgia, Post-Traumatic Stress Disorder, Gulf War Syndrome, and Others. Harrington Park Press/Haworth Press, New York/ London 2007, ISBN 978-0-7890-2388-9.
- R. Kreutzer, R. R. Neutra, N. Lashuay: Prevalence of people reporting sensitivities to chemicals in a population based survey. In: American Journal of Epidemiology. (1999); 150, S. 1–12.
- A. Bauer, E. Schwarz, C. Mai: Multiple Chemical Sensitivity (MCS): Ein Update. In: Umwelt Medizin Gesellschaft. 2008, 21(4), S. 9–15 (online (Memento vom 3. Dezember 2013 im Internet Archive); PDF, 25 kB)
- W. J. Meggs, K. A. Dunn, R. M. Bloch u. a.: Prevalence and nature of allergy and chemical sensitivity in a general population. In: Archives of Environmental and Occupational Health. (1996); 51, S. 275–282.
- NICNAS (Australian Government Department of Health and Aging): A scientific review of multiple chemical sensitivity: Working Draft report, November 2008. Online (Memento vom 20. Januar 2010 im Internet Archive)
- N. A. Ashford, C. S. Miller: Chemical exposures. Low levels and high stakes. 2. Auflage. Van Nostrand Reinhold, New York 1998.
Einzelnachweise
- ↑ Schreiben von DIMDI bzgl. der Klassifizierung in Deutschland
- ↑ Liliane Bartha, Williarn Baumzweiger, David S. Buscher, Thomas Callender u. a.: Multiple Chemical Sensitivity: A 1999 Consensus. In: Archives of Environmental and Occupational Health. Band 54, Nr. 3, 1999, S. 147–149, doi:10.1080/00039899909602251.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb bc bd be bf bg bh bi bj bk bl bm Hans-Ulrich Hill, Wolfgang Huber, Kurt E. Müller: Multiple Chemikalien-Sensitivität (MCS). Ein Krankheitsbild der chronischen Multisystemerkrankungen (CMI). Umweltmedizinische, toxikologische und sozialpolitische Aspekte – Ein Blick auf den aktuellen Forschungsstand. 3. Auflage. Shaker, Aachen 2010, ISBN 978-3-8322-9046-7.
- ↑ Ein kurzer Überblick über den Vortrag von Prof. Dr. Martin Pall: MCS – Toxikologische Entstehungsmechanismen und therapeutische Annäherungsversuche
- ↑ Thomas Eikmann, Caroline Herr: Multiple Chemical Sensitivity Syndrome (MCS). Hessisches Zentrum für Klinische Umweltmedizin, Universitätsklinikum Gießen und Marburg ((Seite nicht mehr abrufbar, Suche in Webarchiven: PDF, 29 kB) ).
- ↑ A. Bauer, E. Schwarz, C. Mai: Multiple Chemical Sensitivity (MCS). Ein Update. In: Umwelt Medizin Gesellschaft. 2008, 21, 4, S. 9–15.
- ↑ NICNAS (Australian Governmental Department of Health and Aging): A scientific review of multiple chemical sensitivity: Working Draft report. (Memento vom 20. Januar 2010 im Internet Archive), November 2008.
- ↑ L. Andersson u. a.: Prevalence and risk factors for Chemical Sensitivity and sensory hyperreactivity in teenagers. In: International Journal of Hygiene and Environmental Health. 2008, 211, S. 690–697.
- ↑ Übersicht bei: Ashford und Miller 1998, Maschewsky 1996
- ↑ a b E. Schwarz, A. Bauer, U. Martens: Allergien, Stress und Schadstoffe als Risikofaktoren für chemische Intoleranzen und „Multiple Chemical Sensitivity“ (MCS). In: Allergo Journal. (2006); 15, S. 139–140.
- ↑ Buchwald und Garrity 1994, Kreutzer u. a. 1999.
- ↑ a b Nicholas Ashford, Claudia Miller: Chemical Exposures. John Wiley & Sons, 1998, ISBN 0-471-29240-0.
- ↑ A. L. Davidoff, L. Fogarty, P. M. Keyl: Psychiatric inferences from data on psychologic/psychiatric symptoms in multiple chemical sensitivities syndrome. In: Archives of Environmental and Occupational Health. (2000); 55, S. 165–175.
- ↑ A. Bauer, E. Schwarz, U. Martens: Patienten mit multiplen Chemikalienintoleranzen – Umweltmedizin oder Psychosomatik? In: Zeitschrift für Allgemeinmedizin (ZFA). (2007); 83, S. 442–446.
- ↑ A. Bauer, E. Schwarz, C. Mai: Environmental medicine or Psychiatry? In: International Journal of Hygiene and Environmental Health. 2009, 212, S. 569–570 doi:10.1016/j.ijheh.2008.12.004
- ↑ F. Fiedler, C. Maccia, H. Kipen: Evaluation of chemical sensitive patients. In: Journal of Occupational Medicine. (1992); 34, S. 529–538.
- ↑ Zucco G. M. u. a.: Discriminating between organic and psychological determinants of multiple chemical sensitivity: A case study. In: Neurocase. 2008; 14(6), S. 485–493. PMID 19012169.
- ↑ D. Eis u. a.: The German Multicentre Study on Multiple Chemical Sensitivity (MCS). In: International Journal of Hygiene and Environmental Health. 2008 Oct;211(5–6), S. 658–681. PMID 18502687.
- ↑ C. Hausteiner u. a.: Dysfunctional cognitions in idiopathic environmental intolerances (IEI) – an integrative psychiatric perspective. In: Toxicology Letters 2007 Jun 15;171(1–2), S. 1–9. PMID 17548174.
- ↑ A. Bauer, E. Schwarz: Welche Aussagekraft hat die MCS-Multicenterstudie? Eine Stellungnahme des Deutschen Berufsverbands der Umweltmediziner (dbu). In: Umwelt Medizin Gesellschaft. (2007); 20 (4), S. 289–296.
- ↑ a b K. Osterberg u. a.: Personality, mental distress, and subjective health complaints among persons with environmental annoyance. In: Human & Experimental Toxicology. 2007, 26, 3, S. 231–241, PMID 17439926.
- ↑ S. M. Caress, A. C. Steinemann, C. Waddick: Symptomatology and etiology of multiple chemical sensitivities in the southeastern United States. In: Archives of Environmental and Occupational Health. (2002); 57, S. 429–436.
- ↑ L. Andersson, A. Johansson, E. Millqvist, S. Nordin, M. Bende: Preva-lence and risk factors for Chemical Sensitivity and sensory hyperreactivity in teenagers. In: International Journal of Hygiene and Environmental Health. 2008, 211, S. 690–697.
- ↑ A. Johansson, E. Millqvist, S. Nordin, M. Bende: Relationship between self-reported odor intolerance and sensitivity to inhaled capsaicin: proposed definition of airway sensory hyperreactivity and estimation of its prevalence. In: Chest. 2006, 129, S. 1623–1628.
- ↑ I. R. Bell, C. M. Baldwin, L. G. Russek, G. E. Schwartz, E. E. Hardin: Early life stress, negative paternal relationships, and chemical intolerance in middle-aged women: support for a neural sensitization model. In: Journal of Women's Health. 1998, 7, 9, S. 1135–1147.
- ↑ I. R. Bell, C. S. Miller, G. E. Schwartz, J. M. Peterson, D. Amend: Neuropsychiatric and somatic characteristics of young adults with and without selfreported chemical odor intolerance and chemical sensitivity. In: Archives of Environmental and Occupational Health. 1996, 51, S. 9–21.
- ↑ J. Das-Munshi u. a.: Multiple chemical sensitivities: A systematic review of provocation studies. In: Journal of Allergy and Clinical Immunology. 2006, 118, S. 1257–1264. PMID 17137865.
- ↑ S. Bornschein u. a.: Double-blind placebo-controlled provocation study in patients with subjective Multiple Chemical Sensitivity (MCS) and matched control subjects. In: Clinical Toxicology. 2008, 46, S. 443–449. PMID 18568800.
- ↑ C. van Thriel, E. Kiesswetter, M. Schäper u. a.: From neurotoxic to chemo-sensory effects: new insights on acute solvent neurotoxicity exemplified by acute effects of 2-ethylhexanol. In: Neurotoxicology. 2007, 28, S. 347–355.
- ↑ Barbara A. Sorg, Samantha Swindell, Matthew L. Tschirgi: Repeated low level formaldehyde exposure produces enhanced fear conditioning to odor in male, but not female, rats. In: Brain Research. Band 1008, Nr. 1, Mai 2004, S. 11–19, doi:10.1016/j.brainres.2004.02.015.
- ↑ Hajime Kimata: Effect of exposure to volatile organic compounds on plasma levels of neuropeptides, nerve growth factor and histamine in patients with self-reported multiple chemical sensitivity. In: International Journal of Hygiene and Environmental Health. Band 207, Nr. 2, Januar 2004, S. 159–163, doi:10.1078/1438-4639-00262.
- ↑ Lindsey J. Macpherson, Adrienne E. Dubin, Michael J. Evans, Felix Marr, Peter G. Schultz: Noxious compounds activate TRPA1 ion channels through covalent modification of cysteines. In: Nature. Band 445, Nr. 7127, Februar 2007, ISSN 0028-0836, S. 541–545, doi:10.1038/nature05544 (nature.com [abgerufen am 1. Februar 2021]).
- ↑ C. R. McNamara, J. Mandel-Brehm, D. M. Bautista, J. Siemens, K. L. Deranian: TRPA1 mediates formalin-induced Pain. In: Proceedings of the national Academy of Sciences. Band 104, Nr. 33, 14. August 2007, ISSN 0027-8424, S. 13525–13530, doi:10.1073/pnas.0705924104, PMID 17686976, PMC 1941642 (freier Volltext).
- ↑ Sally M Bradberry, Sarah A Cage, Alex T Proudfoot, J Allister Vale: Poisoning due to Pyrethroids:. In: Toxicological Reviews. Band 24, Nr. 2, 2005, ISSN 1176-2551, S. 93–106, doi:10.2165/00139709-200524020-00003.
- ↑ William J. Meggs: Rads and Ruds the Toxic Induction of Asthma and Rhinitis. In: Journal of Toxicology: Clinical Toxicology. Band 32, Nr. 5, Januar 1994, ISSN 0731-3810, S. 487–501, doi:10.3109/15563659409011053.
- ↑ Hendrik W Steenland, Shanelle W Ko, Long-Jun Wu, Min Zhuo: Hot Receptors in the Brain. In: Molecular Pain. Band 2, 5. Juni 2006, ISSN 1744-8069, S. 1744–8069–2–34, doi:10.1186/1744-8069-2-34, PMID 17092351, PMC 1647269 (freier Volltext).
- ↑ Guangfan Zhang, Ruei-Lung Lin, Michelle Wiggers, Diane M. Snow, Lu-Yuan Lee: Altered expression of TRPV1 and sensitivity to capsaicin in pulmonary myelinated afferents following chronic airway inflammation in the rat: Increased Expression of TRPV1 in pulmonary myelinated afferents. In: The Journal of Physiology. Band 586, Nr. 23, 1. Dezember 2008, S. 5771–5786, doi:10.1113/jphysiol.2008.161042, PMID 18832423, PMC 2655410 (freier Volltext).
- ↑ a b Mark P. Mattson: Free Radicals, Calcium., and The Synaptic Plasticity-Cell Death Continuum: Emerging Roles of The Transcription Factor Nfκb. In: International Review of Neurobiology. Band 42. Elsevier, 1998, ISBN 978-0-12-366842-4, S. 103–168, doi:10.1016/s0074-7742(08)60609-1.
- ↑ Lena Hillert, Vildana Musabasic, Hans Berglund, Carolina Ciumas, Ivanka Savic: Odor processing in multiple chemical sensitivity. In: Human Brain Mapping. Band 28, Nr. 3, März 2007, S. 172–182, doi:10.1002/hbm.20266, PMID 16767766, PMC 6871299 (freier Volltext).
- ↑ A. Novelli, J.A. Reilly, P.G. Lysko, R.C. Henneberry: Glutamate becomes neurotoxic via the N-methyl-d-aspartate receptor when intracellular energy levels are reduced. In: Brain Research. Band 451, Nr. 1-2, Juni 1988, S. 205–212, doi:10.1016/0006-8993(88)90765-2.
- ↑ Martin L. Pall: NMDA sensitization and stimulation by peroxynitrite, nitric oxide, and organic solvents as the mechanism of chemical sensitivity in multiple chemical sensitivity. In: The FASEB Journal. Band 16, Nr. 11, September 2002, ISSN 0892-6638, S. 1407–1417, doi:10.1096/fj.01-0861hyp.
- ↑ Jonathan S. Stamler: Redox signaling: Nitrosylation and related target interactions of nitric oxide. In: Cell. Band 78, Nr. 6, September 1994, S. 931–936, doi:10.1016/0092-8674(94)90269-0.
- ↑ John T Groves: Peroxynitrite: reactive, invasive and enigmatic. In: Current Opinion in Chemical Biology. Band 3, Nr. 2, April 1999, S. 226–235, doi:10.1016/S1367-5931(99)80036-2.
- ↑ M.L. Pall: Elevated, sustained peroxynitrite levels as the cause of chronic fatigue syndrome. In: Medical Hypotheses. Band 54, Nr. 1, Januar 2000, S. 115–125, doi:10.1054/mehy.1998.0825.
- ↑ Donald M. Kuhn, Cheryl W. Aretha, Timothy J. Geddes: Peroxynitrite Inactivation of Tyrosine Hydroxylase: Mediation by Sulfhydryl Oxidation, not Tyrosine Nitration. In: The Journal of Neuroscience. Band 19, Nr. 23, 1. Dezember 1999, ISSN 0270-6474, S. 10289–10294, doi:10.1523/JNEUROSCI.19-23-10289.1999, PMID 10575026, PMC 6782408 (freier Volltext).
- ↑ Patrick S.-Y. Wong, Jason P. Eiserich, Sharanya Reddy, C.Leticia Lopez, Carroll E. Cross: Inactivation of Glutathione S-Transferases by Nitric Oxide-Derived Oxidants: Exploring a Role for Tyrosine Nitration. In: Archives of Biochemistry and Biophysics. Band 394, Nr. 2, Oktober 2001, S. 216–228, doi:10.1006/abbi.2001.2532.
- ↑ Donald M. Kuhn, Cheryl W. Aretha, Timothy J. Geddes: Peroxynitrite Inactivation of Tyrosine Hydroxylase: Mediation by Sulfhydryl Oxidation, not Tyrosine Nitration. In: Journal of Neuroscience. Band 19, Nr. 23, 1. Dezember 1999, ISSN 0270-6474, S. 10289–10294, doi:10.1523/JNEUROSCI.19-23-10289.1999, PMID 10575026, PMC 6782408 (freier Volltext).
- ↑ Pál Pacher, Joseph S. Beckman, Lucas Liaudet: Nitric Oxide and Peroxynitrite in Health and Disease. In: Physiological Reviews. Band 87, Nr. 1, Januar 2007, ISSN 0031-9333, S. 315–424, doi:10.1152/physrev.00029.2006, PMID 17237348, PMC 2248324 (freier Volltext).
- ↑ Mark P. Mattson: Free Radicals, Calcium., and The Synaptic Plasticity-Cell Death Continuum: Emerging Roles of The Transcription Factor Nfκb. In: International Review of Neurobiology. Band 42. Elsevier, 1998, ISBN 978-0-12-366842-4, S. 103–168, doi:10.1016/s0074-7742(08)60609-1.
- ↑ Todd B. Sherer, Jin-Ho Kim, Ranjita Betarbet, J.Timothy Greenamyre: Subcutaneous Rotenone Exposure Causes Highly Selective Dopaminergic Degeneration and α-Synuclein Aggregation. In: Experimental Neurology. Band 179, Nr. 1, Januar 2003, S. 9–16, doi:10.1006/exnr.2002.8072.
- ↑ Paul R. Forfia, Thomas H. Hintze, Michael S. Wolin, Gabor Kaley: Role of Nitric Oxide in the Control of Mitochondrial Function. In: Oxygen Transport to Tissue XXI. Band 471. Springer US, Boston, MA 1999, ISBN 978-1-4613-7137-3, S. 381–388, doi:10.1007/978-1-4615-4717-4_46.
- ↑ Mark P. Mattson: Free Radicals, Calcium., and The Synaptic Plasticity-Cell Death Continuum: Emerging Roles of The Transcription Factor Nfκb. In: International Review of Neurobiology. Band 42. Elsevier, 1998, ISBN 978-0-12-366842-4, S. 103–168, doi:10.1016/s0074-7742(08)60609-1.
- ↑ Todd B. Sherer, Jin-Ho Kim, Ranjita Betarbet, J.Timothy Greenamyre: Subcutaneous Rotenone Exposure Causes Highly Selective Dopaminergic Degeneration and α-Synuclein Aggregation. In: Experimental Neurology. Band 179, Nr. 1, Januar 2003, doi:10.1006/exnr.2002.8072.
- ↑ Mohamed B. Abou-Donia: Organophosphorus Ester-Induced Chronic Neurotoxicity. In: Archives of Environmental Health: An International Journal. Band 58, Nr. 8, August 2003, ISSN 0003-9896, S. 484–497, doi:10.3200/AEOH.58.8.484-497.
- ↑ William M. Valentine: Pyrethrin and Pyrethroid Insecticides. In: Veterinary Clinics of North America: Small Animal Practice. Band 20, Nr. 2, 1. März 1990, ISSN 0195-5616, S. 375–382, doi:10.1016/S0195-5616(90)50031-5.
- ↑ a b Marquardt, Hans: Lehrbuch der Toxikologie mit 342 Tabellen. 2., völlig neu bearb. Auflage. Stuttgart, ISBN 978-3-8047-1777-0.
- ↑ a b F. M. Corrigan, S. Macdonald, A. Brown, K. Armstrong, E. M. Armstrong: Neurasthenic fatigue, chemical sensitivity and GABAa receptor toxins. In: Medical Hypotheses. Band 43, Nr. 4, 1. Oktober 1994, ISSN 0306-9877, S. 195–200, doi:10.1016/0306-9877(94)90065-5.
- ↑ A. E. Halaris, K. T. Belendiuk, D. X. Freedman: Antidepressant drugs affect dopamine uptake. In: Biochemical Pharmacology. Band 24, Nr. 20, 15. Oktober 1975, ISSN 0006-2952, S. 1896–1897, doi:10.1016/0006-2952(75)90412-8, PMID 19.
- ↑ Jordi Llorens, Josep M. Tusell, Cristina Suñol, Eduard Rodríguez-Farré: On the effects of lindane on the plus-maze model of anxiety. In: Neurotoxicology and Teratology. Band 12, Nr. 6, November 1990, S. 643–647, doi:10.1016/0892-0362(90)90078-Q.
- ↑ Rosa Planells-Cases, Nuria Garcìa-Sanz, Cruz Morenilla-Palao, Antonio Ferrer-Montiel: Functional aspects and mechanisms of TRPV1 involvement in neurogenic inflammation that leads to thermal hyperalgesia. In: Pflügers Archiv - European Journal of Physiology. Band 451, Nr. 1, Oktober 2005, ISSN 0031-6768, S. 151–159, doi:10.1007/s00424-005-1423-5.
- ↑ Hillel S. Koren, Robert B. Devlin: Human Upper Respiratory Tract Responses to Inhaled Pollutants with Emphasis on Nasal Lavage. In: Annals of the New York Academy of Sciences. Band 641, 1 Sources of In, April 1992, ISSN 0077-8923, S. 215–224, doi:10.1111/j.1749-6632.1992.tb16545.x.
- ↑ Hillel S. Koren, Gary E. Hatch, Delores E. Graham: Nasal lavage as a tool in assessing acute inflammation in response to inhaled pollutants. In: Toxicology. Band 60, Nr. 1-2, Januar 1990, S. 15–25, doi:10.1016/0300-483X(90)90159-E.
- ↑ Hillel S. Koren, Delores E. Graham, Robert B. Devlin: Exposure of Humans to a Volatile Organic Mixture. III. Inflammatory Response. In: Archives of Environmental Health: An International Journal. Band 47, Nr. 1, Februar 1992, ISSN 0003-9896, S. 39–44, doi:10.1080/00039896.1992.9935942.
- ↑ Maija-Riitta Hirvonen, Marjo Ruotsalainen, Kai Savolainen, Aino Nevalainen: Effect of viability of actinomycete spores on their ability to stimulate production of nitric oxide and reactive oxygen species in RAW264.7 macrophages. In: Toxicology. Band 124, Nr. 2, Dezember 1997, S. 105–114, doi:10.1016/S0300-483X(97)00141-8.
- ↑ Miyun Tsai-Turton, Brooke N. Nakamura, Ulrike Luderer: Induction of Apoptosis by 9,10-Dimethyl-1,2-Benzanthracene in Cultured Preovulatory Rat Follicles Is Preceded by a Rise in Reactive Oxygen Species and Is Prevented by Glutathione1. In: Biology of Reproduction. Band 77, Nr. 3, 1. September 2007, ISSN 0006-3363, S. 442–451, doi:10.1095/biolreprod.107.060368.
- ↑ Barry Dellinger, William A. Pryor, Rafael Cueto, Giuseppe L. Squadrito, Vijay Hegde: Role of Free Radicals in the Toxicity of Airborne Fine Particulate Matter. In: Chemical Research in Toxicology. Band 14, Nr. 10, Oktober 2001, ISSN 0893-228X, S. 1371–1377, doi:10.1021/tx010050x.
- ↑ Peter S Gilmour, Axel Ziesenis, E.Rona Morrison, Mark A Vickers, Ellen M Drost: Pulmonary and systemic effects of short-term inhalation exposure to ultrafine carbon black particles. In: Toxicology and Applied Pharmacology. Band 195, Nr. 1, Februar 2004, S. 35–44, doi:10.1016/j.taap.2003.10.003.
- ↑ Gefährliches Duo. Partikel und Allergene bringen das Immunsystem durcheinander. In: GSF-Forschungszentrum für Umwelt und Gesundheit, Mitglied der Helmholtzgemeinscha (Hrsg.): Aerosolforschung der GSF. Neuherberg, S. 38–42 (archive.org [PDF]).
- ↑ Von der Quelle zum Menschen. Die individuelle Expositionmit Partikeln. In: GSF-Forschungszentrum für Umwelt und Gesundheit, Mitglied der Helmholtzgemeinscha (Hrsg.): Aerosolforschung der GSF. Neuherberg, S. 24 (archive.org [PDF]).
- ↑ Zusammenspiel und Abwehr. Partikel auf ihrem Weg durch den Körper. In: GSF-Forschungszentrum für Umwelt und Gesundheit, Mitglied der Helmholtzgemeinscha (Hrsg.): Aerosolforschung der GSF. Neuherberg, S. 25–28 (archive.org [PDF]).
- ↑ Thomas P. J. Hofer, Ellen Bitterle, Ingrid Beck-Speier, Konrad L. Maier, Marion Frankenberger: Diesel exhaust particles increase LPS-stimulated COX-2 expression and PGE 2 production in human monocytes. In: Journal of Leukocyte Biology. Band 75, Nr. 5, Mai 2004, S. 856–864, doi:10.1189/jlb.0803387.
- ↑ Die Lunge im Visier. Partikelforschung in Kliniknähe. In: GSF-Forschungszentrum für Umwelt und Gesundheit, Mitglied der Helmholtzgemeinscha (Hrsg.): Aerosolforschung der GSF. Neuherberg, S. 29–33 (archive.org [PDF]).
- ↑ S. E. Schriner: Extension of Murine Life Span by Overexpression of Catalase Targeted to Mitochondria. In: Science. Band 308, Nr. 5730, 24. Juni 2005, ISSN 0036-8075, S. 1909–1911, doi:10.1126/science.1106653.
- ↑ T. Arai: High accumulation of oxidative DNA damage, 8-hydroxyguanine, in Mmh/Ogg1 deficient mice by chronic oxidative stress. In: Carcinogenesis. Band 23, Nr. 12, 1. Dezember 2002, S. 2005–2010, doi:10.1093/carcin/23.12.2005.
- ↑ Fritz Dünschede, Klaus Zwicker, Hanns Ackermann, Guido Zimmer: ADP- and oligomycin-sensitive redox behavior of F 0 b thiol in ATPsynthase depends on neighbored primary structure: Investigations using 14-C-labeled alpha lipoic acid. In: BioFactors. Band 19, Nr. 1-2, 2003, S. 19–32, doi:10.1002/biof.5520190104.
- ↑ Maxim Yu. Balakirev, Guido Zimmer: Gradual Changes in Permeability of Inner Mitochondrial Membrane Precede the Mitochondrial Permeability Transition. In: Archives of Biochemistry and Biophysics. Band 356, Nr. 1, 1. August 1998, ISSN 0003-9861, S. 46–54, doi:10.1006/abbi.1998.0738.
- ↑ a b Sridhar Varadarajan, Servet Yatin, Marina Aksenova, und D. Allan Butterfield: Alzheimer’s Amyloidb-Peptide-Associated Free Radical Oxidative Stress and Neurotoxicity. Journal of Structural Biology, 7. April 2000, abgerufen am 12. Februar 2021 (englisch).
- ↑ John M. C. Gutteridge: Free radicals in biology and medicine. Fifth edition Auflage. Oxford 2015, ISBN 978-0-19-102698-0.
- ↑ Melanie Gertz, Frank Fischer, Dirk Wolters, Clemens Steegborn: Activation of the lifespan regulator p66Shc through reversible disulfide bond formation. In: Proceedings of the National Academy of Sciences. Band 105, Nr. 15, 15. April 2008, ISSN 0027-8424, S. 5705–5709, doi:10.1073/pnas.0800691105, PMID 18413607, PMC 2311372 (freier Volltext).
- ↑ T. Bottiglieri: Homocysteine, folate, methylation, and monoamine metabolism in depression. In: Journal of Neurology, Neurosurgery & Psychiatry. Band 69, Nr. 2, 1. August 2000, S. 228–232, doi:10.1136/jnnp.69.2.228, PMID 10896698, PMC 1737050 (freier Volltext).
- ↑ W. P. Bieger, F. Bartram, B. Knabenschuh, M. Penz, A. Neuner-Kritikos, W. Mayer: Die Rolle von oxidativem Stress in der Pathogenese von MCS. In: Zeitschrift für Umweltmedizin. Nr. 4, 2002, S. 198–205.
- ↑ Arti Shukla, Cynthia Timblin, Kelly BeruBe, Terry Gordon, Willie McKinney: Inhaled Particulate Matter Causes Expression of Nuclear Factor (NF)- κ B–Related Genes and Oxidant-Dependent NF- κ B Activation In Vitro. In: American Journal of Respiratory Cell and Molecular Biology. Band 23, Nr. 2, August 2000, ISSN 1044-1549, S. 182–187, doi:10.1165/ajrcmb.23.2.4035.
- ↑ Prang, N., W.R. Mayer, F. Bartram, und W.P. Bieger: MCS ein NF-κB-getriggerter Entzündungsprozess. Hrsg.: Organ des Deutschen Berufsverbandes der Umweltmediziner ; Organ der Deutschen Gesellschaft für Umwelt- und Humantoxikologie. Nr. 11/2, 2003, ZDB-ID 1447525-X, S. 80–86.
- ↑ Attilio Cannata, Chiara De Luca, Giulia Andolina, Daniela Caccamo, Monica Currò: Influence of the SOD2 A16V gene polymorphism on alterations of redox markers and erythrocyte membrane fatty acid profiles in patients with multiple chemical sensitivity. In: Biomedical Reports. Band 15, Nr. 6, 6. Oktober 2021, ISSN 2049-9434, S. 101, doi:10.3892/br.2021.1477, PMID 34667598, PMC 8517758 (freier Volltext).
- ↑ Hajime Kimata: Effect of exposure to volatile organic compounds on plasma levels of neuropeptides, nerve growth factor and histamine in patients with self-reported multiple chemical sensitivity. In: International Journal of Hygiene and Environmental Health. Band 207, Nr. 2, Januar 2004, S. 159–163, doi:10.1078/1438-4639-00262.
- ↑ Multi-Chemikalien-Sensitivitätssyndrom (MCS) und die Behandlung mit SANUM-Präparaten. Abgerufen am 15. April 2019.
- ↑ Avoxa-Mediengruppe Deutscher Apotheker GmbH: Gerichtsurteil: Nahrungsergänzungsmittel niemals erstattungsfähig. Abgerufen am 26. Juli 2022.
- ↑ Anlage I: OTC-Übersicht - Gemeinsamer Bundesausschuss. Abgerufen am 26. Juli 2022.
- ↑ a b Rechtsprechung OLG Frankfurt, 20.12.2018 - 7 U 103/16 auf dejure.org
- ↑ Hinweise zur Therapie chron. entzündliche Multisystemkrankheiten. Abgerufen am 15. April 2019.
- ↑ E. Schwarz u. a.: Langzeit-Verlaufskontrolle bei umweltmedizinischen Patienten unter der besonderen Berücksichtigung der Patienten mit chemischen Intoleranzen bzw. Multiple Chemical Sensitivity (MCS). (Memento vom 3. Dezember 2013 im Internet Archive) Forschungsbericht, 2006. (PDF, 542 kB)
- ↑ a b M. Nasterlack, T. Kraus, R. Wrbitzky: Multiple Chemical Sensitivity: Eine Darstellung des wissenschaftlichen Kenntnisstandes aus arbeitsmedizinischer und umweltmedizinischer Sicht. In: Deutsches Ärzteblatt. 2002, 99, S. A 2474–2483, Heft 38.
- ↑ Gemeinsame Presseerklärung des Umweltbundesamtes und des Bundesinstituts für gesundheitlichen Verbraucherschutz und Veterinärmedizin: Ursachen, Diagnostik und Therapie der vielfachen Chemikalienüberempfindlichkeit (MCS) stellen Wissenschaft und Ärzte vor Probleme, 28. Februar 1996.
- ↑ MCS für Ärzte, Deutsche Gesellschaft Multiple-Chemical-Sensitivity (DGMCS) e.V., Bayreuth
- ↑ Dr. Kurt E. Müller: Multiple Chemikaliensensitivität (MCS). Fachinformation für Ärzte, Heilpraktiker und Therapeuten. Deutscher Berufsverband Klinischer Umweltmediziner e. V., abgerufen am 26. Februar 2021.
- ↑ M. Pall, J. D. Satterlee: Elevated Nitric Oxide/Peroxynitrite Mechanism for the common etiology of Multiple Chemical Sensitivity, Chronic Fatigue Syndrome and Posttraumatic Stress Disorder. In: Annals of the New York Academy of Sciences. (2001); 933, S. 323–329.
- ↑ P. Rainville u. a.: Representation of acute and persistent pain in the human CNS: potential implications for chemical intolerance. In: Annals of the New York Academy of Sciences. (2001); 933, S. 130–141.
- ↑ M. R. Cullen: The worker with multiple chemical sensitivities: an overview. In: Occupational Medicine. 1987; 2, S. 655–661, PMID 3313760.
- ↑ Definitions of MCS (englisch)
Auf dieser Seite verwendete Medien
Ärztlicher Befundberich (Musterbefund) von LTT-Umweltschadstoffen
Ärztlicher Befundbericht zum Nachweis genetischer Polymorphismen
Ärztlicher Befundberich (Musterbefund) von Acrylaten
Wirkung von Pestiziden und Lösungsmitteln bei der Auslösung von MCS
Vereinfachter Pathomechanismus der Entgiftung von Fremdstoffen