Mucobromsäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
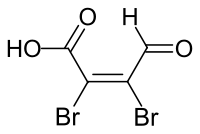 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Mucobromsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H2Br2O3 | ||||||||||||||||||
| Kurzbeschreibung | beiger Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 257,86 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Mucobromsäure ist eine chemische Verbindung aus der Gruppe der ungesättigten Oxocarbonsäuren.
Gewinnung und Darstellung
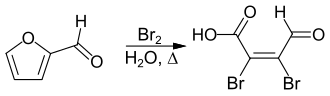
Eine für eine industrielle Herstellung praktikable Synthese geht von Furfural aus, welches unter Ringöffnung oxidativ zur Mucobromsäure bromiert wird.[2]
Eigenschaften
NMR- und UV-Untersuchungen zeigen, dass die Mucobromsäure in neutraler oder saurer Lösung als Lacton vorliegt und im basischen Medium zur offenkettigen Aldehydform tautomerisiert.[3]
Verwendung
Durch Reduktion der Mucobromsäure mit Natriumborhydrid in Methanol und anschließender Aufarbeitung mit konzentrierter Schwefelsäure ist 3,4-Dibrom-2(5H)-furanon zugänglich, ein Zwischenprodukt für substituierte 2(5H)-Furanone und Tetronamide.[4][5]
Durch Umsetzung von Mucobromsäure mit Natriumnitrit erhält man das Natriumsalz von Nitromalondialdehyd, ein Zwischenprodukt zur Synthese von 2-Amino-5-nitropyrimidin[6] und anderer heterocyclischer Verbindungen.[7]
Mucobromsäure kann als Ausgangsmaterial zur Herstellung von Hexanitroethan verwendet werden.[8]
Einzelnachweise
- ↑ a b c d e Datenblatt Mucobromic acid, 99% bei Sigma-Aldrich, abgerufen am 12. Dezember 2015 (PDF).
- ↑ G. A. Taylor: Organic Syntheses. American Cancer Society, 2003, ISBN 0-471-26422-9, Mucobromic Acid, S. 688, doi:10.1002/0471264180.os900.13 (orgsyn.org [PDF]).
- ↑ N. P. Buu-Hoi, M. Dufour, P. Jacquignon: ChemInform Abstract: Ring-Ketten-Tautomerie bei Mucochlor- und Mucobromsaeure und einigen ihrer Derivate. In: Chemischer Informationsdienst. Organische Chemie. Band 2, Nr. 50, 1971, doi:10.1002/chin.197150141.
- ↑ Selective synthesis of (Z)-4-aryl-5-[1-(aryl)methylidene]-3-bromo-2(5H)-furanones. In: Tetrahedron. Band 57, Nr. 50, 2001, S. 9997–10007, doi:10.1016/S0040-4020(01)01017-1.
- ↑ Silvio Cunha, Caio C. Oliveira, José R. Sabino: Synthesis of 3-bromotetronamides via amination of 3,4-dibromofuran-2(5H)-one. In: Journal of the Brazilian Chemical Society. Band 22, 2011, S. 598–603, doi:10.1590/S0103-50532011000300026.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2-Amino-5-nitropyrimidin: CAS-Nummer: 3073-77-6, EG-Nummer: 221-348-1, ECHA-InfoCard: 100.019.408, PubChem: 76490, ChemSpider: 68960, Wikidata: Q72440152.
- ↑ Sodium Nitromalonaldehyde Monohydrate. In: Organic Syntheses. Band 32, 1952, S. 95, doi:10.15227/orgsyn.032.0095.
- ↑ Patent US3101379: Synthesis of Hexanitroethane. Angemeldet am 4. Januar 1961, veröffentlicht am 20. August 1963, Anmelder: Lockheed Aircraft Corp., Erfinder: John A. Gallaghan, Wilmer L. Reed.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
chemical structure of Mucobromic acid
Ring–chain tautomerism of Mucobromic acid
synthesis of 2-Amino-5-nitropyrimidine from Mucobromic acid and Guanidine
synthesis of Mucobromic acid by bromination of fufural
Reduction of Mucobromic acid with sodium borohydride and further reactions
synthesis of Hexanitroethane from Mucobromic acid