Modell (Chemie)



Modelle werden in der Chemie ausgehend von makroskopischen oder mikroskopischen Beobachtungen und Versuchsergebnissen erdacht und benutzt, mit denen auf Eigenschaften und Reaktionen von Atomen, Ionen, Molekülen und Stoffen geschlossen werden kann. Sie dienen zudem zur Veranschaulichung von Teilchen und Reaktionen. Alle Aussagen über den submikroskopischen Bereich haben Modellcharakter, da dieser Bereich dem Betrachter oftmals nicht unmittelbar zugänglich ist. Modelle sind nicht nur für die Forschung, sondern insbesondere auch für den Chemieunterricht und das Chemiestudium bedeutungsvoll.
Prinzipien
Man kann zwischen folgenden Arten von Modellen unterscheiden:
- ideelle Modelle sind gedankliche Konstrukte (Denkmodelle),
- materielle Modelle oder Sachmodelle dienen zur Veranschaulichung von ideellen Modellen und gehören prinzipiell auch zu den Medien.
Ein großer Bereich in der Chemie nehmen Modelle vom Aufbau der Materie (Teilchenmodelle) und Modellvorstellungen von der chemischen Bindung ein. Die zunächst entwickelten Denkmodelle werden dabei in der Regel durch geeignete materielle Modelle veranschaulicht. Die Vorstellung über eine kovalente Bindung ist ein ideelles Modell, das z. B. in einfachster Form durch ein Kugel-Stab-Modell oder eine Elektronenformel veranschaulicht werden kann. Die Vorstellung einer Ionenbindung kann durch ein Gittermodell, die Vorstellung über die räumliche Anordnung von Atomen in einem Molekül kann durch ein Kalottenmodell oder Orbitalmodell veranschaulicht werden.
An die Modelle sollten folgende Forderungen gestellt werden:
- Anschaulichkeit,
- Einfachheit,
- Transparenz,
- Möglichkeiten zur Weiterentwicklung,
- Kohärenz zwischen mehreren Modellen: Modelle einer übergeordneten Struktur müssen zur untergeordneten Struktur passen.
Reaktionsgleichungen, Reaktionstypen bzw. Reaktionsmechanismen und kinetische Betrachtungen sind Modellvorstellungen der abgelaufenen Reaktionen und werden mit Hilfe geeigneter Medien beschrieben und dargestellt. Kinetische Betrachtungen können gut durch Simulationen (z. B. Computersimulationen) unterstützt werden. Experimente haben oftmals Modellcharakter, zumal sie in der Regel die Realität vereinfachen. Zudem können sie als Funktionsmodell zur Veranschaulichung von anwendungsbezogenen und technischen Abläufen eingesetzt werden.
Quellen
- Günter Keller: Über das Denken in Modellen, Verlag Diesterweg Salle/Sauerländer 1977, ISBN 3-425-07027-4
- Ernst Kircher, Alfred Teßmann (Hrsg.): Atommodelle im Unterricht, IPTS-Schriften Band 15, Verlag Schmidt und Klaunig 1977, ISBN 3-88312-112-6
- Christhardt Tröger: Gedanken zum Modellgebrauch im Chemieunterricht, Praxis der Naturwissenschaften Chemie 9/1980, S. 269, Aulis Verlag Köln
- Hans-Dieter Barke: Die Unverzichtbarkeit von Strukturmodellen für das Verständnis chemischer Reaktionen, Praxis der Naturwissenschaften Chemie 12/1980, S. 372, Aulis Verlag Köln
- Modelle und Modellexperimente, Praxis der Naturwissenschaften – Chemie in der Schule 2/2003, Aulis Verlag Köln
Auf dieser Seite verwendete Medien
Autor/Urheber: Alexander, Lizenz: CC0
Simulacion hecha en g09, en la Univarsidad Autonoma Metropolita, hecha por estudiantes
Autor/Urheber: Ricardo Maçãs, Lizenz: CC BY-SA 3.0
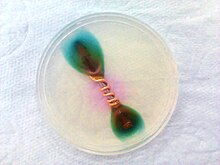
Corrosion of a iron nail with a coiled copper wire, in agar-agar medium with ferroxyl indicator solution (potassium hexacyanoferrate(III), indicator of iron ions, and phenolphthalein, indicator of hydroxide ions). Results obtained after 3 days. Due to presence of copper, the iron is corroded faster because it is the sacrificial metal in this case. The blue color near the iron indicates the presence of iron ions in the medium (iron oxidation - anodic zone) and pink near the copper indicates the presence of hydroxide ions in the medium (oxygen reduction - cathodic zone).
Autor/Urheber: Bin im Garten, Lizenz: CC BY-SA 3.0
Moleküel - gebaut mit dem Molekülbaukasten
Kation Zundla fluktuacje



