Diffuses Mittelliniengliom
| Klassifikation nach ICD-10 | |
|---|---|
| C71 | Bösartige Neubildung des Gehirns |
| C72 | Bösartige Neubildung des Rückenmarks |
| ICD-10 online (WHO-Version 2019) | |
| Klassifikation nach ICD-O-3 | |
|---|---|
| 9385/3 | Diffuses Mittelliniengliom, H3 K27-alteriert |
| ICD-O-3, zweite Revision (2019) | |

Das diffuse Mittelliniengliom, H3 K27-alteriert (DMG) ist ein bösartiger Hirntumor, der insbesondere im Kindesalter auftritt und im Hirnstamm, Thalamus und Rückenmark lokalisiert sein kann. Bei Auftreten im Pons wird es auch als diffuses intrinsisches Ponsgliom (DIPG) bezeichnet.
Aufgrund der schlechten Prognose wird die Krankheit als WHO-Grad 4 klassifiziert. Die Behandlung erfolgt mittels Bestrahlung und Studientherapien. Die mittlere Überlebensdauer ab Diagnosestellung liegt bei 9 bis 15 Monaten.
Verbreitung
Bei Kindern sind 80 % der Hirnstammgliome und 10 % aller ZNS-Tumoren diffuse Mittelliniengliome. Sie treten selten auf, in den USA gibt es etwa 300 Fälle pro Jahr. Überwiegend sind Kinder betroffen, das Durchschnittsalter bei Diagnose lieg bei etwa sieben Jahren. Bei Erwachsenen sind DMGs sehr selten und Varianten ohne H3K27M-Mutation vergleichsweise häufiger.[1][2][3]
Das Geschlecht hat keinen Einfluss auf das Erkrankungsrisiko.[3]
Ursache
Die meisten Mittelliniengliome treten sporadisch auf, also ohne familiäre Häufung. Spezifische Risikofaktoren sind nicht bekannt. In seltenen Fällen können sie im Rahmen erblicher Syndrome wie dem Li-Fraumeni-Syndrom auftreten.[1][4]
Klinische Erscheinungen
Der Tumor wächst schnell und wird in der Regel innerhalb von drei bis sechs Monaten symptomatisch. Da der Tumor raumfordernd wächst, kommt es zu einem Hydrocephalus, der sich mit allgemeinen Hirndrucksymptomen wie Kopfschmerzen, Schwindel und Erbrechen äußert.[5][6][7]
Spezifische Symptome hängen von der Lokalisation des Tumors ab. Klassisch sind Störungen des Kleinhirns (z. B. Ataxie), der langen Rückenmarksbahnen (z. B. Pyramidenbahnzeichen) und Hirnnervenausfällen (vor allem N. abducens und N. facialis). Bei den selteneren Lokalisationen im Thalamus kommt es zu halb- oder beidseitigen Paresen oder begrenzten motorischen Ausfällen. Spinale DMGs werden ebenfalls durch Bewegungsstörungen auffällig.[1][6][7]
Untersuchungsmethoden

Der Tumor kann mittels Schnittbildgebung, vor allem der Magnetresonanztomographie, dargestellt werden. Der Tumor zeigt keine oder nur eine geringe Aufnahme von Gadolinium-Kontrastmittel.[5][8]
Zur Diagnosesicherung kann eine Biopsie im Rahmen eines stereotaktischen Eingriffs entnommen und anschließend analysiert werden.[8]
Krankheitsentstehung und Varianten
Diffuse Mittelliniengliome entwickeln sich aus Gliazellen. Diese bilden unter anderem das Stützgewebe des zentralen Nervensystems und zeichnen sich durch lange Zellfortsätze und verzweigtes Wachstum aus.
Alle DMGs teilen Veränderungen an Histon H3. Histon H3 unterliegt verschiedenen posttranslationalen Modifikationen, die sich wiederum auf seinen Einfluss auf die Transkription und die Struktur des Chromatins auswirken (Histonmodifikation).[9] Insbesondere die Form, bei der Lysin (K) an Stelle 27 (K27) dreifach methyliert vorliegt, hemmt die Expression verschiedener Gene (Gen-Silencing). Die Methylierung erfolgt durch den Polycomb repressive complex 2 (PRC2), die abschließend produzierte Form wird als H3K27me3 bezeichnet.[4][10]
Alle Formen des diffusen Mittellinienglioms haben einen Verlust von H3K27me3. In 80 % der Fälle handelt es sich um eine Gain-of-Function-Mutation, bei denen Lysin (K) durch Methionin (M) ausgetauscht wird, diese Mutation wird als H3K27M bezeichnet. Der genaue Krankheitsmechanismus von H3K27M-Mutationen ist nicht geklärt: Mögliche Faktoren sind eine höhere Bindungsaffinität zu EZH2, einem Enzym des PRC2; die Hemmung der Herstellung von S-Adenosylmethionin, einem Methylspender und der Verhinderung der Bindung von PRC2 an Chromatin. Den Ansätzen gemein ist eine Hemmung der H3K27-Methylierung, sodass es bereits bei geringen Anteilen von H3K27M-Mutationen zu einem weitgehenden Verlust von H3K27me3 kommt.[10][11][12]
Formen
Die aktuelle WHO-Klassifikation der Tumoren des zentralen Nervensystems unterscheidet vier Typen:[1]
- Diffuses Mittelliniengliom, H3.1 oder H3.2 K27-mutiert
- Mutationen des Gens HIST1H3B werden als H3.1 bezeichnet, sie machen ca. 15 % der diffusen Mittelliniengliome aus. Sie sind fast ausschließlich in Pons und Thalamus lokalisiert.[13][14] 80 % der H3.1-Formen weisen zusätzlich eine ACVR1-Mutation auf.[9] Diese Form tritt vor allem bei jüngeren Kindern auf, das durchschnittliche Erkrankungsalter liegt bei fünf Jahren.[1]
- Diffuses Mittelliniengliom, H3.3 K27-mutiert
- Mit 65 % der Fälle ist dies die häufigste Form des diffusen Mittellinienglioms, ursächlich ist eine Mutation des Gens H3F3A.[11][13] Sie können in allen Mittellinienstrukturen auftreten und sind besonders häufig mit TP-53-Mutationen assoziiert.[13][14]
- Diffuses Mittelliniengliom, H3-Wildtyp mit EZHIP-Überexpression
- Bei diesem Untertyp liegt ein H3-Wildtyp vor, das Gen ist also nicht mutiert. EZH ist ein Enzym des PRC2, der die H3K27-Trimethylierung durchführt. EZH wird durch das EZH inhibitory protein (EZHIP) gehemmt. Bei Überexpression von EZHIP wird H3K27 seltener methyliert, mit vergleichbaren Folgen wie bei einer H3K27-Mutation.[1][10][13]
- Diffuses Mittelliniengliom, EGFR-mutiert
- Diese Form definiert sich über Mutationen des Epidermal-Growth-Factor-Receptor-Gens und tritt bevorzugt im Thalamus auf. Der H3K27me3-Verlust wird vermutlich durch eine H3K27-Mutation oder eine EZHIP-Überexpression verursacht.[1][13]
Assoziierte Mutationen
- TP53
- p53 ist ein wichtiger Regulator der Zellproliferation und der Apoptose. Mutationen des verantwortlichen Gens TP53 kommen in fast der Hälfte der diffusen Mittelliniengliome vor, in erster Linie in solchen mit H3.3- oder EGFR-Mutation.[10][13][14]
- ACVR1
- Der Aktivin-A-Rezeptor-Typ-1 (ACVR1) ist Teil der Zytokinfamilie TGF-β. ACVR aktiviert den BMP-Signalweg, wodurch vermehrt Gliazellen gebildet werden.[11] Sie tritt vor allem bei DMGs mit H3.1-Mutation oder EZHIP-Überexpression auf.[7][13]
- ACVR1-Mutationen sind mit geringerem Alter und längerem Überleben assoziiert.[13]
- Sonstige
- Assoziierte Mutationen treten auch bei den Genen für den Platelet-Derived-Growth-Factor-Rezeptor-A, Fibroblasten-Wachstumsfaktor-Rezeptor-1, Phosphoinositid-3-Kinasen und weiteren auf.[1]
Pathologie

Aufgrund der schlechten Prognose werden alle diffusen Mittelliniengliome von der WHO-Klassifikation der Tumoren des zentralen Nervensystems als Grad 4 eingestuft.[1]
Histologie
In der Lichtmikroskopie zeigen sich diffus in das umliegende Gewebe infiltrierende Tumorzellen. Es finden sich viele Mitosen und teilweise auch mikrovaskuläre Proliferation und Nekrosen.[1]
Immunhistochemie
Durch immunhistochemische Verfahren können spezifische Proteine sichtbar gemacht werden.
Wie andere Gliome exprimieren DMGs üblicherweise OLIG2-, MAP2- und S100-Proteine, manchmal auch GFAP. Beim EGFR-mutierten Typ ist eine GFAP-Expression meist vorhanden, die von OLIG2 kann jedoch fehlen. Alle DMGs zeigen eine verringerte Anfärbung von H3K27me3. Durch die Anfärbung von H3K27M und EZHIP ist es möglich, zwischen Subtypen zu differenzieren.[1]
Behandlung
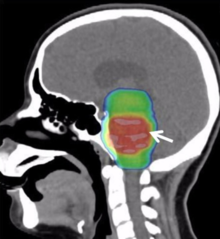
Die derzeitige Standardtherapie ist eine Bestrahlung. Bisher ist keine wirksame Chemotherapie etabliert. Durch die typische Lokalisation in den Mittellinienstrukturen und das infiltrierende Wachstum sind DMGs weitestgehend inoperabel.[8]
Neuere Studien lassen eine Wirksamkeit von Histon-Deacetylase (HDAC) Inhibitoren möglich erscheinen. Eine weitere Charakterisierung des Tumors und dessen Therapie sind noch Gegenstand der Forschung, der sich internationale Institutionen und Stiftungen, wie z. B. das Dana-Farber Cancer Institute in Boston[17] oder die Georg-August-Universität Göttingen[18] widmen.
Prognose
Diffuse Mittelliniengliome wachsen hochaggressiv und können nicht geheilt werden. Nach der Diagnose beträgt die mittlere Überlebenszeit 9 bis 15 Monate. Die Überlebensrate liegt nach zwei Jahren bei unter zehn Prozent, nach drei Jahren bei etwa drei Prozent.[1][19][20]
Einzelnachweise
- ↑ a b c d e f g h i j k l m n WHO Classification of Tumours Editorial Board (Hrsg.): Central Nervous System Tumours (= World Health Organization Classification of Tumours). 5th ed Auflage. International Agency for Research on Cancer, Lyon 2021, ISBN 978-92-832-4508-7, S. 69–73 (englisch).
- ↑ a b Hoffman LM, Veldhuijzen van Zanten SEM, Colditz N et al.: Clinical, Radiologic, Pathologic, and Molecular Characteristics of Long-Term Survivors of Diffuse Intrinsic Pontine Glioma (DIPG): A Collaborative Report From the International and European Society for Pediatric Oncology DIPG Registries. In: Journal of Clinical Oncology. Band 36, Nr. 19, 1. Juli 2018, ISSN 0732-183X, S. 1963–1972, doi:10.1200/JCO.2017.75.9308, PMID 29746225, PMC 6075859 (freier Volltext).
- ↑ a b López-Pérez CA, Franco-Mojica X, Villanueva-Gaona R et al.: Adult diffuse midline gliomas H3 K27-altered: review of a redefined entity. In: Journal of Neuro-Oncology. Band 158, Nr. 3, Juli 2022, ISSN 0167-594X, S. 369–378, doi:10.1007/s11060-022-04024-5.
- ↑ a b Al Sharie S, Abu Laban D, Al-Hussaini M: Decoding Diffuse Midline Gliomas: A Comprehensive Review of Pathogenesis, Diagnosis and Treatment. In: Cancers. Band 15, Nr. 19, 6. Oktober 2023, ISSN 2072-6694, S. 4869, doi:10.3390/cancers15194869, PMID 37835563, PMC 10571999 (freier Volltext) – (mdpi.com [abgerufen am 1. Dezember 2023]).
- ↑ a b Cohen KJ, Jabado N, Grill J: Diffuse intrinsic pontine gliomas—current management and new biologic insights. Is there a glimmer of hope? In: Neuro-Oncology. Band 19, Nr. 8, August 2017, ISSN 1522-8517, S. 1025–1034, doi:10.1093/neuonc/nox021, PMID 28371920, PMC 5570259 (freier Volltext).
- ↑ a b Di Ruscio V, Del Baldo G, Fabozzi F et al.: Pediatric Diffuse Midline Gliomas: An Unfinished Puzzle. In: Diagnostics. Band 12, Nr. 9, 25. August 2022, ISSN 2075-4418, S. 2064, doi:10.3390/diagnostics12092064, PMID 36140466, PMC 9497626 (freier Volltext).
- ↑ a b c Argersinger DP, Rivas SR, Shah AH et al.: New Developments in the Pathogenesis, Therapeutic Targeting, and Treatment of H3K27M-Mutant Diffuse Midline Glioma. In: Cancers. Band 13, Nr. 21, 21. Oktober 2021, ISSN 2072-6694, S. 5280, doi:10.3390/cancers13215280, PMID 34771443, PMC 8582453 (freier Volltext).
- ↑ a b c S2k-Leitlinie Gliome der Deutsche Gesellschaft für Neurologie. In: AWMF online (Stand 01.02.2021, inhaltlich überprüft am 31.10.2023)
- ↑ a b Duchatel RJ, Jackson ER, Alvaro F, Nixon B, Hondermarck H, Dun MD: Signal Transduction in Diffuse Intrinsic Pontine Glioma. In: PROTEOMICS. Band 19, Nr. 21-22, November 2019, ISSN 1615-9853, doi:10.1002/pmic.201800479.
- ↑ a b c d Cooney TM, Lubanszky E, Prasad R, Hawkins C, Mueller S: Diffuse midline glioma: review of epigenetics. In: Journal of Neuro-Oncology. Band 150, Nr. 1, Oktober 2020, ISSN 0167-594X, S. 27–34, doi:10.1007/s11060-020-03553-1 (springer.com [abgerufen am 1. Dezember 2023]).
- ↑ a b c Findlay, I.J., De Iuliis, G.N., Duchatel, R.J. et al.: Pharmaco-proteogenomic profiling of pediatric diffuse midline glioma to inform future treatment strategies. In: Oncogene. Band 41, Nr. 4, 21. Januar 2022, ISSN 0950-9232, S. 461–475, doi:10.1038/s41388-021-02102-y, PMID 34759345, PMC 8782719 (freier Volltext).
- ↑ Persson ML, Douglas AM, Frank Alvaro F et al.: The intrinsic and microenvironmental features of diffuse midline glioma: Implications for the development of effective immunotherapeutic treatment strategies. In: Neuro-Oncology. Band 24, Nr. 9, 1. September 2022, ISSN 1522-8517, S. 1408–1422, doi:10.1093/neuonc/noac117, PMID 35481923, PMC 9435509 (freier Volltext).
- ↑ a b c d e f g h i j Stefano Gabriele Vallero et al.: Pediatric diffuse midline glioma H3K27- altered: A complex clinical and biological landscape behind a neatly defined tumor type. In: Frontiers in Oncology. Band 12, 16. Januar 2023, ISSN 2234-943X, doi:10.3389/fonc.2022.1082062, PMID 36727064, PMC 9885151 (freier Volltext).
- ↑ a b c Price G, Bouras A, Hambardzumyan D, Hadjipanayis CG: Current knowledge on the immune microenvironment and emerging immunotherapies in diffuse midline glioma. In: eBioMedicine. Band 69, Juli 2021, S. 103453, doi:10.1016/j.ebiom.2021.103453, PMID 34157482, PMC 8220552 (freier Volltext).
- ↑ Castel D, Philippe C, Calmon R et al.: Histone H3F3A and HIST1H3B K27M mutations define two subgroups of diffuse intrinsic pontine gliomas with different prognosis and phenotypes. In: Acta Neuropathologica. Band 130, Nr. 6, 1. Dezember 2015, ISSN 1432-0533, S. 815–827, doi:10.1007/s00401-015-1478-0, PMID 26399631, PMC 4654747 (freier Volltext).
- ↑ Antin C, Tauziède-Espariat A, Debily MA et al.: EZHIP is a specific diagnostic biomarker for posterior fossa ependymomas, group PFA and diffuse midline gliomas H3-WT with EZHIP overexpression. In: Acta Neuropathologica Communications. Band 8, Nr. 1, Dezember 2020, ISSN 2051-5960, doi:10.1186/s40478-020-01056-8, PMID 33153494, PMC 7643397 (freier Volltext).
- ↑ Mikey Czech Foundation stiftet 1 Million USD für DIPG-Forschung im Krebsinstitut Dana-Farber. In: Presseportal. 30. März 2017, archiviert vom (nicht mehr online verfügbar) am 7. November 2018.
- ↑ M. Karremann, N. Krämer, M. Hoffmann, M. Wiese, A. Beilken, S. Corbacioglu, D. Dilloo, P. H. Driever, W. Scheurlen, A. Kulozik, G. H. Gielen, A. O. von Bueren, M. Dürken, C. M. Kramm: Haematological malignancies following temozolomide or paediatric high-grade glioma. In: Eur J Cancer. 81, 3. Jun 2017, S. 1–8.
- ↑ Kinderkrebsinfo – Prognose: Wie sind die Überlebensaussichten von Patienten mit einem hochmalignen Gliom. 9. Juli 2014, abgerufen am 20. Juni 2018.
- ↑ Michelle Monje et al.: Contemporary survival endpoints: an International Diffuse Intrinsic Pontine Glioma Registry study. In: Neuro-Oncology. Band 19, Nr. 9, September 2017, ISSN 1522-8517, S. 1279–1280, doi:10.1093/neuonc/nox107, PMID 28821206, PMC 5570207 (freier Volltext).
Auf dieser Seite verwendete Medien
Autor/Urheber: Antin, C., Tauziède-Espariat, A., Debily, MA. et al., Lizenz: CC BY 4.0
A distinct H3K27me3 loss (A, magnification, ×400) in one case of diffuse midline glioma with EZHIP overexpression, without expression of H3K27-mutant protein (B, magnification, ×400) and with strong positive EZHIP expression (C, magnification, ×400). A case of diffuse midline glioma, H3K27-mutant with a loss of expression of H3K27me3 (D, magnification, ×400), nuclear expression of H3K27-mutant protein (E, magnification, ×400), and without expression of EZHIP (F, magnification, ×400). DMG diffuse midline glioma, WT wildtype. Black scale bars represent 50 μm
Autor/Urheber: Benjamin T. Himes, Liang Zhang, David J. Daniels, Lizenz: CC BY 4.0
MRI imaging of an 8 year-old girl with a diffuse intrinsic pontine glioma (DIPG) tumor (white arrows). T2-weighted sagittal (A) and axial (B) images demonstrate the enlargement of the brainstem and highlight the diffuse infiltrative characteristic of DIPG tumors. (C,D) Gadolinium-enhanced T1-weighted MRI images of the same patient demonstrating scant patchy enhancement.
Autor/Urheber: Sison J, Tran H, Margol A, et al. (2017), Lizenz: CC BY 3.0
Treatment plan for a 16-year-old female with a diffuse intrinsic pontine glioma. Sagittal slice of a dose color wash of a 10-beam non-coplanar intensity-modulated radiation therapy (IMRT) plan (white arrows) to 54 Gy in 30 fractions.
Autor/Urheber: Huang T., Garcia R., Qi J., Lulla R., Horbinski C., Behdad A., Wadhwani N., Shilatifard A., James C., Saratsis A. M., Lizenz: CC BY 4.0
Magnetic resonance imaging characteristics (MRI) of pediatric diffuse midline glioma. Pediatric diffuse midline glioma arise in the brainstem (A, B) or thalamus (C, D). T2 weighted MR imaging (A, B, C) demonstrates a homogenous, expansile, infiltrative lesion with extension within white matter tracts. Minimal to heterogenous enhancement may be observed on T1 post-gadolinium sequences (D). Local mass effect and perilesional edema may also be seen.



