Methylmalonyl-CoA-Mutase
| Humane L-Methylmalonyl-CoA-Mutase | ||
|---|---|---|
 | ||
| Bändermodell nach PDB 3BIC | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 718 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Kofaktor | Adenosylcobalamin (Vitamin B12) | |
| Bezeichner | ||
| Gen-Namen | MCM ; MUT; MUTA | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 5.4.99.2, Mutase | |
| Reaktionsart | Isomerisierung | |
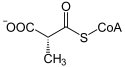
| Substrat | L-Methylmalonyl-CoA | |
| Produkte | Succinyl-CoA | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 4594 | 17850 |
| Ensembl | ENSG00000146085 | ENSMUSG00000023921 |
| UniProt | P22033 | P16332 |
| Refseq (mRNA) | NM_000255 | NM_008650 |
| Refseq (Protein) | NP_000246 | NP_032676 |
| Genlocus | Chr 6: 49.43 – 49.46 Mb | Chr 17: 40.93 – 40.96 Mb |
| PubMed-Suche | 4594 | 17850 |
Methylmalonyl-CoA-Mutase (MCM) ist ein Enzym, das im Stoffwechsel aller Lebewesen zum Abbau mehrerer Aminosäuren, Fettsäuren und Cholesterin benötigt wird. MCM katalysiert den Reaktionsschritt von L-Methylmalonyl-CoA zu Succinyl-CoA, eine Umlagerung; daher gehört MCM zu den Isomerasen. In manchen Bakterien ist es Teil des Aufbaus von Propionat aus Citratzyklus-Zwischenprodukten. Bei Eukaryoten ist MCM in den Mitochondrien lokalisiert. Mangel an MCM führt beim Menschen zur erblichen und oft tödlichen Methylmalonazidämie.[1]
Katalysierte Reaktion
L-Methylmalonyl-CoA wird zu Succinyl-CoA umgelagert. In Bakterien läuft die Reaktion in Gegenrichtung ab.
Coenzym der Reaktion ist Vitamin B12 (Cobalamin).[2]
Siehe auch
- Methylmalonazidämie mit Homocystinurie
Einzelnachweise
Weblinks
Auf dieser Seite verwendete Medien
Struktur von Succinyl-CoA
Struktur von L-Methylmalonyl-CoA
3d ribbon model of L-methylmalonyl-CoA-mutase (MUT, MCM) dimer from PDF 3BIC. Ref.: Ugochukwu, E., Kochan, G., Pantic, N., Parizotto, E., Pilka, E.S., Pike, A.C.W., Gileadi, O., von Delft, F., Arrowsmith, C.H., Weigelt, J., Edwards, A.M., Oppermann, U. Crystal structure of human methylmalonyl-CoA mutase. To be Published