Metallkomplexfarbstoffe
Metallkomplexfarbstoffe sind Koordinationsverbindungen eines Metallions mit einem oder mehreren Farbstoff-Liganden, die Elektronendonorgruppen aufweisen.
Bei den Metallkomplexfarbstoffen überwiegen die Kupfer- und Chrom-Verbindungen. In geringerem Umfang werden aber auch Cobalt-, Nickel- und Eisen-Komplexe als Metallkomplexfarbstoffe eingesetzt.[1] Bei den Liganden handelt es sich häufig um mehrzähnige Azofarbstoffe, Azomethinfarbstoffe, Formazane oder Phthalocyanine.[2]
Metallkomplexfarbstoffe zeichnen sich durch eine sehr gute Lichtechtheit aus.
Geschichte
Die bereits im Mittelalter praktizierte Beizenfärbung ist ein Beispiel für die Verwendung von Metallkomplexfarbstoffen. Dabei wird das Färbegut mit einer Lösung von Aluminium-, Eisen-, Chrom- oder Zinn-Salzen imprägniert und dann mit Naturfarbstoffen, die ein Chelat-System enthalten (z. B. Alizarin aus der Wurzel des Färberkrapps), gefärbt. Auf der Faser bildet sich der meist wasserunlösliche Metallkomplex.

Die ersten metallisierbaren synthetischen Farbstoffe wurden Ende des 19. Jahrhunderts entwickelt. Der erste Vertreter aus der Klasse der Azofarbstoffe war C.I. Mordant Orange 1 (Alizarin Gelb), der 1887 durch Rudolf Nietzki synthetisiert wurde. 1893 folgte die Synthese der metallisierbaren 2,2'-Dihydroxyazofarbstoffe und 1912 die Synthese der ersten vorab metallisierten 1:1-Chrom-Komplexfarbstoffe (René Bohn, BASF), die ab 1920 vermarktet wurden (BASF, Ciba). Weitere Meilensteine waren die erste Synthese von Kupferphthalocyanin (1927), die Entwicklung wasserlöslicher 1:2-Chrom-Komplexe ohne Sulfogruppen (1949), die Entwicklung unsymmetrischer 1:2-Metallkomplexfarbstoffe mit nur einer Sulfogruppe (1962) und von 1:2-Chromkomplexen mit zwei Sulfogruppen (1970).

Bereits in den 1940ern wurde das kommerziell wichtige Nachchromierungsverfahren entwickelt. Dabei wird die Faser zuerst mit einem metallisierbaren Farbstoff gefärbt und anschließend mit Natrium- oder Kaliumdichromat behandelt, so dass sich die Chrom-Komplexfarbstoffe direkt auf der Faser bilden. Dieses Verfahren wird insbesondere beim Färben von Wolle in dunklen Farbtönen angewendet (Beispiel: Mordant Black 9).[1]
Azo-/Azomethin-Komplexfarbstoffe
Die wichtigsten Metallkomplexfarbstoffe aus der Klasse der Azofarbstoffe, bzw. Azomethinfarbstoffe enthalten als Strukturelement eine 2,2'-dihydroxy-, eine 2-carboxy-2'-hydroxy- oder eine 2-amino-2'-hydroxy-substituierte Azoverbindung, bzw. eine 2,2'-dihydroxy- oder 2-carboxy-2'-hydroxy-substituierte Azomethinverbindung:

Azomethinfarbstoffe mit 2,2'-dihydroxy-, 2-carboxy-2'-hydroxy-Substituenten
Bei den aromatischen Kernen handelt es sich um Benzol-, Naphthalin- oder Pyrazolon-Derivate. Diese Verbindungen fungieren als dreizähnige Liganden. Somit kann das Cu2+-Ion mit der Koordinationszahl 4, Komplexe mit einem Farbstoff-Liganden dieses Typs bilden. Die vierte Koordinationsstelle wird durch ein Lösungsmittelmolekül besetzt. Cr3+ mit der Koordinationszahl 6 bildet Komplexe mit zwei Farbstoffliganden, sogenannte 2:1-Komplexe.[3]
Kupferkomplexfarbstoffe
Die Herstellung der Kupferkomplexfarbstoffe gelingt aus 2,2'-Dihydroxyazofarbstoffen unter milden Bedingungen durch Umsetzung mit Kupfersalzen (z. B. CuSO4) bei pH 4–7, in Gegenwart von Natriumacetat als Puffer. 2,2'-Dihydoxyazofarbstoffe sind jedoch teilweise nur schwer zugänglich, da die entsprechenden o-Hydroxydiazoniumsalze relativ reaktionsträge sind. Einen alternativen Zugang zu den entsprechenden Cu-Komplexfarbstoffen bieten folgende Varianten:
- Entalkylierende Kupferung: Bei der Umsetzung von 2-Alkoxy-2'-hydroxy-azofarbstoffen bei einer Temperatur >80 °C (ggf. auch bei T>100 °C unter Druck) bildet sich der Cu-Komplex unter Spaltung der Alkoxygruppe. In aller Regel werden die Methoxy-Verbindungen eingesetzt.[4]
- Oxidative Kupferung: Bei der Umsetzung eines o-Hydroxyazofarbstoffs mit einem Oxidationsmittel wie H2O2 in Gegenwart von Kupfer(II)-Ionen erhält man ebenfalls den 2,2'-Dihydroxyazofarbstoff-Cu-Komplex.
- Ausgehend von einem 2-Chlor-2'-hydroxyfarbstoff erhält man den Kupferkomplexfarbstoff durch Umsetzung mit einem Kupfersalz in alkalischem Medium bei 50 °C.[1]
Beispiele
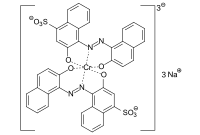
- C.I. Reactive Red 23
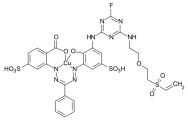
- C.I. Acid Blue 193
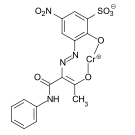
- C.I. Solvent Yellow 19
Formazanfarbstoffe
Die mit den Azofarbstoffen strukturell verwandten Formazanfarbstoffe sind 1,5-diaryl- oder 1,3,5-triarylsubstituierte Derivate der hypothetischen Stammverbindung NH=N‑CH=N‑NH2 – formal ein mit einer Azogruppe substituiertes Hydrazon.[5] Diese wurden erstmals 1892 durch Hans von Pechmann und Eugen Bamberger beschrieben.[6][7] Der einfachste Vertreter der 1,3,5-arylsubstituierten Formazane ist das Triphenylformazan. Die Formazane bilden mit verschiedenen Metallionen (Kupfer, Nickel, Cobalt) Komplexe, wobei die unsubstituierten Di- und Triarylformazane zweizähnig sind. Durch Einführung von Elektronendonorgruppen (Hydroxy-, Carboxy-, Amino-Gruppen) in die o-Position der Arylgruppen in 1- und 5-Position erhält man drei- und vierzähnige Liganden.
Von kommerziellem Interesse sind im Wesentlichen die vierzähnigen 1,3,5-triarylsubstituierten Kupferformazan-Komplexe. Ein wichtiger Vertreter ist ein Triphenylkupferformazan, bei der die Phenylgruppe in der 1-Position mit einer Hydroxy- und Aminogruppe und die 5-Phenylgruppe in der 5-Position mit einer Carboxygruppe substituiert ist.
Durch weitere Sulfogruppen wird die Wasserlöslichkeit der Verbindung erhöht. Durch Derivatisierung der Aminogruppe beispielsweise mit Trichlortriazin oder Trifluortriazin sind verschiedene Formazane aus der Klasse der Reaktivfarbstoffe zugänglich.[8]
Herstellung
Benzaldehyd (1) reagiert mit 2-Carboxy-5-sulfo-phenylhydrazin (2) zu dem Hydrazon (3). In Gegenwart von Kupfersulfat kuppelt das Hydrazon mit diazotiertem 6-Acetylamino-4-sulfo-2-aminophenol (4) zu der Kupferformazan-Verbindung (6). Durch alkalische Hydrolyse der Acetylamino-Gruppe erhält man den Kupferformazan-Chromophor (7).[8]
Beispiele
- C.I. Reactive Blue 235
- C.I. Reactive Blue 160
Phthalocyaninfarbstoffe
Die Phthalocyaninfarbstoffe sind Metallkomplexe des Phthalocyanins, substituiert mit löslichmachenden Gruppen, beispielsweise -SO3H. Phthalocyanin bildet mit einer Vielzahl von Metallen und Halbmetallen stabile Komplexe. Von kommerzieller Bedeutung sind jedoch in erster Linie die Kupferkomplexe und in untergeordnetem Umfang die Nickelkomplexe. Wichtige Zwischenstufen bei der Herstellung von Kupferphthalocyaninfarbstoffen sind die Sulfonsäurechloride, die man bei der Umsetzung von Kupferphthalocyanin mit Chlorsulfonsäure und Thionylchlorid bei Temperaturen >100 °C erhält. Die Sulfochloride lassen sich mit aromatischen oder aliphatischen Aminen zu Sulfonamiden umsetzen. Durch Hydrolyse der Sulfochloridgruppen erhält man Sulfonsäuren.[9]
Abhängig von dem Metallion und den Substituenten sind mit den Phthalocyaninfarbstoffen türkisfarbene bis brillantgrüne Farbtöne zugänglich. Die Phthalocyaninfarbstoffe zeichnen sich durch eine ausgezeichnete Stabilität und eine hohe Lichtechtheit aus.
Beispiele
- C.I. Direct Blue 86
- C.I. Reactive Blue 7
- Alcianblau
Einzelnachweise
- ↑ a b c Klaus Hunger (Hrsg.): Industrial Dyes: Chemistry, Properties, Applications. WILEY-VCH Verlag, Weinheim 2003, ISBN 978-3-662-01950-4, S. 85 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Metallkomplex-Farbstoffe. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. März 2019.
- ↑ Heinrich Zollinger: Color Chemistry: Syntheses, Properties, and Applications of Organic Dyes and Pigments. 3. Auflage. WILEY-VCH Verlag, Weinheim 2003, ISBN 3-906390-23-3, S. 206 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Max Hungerbühler: Über die entmethylierende Kupferung von o-Methoxy-o'-Oxyfarbstoffen. Eidgenössische Technische Hochschule, Zürich 1949, doi:10.3929/ethz-a-000103794.
- ↑ R. Price: The Chemistry of Metal Complex Dyestuffs. In: K. Venkataraman (Hrsg.): The Chemistry of Synthetic Dyes. Band III. Academic Press, New York, London 1970, ISBN 0-12-717003-0, S. 373 ff.
- ↑ H. v. Pechmann: Ueber die sogen. gemischten Azoverbindungen. In: Berichte der deutschen chemischen Gesellschaft. Band 25, Nr. 2, Juli 1892, S. 3190, doi:10.1002/cber.189202502174.
- ↑ Eug. Bamberger, E. Wheelwright: Ueber die Einwirkung von Diazobenzol auf Acetessigäther. In: Berichte der deutschen chemischen Gesellschaft. Band 25, Nr. 2, Juli 1892, S. 3201, doi:10.1002/cber.189202502175.
- ↑ a b Patent DE3705789: Kupferkomplex-Formazan-Verbindungen, Verfahren zu ihrer Herstellung und ihre Verwendung als Farbstoffe. Veröffentlicht am 1. September 1988, Erfinder: Günther Schwaiger, Hartmut Springer, Werner Russ.
- ↑ G.Booth: Phthalocyanines. In: K. Venkataraman (Hrsg.): The Chemistry of Synthetic Dyes. Band V. Academic Press, New York, London 1971, S. 241 ff.
Auf dieser Seite verwendete Medien
chemical structure of Acid Blue 193
Coppering of Azo Dyes with Chloro-/OH-exchange
C.I. Mordant Schwarz 9
Synthesis Copperformazane Chromophore
Struktur von Alizaringelb R
C.I. Solvent Gelb 19
Chemical Structure Substituted Copperformazane Chromophore
chemical structures for azo- and azomethine metal complex dyes
chemical structure C.I. Direct Blue 86 / CAS 1330-38-7
Demethylative Coppering of Azo Dyes
C.I. Reactive Blue 160
C.I. Reactive Blue 235
C.I. Reaktiv Blau 7
chemical structure Alcian blue / CAS 33864-99-2
Oxidative Coppering of Azo Dyes
Formazan Metal Complexes
chemical structure of Reactive Red 23