Maul- und Klauenseuche
| Klassifikation nach ICD-10 | |
|---|---|
| B08.8 | Sonstige näher bezeichnete Virusinfektionen, die durch Haut- und Schleimhautläsionen gekennzeichnet sind |
| ICD-10 online (WHO-Version 2019) | |
Die Maul- und Klauenseuche (MKS), auch Aphthenseuche, Aphthae epizooticae und Stomatitis epidemica,[1] ist eine hoch ansteckende Viruserkrankung bei Rindern und Schweinen und ist eine anzeigepflichtige Tierseuche. Auch andere Paarhufer wie Rehe, Ziegen und Schafe, aber auch Elefanten, Ratten und Igel können sich infizieren. Pferde sind nicht und Menschen nur selten für MKS anfällig.[2]


Erreger

Als erstes tierisches Virus wurde 1898 durch Friedrich Loeffler und Paul Frosch für den MKS-Erreger eine Virusnatur nachgewiesen. Die beiden Bakteriologen entdeckten, dass intravenös verabreichte Lymphe infizierter Tiere auch nach vorheriger Filtration durch bakteriendichte Kieselgurkerzen krankheitsauslösend für gesunde Kälber war. Der von Loeffler und Frosch isolierte ultravisible Erreger der MKS ist das Maul-und-Klauenseuche-Virus, ein hoch kontagiöses Einzel-(+)-Strang-RNA-Virus [ss(+)RNA]. Er gehört zum Genus Aphthovirus der Virenfamilie Picornaviridae. Die Mitglieder dieser Familie sind unbehüllte kleine (25–30 nm) Viren mit ikosaederförmigem Kapsid (Proteinhülle), das als genetisches virales Material einzelsträngige Ribonukleinsäure (RNA) enthält. Nach Auflösung der Proteinhülle findet die Virusreplikation im Zytoplasma einer infizierten Wirtszelle statt. Die Freisetzung der neu entstandenen Virionen erfolgt nach Auflösung der Zellmembran durch Lyse.
Übertragung
Im Gegensatz zu anderen Erregern halten es Forscher beim Maul-und-Klauenseuche-Virus für möglich, dass zumindest theoretisch ein einziges Virion dieses Erregers eine Infektion auslösen kann.[3]
Die durch eine Infektion mit dem Virus ausgelöste Maul- und Klauenseuche tritt in der Regel lokal auf und das Virus wird in erster Linie durch Kontakt- wie durch Schmierinfektion bei direktem Kontakt mit infizierten Tieren, mit kontaminierten Pferchen oder Viehtransportfahrzeugen übertragen. Allerdings kann das Virus auch durch die Luft verbreitet werden. Die Kleidung und Haut von Landwirten und anderen mit Tieren umgehenden Menschen, stehendes Wasser, ungekochte Futterabfälle, infizierte Tierprodukte enthaltende Futterzusätze und Tierprodukte wie Käse oder Fleisch können das Virus beherbergen. Kühe können MKS von infizierten Bullen durch Samenübertragung bekommen. Kontrollmaßnahmen schließen Quarantäne, die Vernichtung von infizierten Viehherden und ein Exportverbot für tierische Produkte in Länder ein, die nicht von der Seuche betroffen sind.
Menschen stecken sich mit der Maul- und Klauenseuche nur sehr selten an. Für den Verbraucher von Rind- und Schweinefleisch sowie von pasteurisierter Milch bzw. daraus hergestellten Erzeugnissen besteht auch im Falle eines Seuchenzuges keine Gefahr. Da sich die Seuche aber unter Tieren äußerst schnell ausbreitet, ist MKS eine gravierende Bedrohung für die Landwirtschaft.[2]
Vorkommen
MKS ist nahezu weltweit verbreitet. Lediglich in Neuseeland wurden bislang keine MKS-Ausbrüche registriert, in Australien war der letzte Ausbruch 1872. Auch die Vereinigten Staaten (letztes Vorkommen 1929), Kanada (1952), Mexiko (1954) und Chile (1988) gelten als MKS-frei. Die MKS von 1911 war die erste europaweite Katastrophe des 20. Jahrhunderts.[4] In Europa blieben in den letzten Jahrzehnten lediglich die skandinavischen Länder Norwegen (letztes Vorkommen 1952), Finnland (1959) und Schweden (1966) von Ausbrüchen verschont. In Österreich trat die letzte Epidemie 1973 auf.[5] Die MKS von 1911 hielt Deutschland über ein Jahr lang in Atem, mit radikalen Eingriffen in das Leben der gesamten Bevölkerung. In Schleswig-Holstein wurden z. B. ganze Regionen abgeriegelt, Veranstaltungen verboten und Nahrungsmittel wurden knapp. Scharlatane machten sich breit, und die politischen Debatten wurden mit vereinfachenden, konträren bis hin zu abstrusen Forderungen aufgeheizt[6]. In Deutschland ist die MKS letztmals 1988 aufgetreten.[7] In Spanien, Frankreich, den Niederlanden und Irland gab es 2001 Fälle der MKS. In Großbritannien kam es zuletzt 2001[8] sowie 2007 zu Ausbrüchen von MKS.[9] In der Schweiz trat die Seuche in den Jahren 1871/72, 1899–1900, 1911–14, 1920/21, 1939/40 und 1965 verheerend auf.[10] Nach den letzten Ausbrüchen von 1968 und 1980 gilt die Schweiz amtlich als MKS-frei.[11][12][13]
Weit verbreitet ist die MKS noch in Afrika, Asien und Teilen Südamerikas.[14] Diese Regionen gelten als enzootisch. In Europa ist die Erkrankung durch staatliche Veterinärüberwachung zwar weitgehend unter Kontrolle, es kommt aber immer wieder zur Einschleppung. Die vielfältigen Übertragungswege und die schnelle Ausbreitungsgeschwindigkeit der MKS führen schnell zu Epizootien, so dass die Seuche für Europa eine ständige Bedrohung darstellt.
Pathogenese
Im Mittelpunkt der Infektion steht eine stark ausgeprägte Virämiephase, mit der die generalisierte Verbreitung des Erregers im Wirt und seine Ansiedlung in den Zielorganen verbunden sind. Das MKS-Virus weist eine hohe Affinität zu Haut und kutanen Schleimhäuten (Epitheliotropismus) auf. Betroffen sind die Schleimhäute von Maulhöhle, Speiseröhre und Pansenpfeilern sowie die unbehaarte Haut von Nasenlöchern, Flotzmaul, Rüssel, Euter und Klauen. Der Erreger befällt darüber hinaus auch Skelett- und Herzmuskulatur (Myotropismus). Selten werden neurotrope Eigenschaften beobachtet.
Rinder infizieren sich hauptsächlich aerogen, während eine Infektion beim Schwein in der Regel auf oralem Wege erfolgt. Die an der Eintrittspforte entstehende Aphthe („Primäraphthe“) entgeht dabei meist der Beobachtung. Vom primären Vermehrungsort (Schwein: Tonsillen, Rind: Pharynxschleimhaut und Bronchiolen) gelangt das Virus in einer ersten virämischen Phase über Lymphe und Blut ins lymphoretikuläre System (v. a. Leber und Milz). Der Krankheitsverlauf wird vom weiteren Vermehrungserfolg des Virus in den primär affinen Organen bestimmt. Bei starker Vermehrung erfolgt dort eine Kolliquationsnekrose mit sich anschließender generalisierter Virämie, in deren Verlauf der MKS-Erreger Muskulatur, Haut, Schleimhaut und gelegentlich auch das ZNS erreicht. Die Virämie dauert vier Tage. Nach der Generalisation ist die virale RNA weitverbreitet in verschiedenen Epithelien nachweisbar. Sichtbares Zeichen der Organmanifestation des Virus ist die Ausbildung von „Sekundäraphthen“. Prädisponierende Faktoren wie besondere mechanische Belastung begünstigen ihr Entstehen. Die Aphthenbildung erfolgt im Stratum spinosum der Epidermis: die infizierten Keratozyten werden zerstört und die dadurch entstehenden Hohlräume füllen sich mit klarer Flüssigkeit, die zu einer großen Blase konfluiert. Den Blasenboden bildet das intakte Stratum basale mit dem darunterliegenden, gut durchbluteten Papillarkörper. Nach dem Platzen haben die Aphthen eine Tendenz zu oft flächigen Erosionen. In Herz- und Muskelzellen kommt es je nach myotroper Affinität des Erreger-Stammes zu Zellschädigungen variablen Ausmaßes.
Klinische Symptomatik und Krankheitsverlauf
Rind
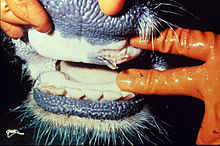
Die Inkubationszeit beträgt zwei bis sieben Tage. Den Ausbruch der Seuche kennzeichnet eine bis zu dreitägige Fieberphase (bis 42 Grad Celsius), die mit schweren Störungen des Allgemeinbefindens einhergeht. Bei Milchkühen ist ein schlagartiger Rückgang der Milchleistung bis hin zum völligen Versiegen der Milch zu beobachten. Noch in der Fieberphase beginnt eine starke Produktion zähflüssigen Speichels („MKS-Bart“) bei gleichzeitiger Rötung der Maulschleimhaut. Inappetenz, Störungen des Wiederkäuens und das Auftreten von „Speichellachen“ in Tiernähe kennzeichnen das Fortschreiten der Krankheit.
Im weiteren Verlauf bilden sich am Flotzmaul, in der gesamten Maulschleimhaut sowie im Zungenbereich erbsen- bis taubeneigroße flüssigkeitsgefüllte Blasen (Aphthen) aus. Gleichzeitig entwickeln sich weitere Aphthen im Klauenbereich, an der Euterhaut und an den Zitzen. Das Allgemeinbefinden ist hochgradig gestört. Die Tiere zeigen Schmerzäußerungen in Form von geschlossenem Maul, schmatzenden Kieferbewegungen und Lahmheiten. Nach Aufplatzen der Blasen bilden sich – zum Teil großflächige – Erosionen und der Heilprozess setzt ein. Gleichzeitig erkranken ständig weitere Tiere im Bestand. Die Abheilung der Läsionen im Maulbereich dauert bis zu 14 Tage. Die Klauenaphthen heilen innerhalb eines Monats ab. Die Rekonvaleszenzphase wird oft von bakteriellen Sekundärinfektionen gestört.
Neben gutartigen Seuchenvarianten mit teilweise milder Symptomatik (Letalität 2–5 %) existiert auch eine bösartige Verlaufsform der Seuche (Letalität bis 80 %). Ursache sind stark virulente Erreger mit ausgeprägtem Myotropismus. Diese Form tritt bevorzugt bei Kälbern auf. Auch bei milden Verläufen stehen in dieser Altersgruppe die Herzmuskelschäden durch Myokarditis im Vordergrund. Betroffene Tiere verenden innerhalb von 24 Stunden mit der Symptomatik einer schweren Allgemeinerkrankung.
Die natürliche Infektion hinterlässt eine belastbare Immunität gegen den jeweiligen Virustyp von bis zu 12 Monaten. Gefürchtete und zu erwartende Folge- und Spätschäden nach überstandener Infektion sind bakterielle Sekundärinfektionen, Mastitiden, Sohlenhorn- und Klauenveränderungen bis hin zum „Ausschuhen“ (komplette Ablösung des Klauenhorns), Muskelschäden, Myokarditis sowie anhaltende massive Leistungsdepressionen und Konditionsverluste.
Zu den wichtigsten Differentialdiagnosen beim Rind gehören Stomatitis vesicularis, Mucosal Disease, Rinderpest, Bösartiges Katarrhalfieber, Infektiöse Bovine Rhinotracheitis und die Pocken.
Schwein

Die Inkubationszeit beträgt ein bis drei Tage (in Einzelfällen bis max. 12). Die anfängliche Fieberphase hält bis zu vier Tage an. Insgesamt verläuft die Seuche weniger dramatisch als beim Rind.
Primär sind die Klauen von der Aphthenbildung betroffen, die sich sichtbar überwiegend am Kronrand und im Zwischenklauenspalt manifestiert. Die Veränderungen an Rüsselscheibe und Maulschleimhaut sind eher unauffällig. Bei der Sau kommt es außerdem zu Gesäugeaphthen.
Das klinische Bestandsbild bei den älteren Tieren wird von (Stützbein-)Lahmheiten unterschiedlichen Schweregrads bis hin zum Festliegen geprägt. Zunächst sind nur einige Tiere betroffen, die Krankheit breitet sich innerhalb weniger Tage im Bestand aus. Bei Saugferkeln und Läufern kommt es aufgrund von Herzmuskelschäden zu plötzlichen Todesfällen. Die Epithelläsionen an Rüssel und Gesäuge heilen innerhalb von zwei Wochen ab, bei Kronsaum- und Sohlendefekten wird der Krankheitsverlauf meist durch eitrige Sekundärinfektionen erschwert.
Die Immunität nach Durchseuchung hält fünf bis sieben Monate an. Spät- und Folgeschäden sind neben Mastitis, Metritis und Aborten ein Ausschuhen der Tiere sowie myokarditisbedingte Leistungseinbußen.
Rein vom klinischen Bild nicht abgrenzbar sind beim Schwein weitere Erkrankungen des Vesikulärkrankheitenkomplexes, die sämtlich mit Bläschenbildung einhergehen: Stomatitis vesicularis (VS), Vesikuläre Schweinekrankheit (SVD) und Vesikuläres Exanthem (VES). Darüber hinaus kommt differentialdiagnostisch eine Selenvergiftung infrage.
Schaf und Ziege
Die Inkubationszeit der sogenannten „gutartigen Klauenseuche“ beträgt 2–14 Tage. Bei Schafen und Ziegen sind die Krankheitsanzeichen unauffälliger als beim Rind.
Im Vordergrund steht beim Schaf die Bildung von Aphthen am Kronrand und im Zwischenklauenspalt. Veränderungen an Maulschleimhaut und Lippen sind oft uncharakteristisch. Die Durchseuchung der Herde erfolgt langsam und unvollständig (innerhalb von drei bis sechs Wochen). Oft einziges Anzeichen der Seuche sind schmerzhafte und hochgradige Lahmheiten. Ab dem dritten Tag der Lahmheit werden nach Platzen der Aphthen die geröteten Wundstellen gut sichtbar. Die Mortalität der adulten Tiere ist gering. Bei Lämmern dominiert die bösartige myokarditische Form mit Fieber, Durchfall und Apathie. Die Verluste betragen bis zu 80 %; die Tiere verenden ohne Anzeichen von Aphthenbildung. Die Läsionen heilen innerhalb von zwei bis drei Wochen ab, Sekundärinfektionen verkomplizieren den Verlauf.
Bei der Ziege verläuft die Erkrankung entweder leicht oder aber schwer, verbunden mit Myokardschäden und hoher Letalität. Es kommt zu einer fieberhaften Phase mit Allgemeinstörungen und Milchrückgang. Die Bildung von Aphthen in der Maulschleimhaut ist deutlich, aber durch baldiges Aufplatzen nur von kurzer Dauer. Im Kopfbereich kann es zu Schwellungen mit Aufstellen der Haare (sog. Dickkop) kommen. Oft liegt eine Rhinitis vor. Klauenaphthen werden selten beobachtet.
Spät- und Folgeschäden beim kleinen Wiederkäuer sind Klauenentzündungen, Aborte, Metritis und Mastitis. Die typspezifische Immunität nach Feldvirusinfektion beträgt ein bis zwei Jahre und länger.
Ähnliche Veränderungen wie die MKS verursachen bei Schaf und Ziege die Moderhinke, Lippengrind (Ecthyma contagiosum), Schaf- und Ziegenpocken.
Mensch
Menschen werden aufgrund ihrer geringen Empfänglichkeit nur extrem selten von der Krankheit betroffen und bei Erkrankungen besteht eine günstige Prognose. Die Infektion erfolgt direkt durch Kontakt mit infizierten Tieren oder infolge einer Laborinfektion. Eine indirekte Übertragung über infizierte Rohmilch ist ebenfalls möglich, von pasteurisierter Milch und daraus hergestellten Produkten geht jedoch keine Gefahr aus.
Mit einer Inkubationszeit von zwei bis sechs Tagen verläuft die Krankheit ebenso wie bei Paarhufern als biphasisch-zyklische Infektion. Nach einer kurzen, mäßigen Fieberphase und unspezifischen Allgemeinsymptomen wie Übelkeit, Abgeschlagenheit, Kopf- und Gliederschmerzen können schmerzhafte Aphthen in der geröteten Mundschleimhaut, bevorzugt jedoch an der Haut von Händen (Fingerspitzen) und Füßen sowie im Genitalbereich, auftreten. Die nach Austrocknung der Aphthen entstehenden Hauterosionen heilen im Regelfall innerhalb von zehn Tagen vollständig ab.
Differentialdiagnostisch ist die gemeinhin als Hand-Fuß-Mund-Exanthem bezeichnete, ebenfalls viral bedingte Erkrankung abzugrenzen, die mit sehr ähnlichen Symptomen einhergeht. Sie wird häufiger beim Menschen, insbesondere bei Kleinkindern, beschrieben. Diese Krankheit wird von einem anderen Virus aus der Familie der Picornaviridae, dem Enterovirus Coxsackie A, hervorgerufen.
Pathologisch-anatomische Befunde
Außer den äußerlich sichtbaren Veränderungen finden sich weitere Aphthen verschiedener Abheilungsstadien in Schlund und Speiseröhre. An Pansenpfeilern und Psalterblättern sind oft nur schorfbedeckte Läsionen erkennbar. Bei fehlender Aphthenbildung in den Schleimhäuten treten katarrhalische Schwellungen oder kleinere Blutungen auf. Auch unter dem Epikard können petechiale Blutungen sichtbar sein. In Myokard und Skelettmuskulatur älterer Tiere können keine Läsionen beobachtet werden und das Virus scheint sich an diesen Stellen nur bei jungen Tieren zu vermehren. Die hohe Mortalität bei Jungtieren geht vermutlich auf eine akute Myokarditis zurück, die sich dem bloßen Auge durch venöse Stauung und große Blutgerinnsel, v. a. in der linken Herzkammer, offenbart. Die geschädigte Herzmuskulatur ist weich, schlecht kontrahiert und zeigt grauweiße Streifen und Flecken variabler Größe („Tigerherz“). Besonders betroffen sind linker Ventrikel und Herzscheidewand. Diese Erkrankungsform geht oft mit dem völligen Fehlen aphthöser Veränderungen an den üblichen Prädilektions-Stellen einher. Bei perakutem Verlauf können sogar sichtbare Veränderungen am Herzmuskel fehlen. Gelegentlich ist die Skelettmuskulatur ebenfalls von streifigen Veränderungen betroffen.
Histologisches Bild
Im Frühstadium können die Läsionen nur mikroskopisch sichtbar gemacht werden. Die ersten histologischen Veränderungen des Stratum spinosums sind gekennzeichnet von vakuolärer Degeneration, ansteigender eosinophiler Anfärbbarkeit des Zell-Zytoplasmas sowie der Bildung von Ödemen im interzellulären Raum. Daran schließen sich Zellnekrosen und eine reaktive Infiltration mit Leukozyten (Monozyten, Granulozyten) an. Aus den mittlerweile sichtbar werdenden Läsionen entwickeln sich durch Trennung des Epithels vom darunterliegenden Gewebe und durch Füllung der entstehenden Höhle mit klarer, vesikulärer Flüssigkeit die sog. Aphthen. In einigen Fällen kann die Flüssigkeitsmenge minimal sein. Das Epithel kann auch nekrotisch werden oder durch mechanische Traumata zerreißen, ohne dass Aphthenbildung stattfindet. Im Herzmuskel entsteht das histologische Bild einer lymphohistiozytären Myokarditis mit hyalin-scholliger Degeneration („Zenkersche Muskel-Degeneration“) und Nekrose der Herzmuskelzellen (Myozyten).
Diagnostik
Bei bestehendem MKS-Verdacht muss der tatsächliche Seuchenausbruch amtlich festgestellt werden. Nach § 1 der „Verordnung zum Schutz gegen die Maul- und Klauenseuche“ (MKS-VO) gilt ein Ausbruch der Seuche erst dann als erwiesen, wenn der Erreger-Nachweis in Form von Virus-Antigen oder viraler RNA vorliegt. Dies gilt auch im Falle fehlender klinischer Erscheinungen. Darüber hinaus ist der serologische Nachweis von Antikörpern gegen MKS bzw. eines Titeranstiegs bei nachweislich nicht-geimpften Tieren bindend. Besteht ein epizootiologischer Zusammenhang zu einem primären Seuchenherd (Sekundärausbruch), können die Ergebnisse klinischer oder pathologisch-anatomischer Untersuchungen alleine ausreichend sein.
Vor-Ort-Maßnahmen
Beim Rind ist das klinische Bild in der Regel deutlich ausgeprägt. Die Diagnosestellung bei kleinen Wiederkäuern ist oft durch inapparente sowie milde Verlaufsformen erschwert. Das Vorkommen plötzlicher Lahmheit eines Großteils der Herde mit zeitgleich erhöhter perakuter Mortalität neugeborener und/oder sehr junger Lämmer gibt erste Hinweise auf MKS noch vor dem pathognomonischen Nachweis der Aphthenbildung. In Schweinebeständen muss differentialdiagnostisch an MKS gedacht werden, sobald gehäuft Stützbeinlahmheiten in Verbindung mit Blasen an prädisponierten Bereichen für die Aphthenbildung auftreten.
Die gründliche Bestandsuntersuchung unter geeigneten Bedingungen (gute Beleuchtung, mechanische Reinigung verschmutzter Prädilektionsstellen) im Verdachtsfall, eine genaue Kenntnis des klinischen Bildes sowie eine ausreichend für das Seuchengeschehen sensibilisierte Tierärzteschaft sind Voraussetzung für ein schnelles Erkennen der Erkrankung.
Die MKS ist eine anzeigepflichtige Tierseuche. Im Verdachtsfall muss durch den Tierbesitzer, das Pflegepersonal oder den praktischen Tierarzt unverzüglich der Amtstierarzt hinzugezogen werden. Dieser untersucht den Bestand, zieht bei Bedarf Proben zur weiteren labordiagnostischen Abklärung und trifft zusätzliche erste tierseuchenrechtliche Anordnungen gemäß MKS-VO (siehe unter Maßnahmen).
Die entnommenen Proben müssen ohne Zeitverlust und auf dem schnellsten Wege (per Kurier oder Hubschrauber) an das nationale MKS-Referenzlabor weitergeleitet werden. Verdachtsproben sind der Untersuchungseinrichtung zuvor anzukündigen, damit die sofortige Weiterbearbeitung sichergestellt werden kann.
Zum Nachweis von infektiösem Virus, Antigen oder Nukleinsäure sind Lymphe sowie Deckenmaterial von frischen Aphthen am besten geeignet. Bei Fehlen von Aphthen können alternativ Tupfer vom Übergang zum gesunden Gewebe entnommen werden. Darüber hinaus sind Nasentupfer sowie bei getöteten Tieren Organproben (z. B. veränderte Bereiche von Pansenpfeilern, Herz und Euter) als Probenmaterial verwendbar. Die Proben werden mit PBS-Puffer sowie Glycerin versetzt und bei neutralem pH-Wert gekühlt versendet. Ist seit der Ansteckung mehr als eine Woche vergangen, ersetzt der Virusnachweis aus Rachenschleimproben (sog. „Probang“-Proben) die Tupferentnahme aus der Nase. Die Versendung dieser Proben muss tiefgekühlt erfolgen. Blutproben enthalten nicht nur Virus-Antikörper (ab 5. Tag nach der Infektion), sondern dienen auch dem Virusnachweis in der virämischen Phase. Vor allem bei kleinen Wiederkäuern ist die zusätzliche Einsendung von Serumproben Pflicht.
Labordiagnostische Verfahren
Zugelassene Nachweisverfahren in der MKS-Diagnostik sowie Referenz-Laborprotokolle für die Testdurchführung sind dem „Manual of Diagnostic Tests and Vaccines for Terrestrial Animals“; Kapitel 2.1.1. (Maul- und Klauenseuche) der OIE zu entnehmen. Auf nationaler Ebene sind in Deutschland Hinweise zur Diagnostik der MKS im „Bundesmaßnahmenkatalog Tierseuchen“, Teil III.2, niedergelegt.
Die MKS-Diagnostik darf aufgrund der hohen Erreger-Kontagiosität nur von Hochsicherheitslaboren der Sicherheitsstufe 4 vorgenommen werden. Das deutsche MKS-Referenzlabor ist Bestandteil des Friedrich-Loeffler-Instituts. Die deutsche Forschungsanlage befindet sich auf der Insel Riems. Das internationale Referenzlabor befindet sich am Institute of Animal Health in Pirbright, England.
Dringlichste Aufgabe der Labordiagnostik ist die Feststellung eines Primärausbruchs, um möglichst schnell die Keulung infizierter Bestände und Errichtung von Sperrmaßnahmen einleiten zu können. Nach Bestätigung des Verdachts erfolgt eine Charakterisierung des Virus, um eine eventuelle Impfstoffempfehlung aussprechen zu können. Darüber hinaus werden epidemiologische Studien auf molekulargenetischer Basis durchgeführt, um die geographische Herkunft des Erregers zu ermitteln („tracing back“). Die labordiagnostischen Methoden gliedern sich in Erregernachweis und Antikörpernachweis.
Erregernachweis
Schon der Nachweis viralen Antigens oder viraler Nukleinsäure des MKS-Erregers ist ausreichend für ein positives Untersuchungsergebnis.
Die bevorzugte Methode zum Virusantigen-Nachweis mit gleichzeitiger Bestimmung des Serotyps ist der Enzyme-linked Immunosorbent Assay (ELISA). Er hat aufgrund 10–100fach höherer Empfindlichkeit (bessere Sensitivität und Spezifität) und geringer Störanfälligkeit die klassische Komplementbindungsreaktion (KBR) als schnelle Nachweis-Methode (< 1 Tag) verdrängt. Die Durchführung erfolgt als indirekter, sog. „double-Sandwich-ELISA“. An die Mikrotiter-Test-Platte gebundene Kaninchen-Antikörper halten dabei das zu detektierende Virusantigen fest. Nach einem darauffolgenden Inkubationsschritt mit Meerschweinchen-Antikörpern wird die Antigen-Antikörper-Reaktion durch Hinzufügen eines Peroxidase-Konjugats und eines speziellen Substrats optisch sichtbar gemacht. Die acht Reihen der Mikrotiter-Platte enthalten jeweils Antiseren gegen die unterschiedlichen sieben bekannten MKS-Serotypen. Somit erlaubt der ELISA eine vorläufige Typendiagnose, die jedoch zur Sicherheit einer weiteren Bestätigung mit monoklonalen Antikörpern bedarf. In der freien achten Reihe kann parallel differentialdiagnostisch auf weitere virale Erreger (z. B. Vesikuläre Schweinekrankheit) untersucht werden. Fragliche Ergebnisse können nach Zellkulturpassage des Probenmaterials nochmals im ELISA-Wiederholungsansatz überprüft werden.
Nur 80 % aller Proben, die in der Zellkultur positiv sind, zeigen bereits im ELISA eine Reaktion. Aufgrund der gravierenden Konsequenzen bei bestätigtem Verdacht wird in Deutschland die Virusisolierung mittels Zellkultur stets parallel zum ELISA eingesetzt. Infektiöses Probenmaterial aus klinischen Verdachtsfällen wird hier in empfängliche Zellkulturen (z. B. Kälber-Schilddrüsen-Zellen, Hamster-Nieren-Zellen) oder in zwei bis sieben Tage alte Babymäuse inokuliert, um potentielles infektiöses Virus zu vermehren. Bis zum Auftreten eines zytopathogenen Effekts bzw. dem Tod des Versuchstieres vergehen mindestens ein bis drei Tage. Einer anschließenden Virus-Vermehrungsphase folgt die Identifizierung und Charakterisierung mittels ELISA oder Reverse Transkriptase-Polymerase-Kettenreaktion (RT-PCR).
Um eine zweite Labormethode mit einer der Zellkultur vergleichbaren Empfindlichkeit zur Verfügung zu haben, wurden Tests zum Nachweis viraler Nukleinsäure etabliert. Die RT-PCR kann verwendet werden, um Genomfragmente des MKS-Virus aus verschiedensten diagnostischen Materialien zu detektieren. In Kombination mit der real Time Quantitative PCR kann dabei eine Sensitivität erreicht werden, die mit der Virusisolation vergleichbar ist. Automatisierbare Prozess-Schritte ermöglichen hier einen höheren Probendurchsatz. Die klassischen PCRs dienten dem typenunabhängigen MKS-Nachweis, indem ein für alle Serotypen weitgehend konservierter Genombereich für die Amplifikation ausgewählt wurde. Der Einsatz spezifischer Primer erlaubt jedoch darüber hinaus eine sichere Unterscheidung der sieben Serotypen. In Gewebeproben ist der Nachweis viraler RNA auch mittels In-situ-Hybridisierung möglich. Diese Technik wird nur von wenigen, spezialisierten Laboren angewendet, obwohl vereinfachte Testsysteme für den „Feld-Gebrauch“ bereits in der Entwicklungsphase sind.
Das Virusgenom wird auch für die molekulare-Epidemiologie-Forschung genutzt. Grundlage ist der Vergleich genetischer Unterschiede einzelner Virusvarianten. Basierend auf den Sequenzierungsdaten des 1D-Gens (codiert für das virale Hüll-Protein VP1), wurden mittlerweile Stammbäume erstellt, die die genetische Verwandtschaft zwischen Impf- und Feldvirus-Stämmen aller sieben Serotypen zeigen. Viele Labore haben hier eigene Methoden entwickelt. Die Vervielfältigung der viralen RNA mittels RT-PCR, gefolgt von der Entschlüsselung der Nukleotid-Folge (Sequenzierung) ist in der Regel die Methode der Wahl zur Erstellung dieser Daten. Die Datenbanken der Referenzlabore enthalten mittlerweile mehr als 3000 Teilsequenzen.
Antikörpernachweis
Serologische Tests für MKS dienen überwiegend der Abklärung folgender Fragen: a) Zertifizierung für den Export bestimmter Tiere als frei von MKS-Infektion und Impfung; b). Bestätigung von Seuchenverdachtsfällen; c). Beweis für das Fehlen einer Infektion und d). Bestätigung der Wirksamkeit einer Impfung. Serologische Nachweisverfahren für MKS-Antikörper (Ak) gliedern sich in solche, die Immunglobuline gegen Strukturproteine (SP) erfassen und die, die gegen Nicht-Strukturproteine (NSP) gerichtete Antikörper detektieren.
Nachweis von Strukturprotein-Antikörpern
Der Virusneutralisationstest sowie verschiedene Arten von Antikörper-ELISAs („solid-phase competition ELISA“ (SPCE); „liquid-phase blocking ELISA“ (LPBE)) zum Nachweis von Strukturproteinen werden als serotyp-spezifische serologische Tests angewandt. Im internationalen Tierhandel sind sie vorgeschrieben. Sie erkennen Antikörper, die sowohl als Reaktion auf eine Impfung als auch durch natürliche MKS-Infektion gebildet werden. Folglich sind sie geeignet, Infektionen, die kürzlich stattfanden, in Nicht-Impflingen zu detektieren oder den Immunstatus einer Population bei Impfprogrammen zu überwachen.
Als hoch-sensitive Verfahren setzen sie eine starke Ähnlichkeit des zirkulierenden Feldstammes mit dem im Test verwendeten MKS-Virusantigen voraus. Unter Verwendung von poly- oder monoklonalen AK sind die ELISA-Tests vielseitig einsetzbar, schnell in der Durchführung und können auch mit inaktivierten Antigenen angesetzt werden. Falsch positive Reaktionen im ELISA sind bei einem kleinen Prozentsatz von Proben im niedrigen Titerbereich zu erwarten. Der Virusneutralisationstest ist abhängig vom Einsatz von Zellkulturen und deshalb weniger vielseitig. Er dauert außerdem länger (vier Tage) und ist anfälliger für Kontaminationen. Ein kombinierter Einsatz des ELISA als Screening-Methode mit anschließender Überprüfung von Reagenten im VNT reduziert die Wahrscheinlichkeit falsch positiver Ergebnisse auf ein Minimum.
Nachweis von Nicht-Strukturprotein-Antikörpern
Tests auf Antikörper gegen Nicht-Strukturproteine sind nützlich für den Nachweis einer kürzlichen oder noch andauernden Virusreplikation im Wirt, ungeachtet seines Impfstatus. Nicht-Strukturproteine sind im Gegensatz zu Strukturproteinen innerhalb der Spezies MKS-Virus hochkonserviert. Der Nachweis dieser Antikörper ist folglich nicht serotyp-spezifisch, was als Nachweisverfahren auf internationaler Ebene von Vorteil ist.
Traditioneller Test zur Detektion von MKS-NSP war der Immundiffusionstest. Er diente dem Nachweis von „virus infection associated antigen“ (VIAA) mit der Hauptkomponente Protein 3D. Letztere kann jedoch auch von Impflingen gebildet werden.
Moderne Verfahren verwenden die gentechnisch hergestellten Proteine 3ABC und 3AB. Antikörper gegen diese Proteine werden generell als verlässliche Indikatoren für eine MKS-Infektion gesehen, da sie experimentell eine hohe Immunogenität aufweisen. Antikörper gegen exprimierte rekombinante Virus-NSP (z. B. 3A, 3B, 2B, 2C, 3ABC) können durch verschiedene ELISA-Varianten oder durch Immunoblotting nachgewiesen werden. Drei indirekte ELISA-Verfahren sind für MKS zugelassen (Südamerika, Dänemark, Brescia). Diese ELISAs verwenden entweder gereinigte Antigene, die direkt an die Test-Platte gebunden sind oder nutzen polyklonale/monoklonale Antikörper, um spezifische Antigene aus halbaufgereingten Präparationen zu „fangen“.
Der Enzyme-linked Imunoelectrotransfer Blot Assay (EITB) wurde 1993 erstmals publiziert. Er findet breite Anwendung in Südamerika, wo er auch als Bestätigungstest für im ELISA-Screening auffällige Reagenten gilt.
Die Verfahren weisen eine Spezifität von 99 % auf. Ein Mangel an Reinheit der Impfstoffe kann die diagnostische Spezifität jedoch negativ beeinflussen. Die Anwesenheit von NSP in einigen Vakzine-Zubereitungen kann zu einer fehlerhaften Zuordnung solcher Tiere führen, die bereits wiederholt geimpft wurden.
Die Test-Sensitivität gilt als nicht zufriedenstellend bei experimentell vakzinierten Rinder, die einer Feldvirus-Infektion ausgesetzt wurden und danach Viruspersistenz aufwiesen (geimpfte „Carrier“). Sie weisen nur eine lokale Immunantwort, nicht jedoch Immunglobuline G gegen NSP auf. Ein Aufspüren von Carrier-Tieren scheint jedoch über Ig A aus dem Speichel möglich. Diese Antikörper werden offensichtlich nur von tatsächlich infizierten Tieren über einen längeren Zeitraum gebildet.
Bekämpfungsmaßnahmen


Bis 31. Dezember 1991 wurden in der EU zur Verhinderung einer MKS-Epidemie Pflichtimpfungen der Rinderbestände durchgeführt. Impfungen führen zu ernsthaften Handelshindernissen: Geimpfte haben wie infizierte Tiere Antikörper im Blut und können so nur bei besonders markierten Impfstoffen voneinander abgegrenzt werden. Zudem besteht die Gefahr der Erregerausbreitung über geimpfte Tiere. Daher wurden Impfungen durch die EU unterbunden. Auch Therapiemaßnahmen sind grundsätzlich nicht erlaubt.
Bei einem MKS-Verdacht wird der betroffene Betrieb gesperrt, Schafe werden meist vorsorglich gekeult und Proben auf MKS untersucht. Weiterhin werden ein Sperrbezirk von mindestens drei Kilometer Umkreis eingerichtet, alle Tierbestände auf MKS untersucht und Tiertransporte verboten.
Bestätigt sich der Verdacht, wird der Bestand gekeult und unschädlich beseitigt, ebenso wie die Nachbarbestände in einem Umkreis von einem Kilometer. Im drei Kilometer großen Sperrbezirk dürfen 15 Tage lang keine Tiere oder Sperma transportiert werden, die Straßen werden gesperrt. Nach diesen 15 Tagen sind Transporte von Tieren nur mit Genehmigung erlaubt (die Tiere dürfen nur zur Schlachtung transportiert werden). Milch darf nur zur gesonderten Verarbeitung verwendet werden. In einem Radius von 10 km um den Seuchenausbruch wird ein Beobachtungsgebiet eingerichtet. Dort dürfen Tiere mit Genehmigung innerhalb des Gebietes transportiert werden. Falls innerhalb von 30 Tagen nach dem Seuchenfall keine weiteren Erkrankungen aufgetreten sind, wird eine Ratten- und Mäusebekämpfung und eine Reinigung und Desinfektion durchgeführt.
Da das Virus sehr widerstandsfähig ist, kann es noch monatelang im Boden, Stall, Abfällen und Stroh überdauern. Bei Befall muss deshalb eine umfangreiche Desinfektion mit Ameisensäure oder durch Hitze (mindestens 60 °C) erfolgen.
Oftmals werden bereits Maßnahmen, wie ein Verbot von Tiertransporten, ergriffen, wenn eine MKS-Epidemie im benachbarten Ausland auftritt. Wegen der hohen Widerstandsfähigkeit werden bei größeren Epidemien sogar die Räder von Autos beim Grenzübertritt desinfiziert.
Epizootien
Europa war häufig von MKS-Epizootien oder gar Panzootien betroffen. Besonders schwere Seuchenzüge gab es 1910–1912, 1919–1921, 1937–1939 und 1950–1952.
In Großbritannien brach im Februar 2001 eine Epizootie aus. Im Verlauf dieses Seuchenausbruchs, der vereinzelt auch auf das europäische Festland übergriff, kam es zur Keulung von mehr als vier Millionen Tieren. Erst am 14. Januar 2002, nach drei Monaten ohne Meldungen über neue Fälle, wurde die Insel wieder als frei von der Seuche erklärt.
Es kommt immer wieder zu vereinzelten Ausbrüchen im übrigen Europa, in Afrika, Asien und Südamerika wie zuletzt am 3. August 2007 in Surrey (Großbritannien).[15]
Literatur
- Wolfgang Bisping: Kompendium der staatlichen Tierseuchenbekämpfung. Stuttgart: Enke 1999, ISBN 3-7773-1423-4, S. 101–104
- Hans Plonait, Klaus Bickhardt (Hrsg.): Lehrbuch der Schweinekrankheiten. 2., neubearb. Aufl. Berlin: Parey 1997, ISBN 3-8263-3149-4, S. 66–68
- Hartwig Bostedt; Kurt Dedié: Schaf- und Ziegenkrankheiten. 2., neubearb. und erw. Aufl. Stuttgart: Ulmer 1996, ISBN 3-8252-8008-X, S. 35–37 (Erkrankungen der Haustiere; UTB für Wissenschaft: Große Reihe)
- Gustav Rosenberger (Hrsg.): Krankheiten des Rindes. 3., unveränd. Aufl. Berlin [u. a.]: Blackwell-Wiss.-Verl. 1994, ISBN 3-8263-3029-3, S. 835–843 (Blackwell Wissenschaft)
- Winfried Hofmann, Hartwig Bostedt: Rinderkrankheiten. Bd. 1: Innere und chirurgische Erkrankungen. Stuttgart: Ulmer 1992, ISBN 3-8252-8044-6, S. 243f. (Erkrankungen der Haustiere)
- Anton Mayr (Hrsg.): Rolle/Mayr. Medizinische Mikrobiologie, Infektions- und Seuchenlehre für Tierärzte, Biologen und Agrarwissenschaftler und Interessierte aus benachbarten Fachgebieten: Lehrbuch für Praxis und Studium. 6., neu bearb. Aufl. Stuttgart: Enke 1993, ISBN 3-432-84686-X, S. 311–317.
- Tierkrankheiten in den Tropen und Subtropen. Ed. by the British Veterinary Association. Konstanz: Terra-Verlag 1968, S. 51–57.
- Joachim Beer: Maul- und Klauenseuche. In: J. Beer (Hrsg.): Infektionskrankheiten der Haustiere. Jena: Fischer-Verlag 1974.
Einzelnachweise
- ↑ Karl Wurm, A. M. Walter: Infektionskrankheiten. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 9–223, hier: S. 209 f.
- ↑ a b FLI: Maul- und Klauenseuche: Amtliche Methode und Falldefinition
- ↑ Daniel Baumann, Daniel Freudenreich: Ein Viruspartikel reicht für eine Infektion aus. In: Berliner Zeitung. 7. August 2007, abgerufen am 19. Juni 2015.
- ↑ Volker Griese: Eine Pandemie »geradezu katastrophaler« Dimension: Die Maul- und Klauenseuche 1911. Verlag: BOD 2024, 104 Seiten, ISBN 978-3-7583-6925-4
- ↑ NÖN: 3.732 Rinder mussten gekeult werden, Woche32/2013
- ↑ Volker Griese: Eine Pandemie »geradezu katastrophaler« Dimension: Die Maul- und Klauenseuche 1911. Verlag: BOD 2024, 104 Seiten, ISBN 978-3-7583-6925-4
- ↑ Tierseuchenbericht 2011 des BMELV. In: Deutsches Tierärzteblatt. (DTBL) 60. Jahrgang, Mai 2012, S. 714–715.
- ↑ Maul- und Klauenseuche in Grossbritannien In: Zeitblende von Schweizer Radio und Fernsehen vom 19. Februar 2011 (Audio)
- ↑ ADNS (Animal Disease Notification System): Animal disease situation per country and per disease, verschiedene Jahrgänge.
- ↑ Urs Amacher: Viehseuchen. In: Historisches Lexikon der Schweiz. 15. Januar 2014.
- ↑ Maul- und Klauenseuche
- ↑ Schweizerische Vereinigung für Geschichte der Veterinärmedizin SVGVM: Maul- und Klauenseuche-Bekämpfung im 20. Jahrhundert ( vom 1. Januar 2016 im Internet Archive)
- ↑ Keystone: Maul- und Klauenseuche (1965/1966) ( des vom 30. November 2018 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ OIE: OIE Members' official FMD status map
- ↑ Vom Labor in den Stall. In: Stern. 6. August 2007, abgerufen am 25. Dezember 2014.
Weblinks
Auf dieser Seite verwendete Medien
Autor/Urheber: Monster4711, Lizenz: CC0
Schild Maul- und Klauenseuche, Syke
Autor/Urheber: Flominator, Lizenz: CC BY-SA 3.0
Maul- und Klauenseuche-Schild im Freilichtmuseum Neuhausen ob Eck
Schild Maul- und Klauenseuche, Sperrbezirk, Mannheim-Käfertal, 1960er Jahre, Größe 50 x 33 cm
Autor/Urheber: OTFW, Berlin, Lizenz: CC BY-SA 3.0
Gedenktafel, Friedrich Loeffler und Paul Frosch, Unterbaumstraße, Berlin-Mitte, Deutschland
Schild Maul- und Klauenseuche, Durchfahrtsverbot, Mannheim-Käfertal, 1960er Jahre, Größe 50 x 33 cm






