Mangan(II)-nitrat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
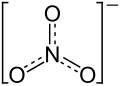 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Mangan(II)-nitrat | ||||||||||||||||||
| Summenformel | Mn(NO3)2 | ||||||||||||||||||
| Kurzbeschreibung | blassrosafarbener Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 178,94 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest[1] | ||||||||||||||||||
| Dichte | 2,13 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | 129 °C[1] | ||||||||||||||||||
| Löslichkeit | sehr gut in Wasser (3800 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | 0,5 mg·m−3[1] | ||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Mangan(II)-nitrat ist das Nitratsalz des Mangans mit der Summenformel Mn(NO3)2.
Gewinnung und Darstellung
Mangan(II)-nitrat kann durch Lösung von Mangan(II)-carbonat in verdünnter Salpetersäure dargestellt werden:
Ebenfalls möglich ist die Herstellung durch Reaktion von Mangan(IV)-oxid mit Stickstoffdioxid.[3]
Eigenschaften
Mangan(II)-nitrat ist ein blass rosafarbener, hygroskopischer Feststoff, welcher sehr gut in Wasser löslich ist. Er zersetzt sich ab einer Temperatur von 140 °C.[1] Mangan liegt hier in der Oxidationsstufe +2 vor. Das Salz bildet je nach Herstellungsmethode und Temperatur ein Monohydrat, ein Tetrahydrat oder ein Hexahydrat.[4] Es ist wie viele andere Nitrate ein Oxidationsmittel und wirkt brandfördernd.
Verwendung
Mangan(II)-nitrat wird zur Herstellung von hochreinen Manganoxiden, Spinellen und Porzellanfarben verwendet.[1] Zudem wird es im Getreideanbau als Blattdünger zur Förderung der Wurzelbildung eingesetzt.[5]
Einzelnachweise
- ↑ a b c d e f g h i j k Eintrag zu Mangan(II)-nitrat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ H. Schmit, C. Rathgeber, P. Hennemann, S. Hiebler: Three–step method to determine the eutectic composition of binary and ternary mixtures - Tested on two novel eutectic phase change materials based on salt hydrates. In: J. Therm. Anal. Calorim. 117, 2014, S. 595–602.
- ↑ Arno H. Reidies: Manganese Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2002. doi:10.1002/14356007.a16_123
- ↑ ABC Chemie. Verlag Harri Deutsch, Frankfurt am Main / Zürich 1965.
- ↑ Mangan im Getreide. ( vom 6. Februar 2006 im Internet Archive) auf: agrarservice.de
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Struktur des Mn2+-Ions
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Nitrat-Anion
Die Zahl 2









