Mangan(II)-fluorid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
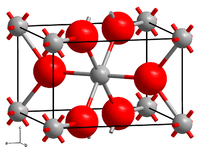 | ||||||||||||||||
| _ Mn2+ _ F− | ||||||||||||||||
| Kristallsystem | tetragonal[1] | |||||||||||||||
| Raumgruppe | P42/mnm (Nr. 136)[2] | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Mangan(II)-fluorid | |||||||||||||||
| Andere Namen | Mangandifluorid | |||||||||||||||
| Verhältnisformel | MnF2 | |||||||||||||||
| Kurzbeschreibung | rosafarbener Feststoff[3] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 92,93 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest[3] | |||||||||||||||
| Dichte | 3,98 g·cm−3 (25 °C)[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | 1820 °C[4] | |||||||||||||||
| Löslichkeit | wenig löslich in Wasser (10 g·l−1)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Mangan(II)-fluorid ist eine chemische Verbindung des Mangans und zählt zu den Fluoriden.
Gewinnung und Darstellung
Mangan(II)-fluorid kann durch Reaktion von Mangancarbonat mit Flusssäure gewonnen werden.[1] Es wurde bereits 1824 von Jöns Jakob Berzelius auf diese Art erhalten.[5]
Es kann auch direkt aus den Elementen dargestellt werden.[6]
Das Tetrahydrat entsteht durch langsames Verdunsten einer wässrigen Lösung von Mangan(II)-fluorid.[5]
Eigenschaften

Mangan(II)-fluorid bildet rosafarbene quadratische Prismen und ist wenig löslich in Wasser, löslich in verdünnter Flusssäure und leicht löslich in konzentrierter Salzsäure und Salpetersäure. Es ist ein Antiferromagnet und besitzt eine tetragonale Kristallstruktur vom Rutil-Typ mit der Raumgruppe P42/mnm (Raumgruppen-Nr. 136) und den Gitterkonstanten a = b = 487,3 pm und c = 313,0 pm.[1][2] Seine Néel-Temperatur beträgt 68 K[7]. Die Verbindung bildet mit Alkalifluoriden Fluorokomplexe M1MnF3 mit Perowskitstruktur und M1MnF4.[8]
Verwendung
Mangan(II)-fluorid kann als Katalysator bei Pyridinsynthesen verwendet werden.[9]
Weblinks
Einzelnachweise
- ↑ a b c d Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 268.
- ↑ a b Z. Yamani, Z. Tun, D. H. Ryan: Neutron scattering study of the classical antiferromagnet MnF2: a perfect hands-on neutron scattering teaching courseSpecial issue on Neutron Scattering in Canada. In: Canadian Journal of Physics. 88, 2010, S. 771–797, doi:10.1139/P10-081.
- ↑ a b c d e f Datenblatt Manganese(II) fluoride, 98% bei Sigma-Aldrich, abgerufen am 7. Juli 2012 (PDF).
- ↑ AMERICAN ELEMENTS: Manganese Fluoride
- ↑ a b Leopold Gmelin, Michael Dub, Patrick J. Lennon, Richard Joseph Meyer: Gmelin handbook of inorganic chemistry. Springer, 1977, S. 5 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ webelements: WebElements Periodic Table of the Elements | Manganese | chemical reaction data
- ↑ G.P. Felcher, R. Kleb: Antiferromagnetic domains and the spin-flop transition of MnF2 In: Europhys. Lett. 36, 455 (1996)doi:10.1209/epl/i1996-00251-7.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1483.
- ↑ S. Shimizu, N. Watanabe, T. Kataoka, T. Shoji, N. Abe, S. Morishita, H. Ichimura: Pyridine and Pyridine Derivatives. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005.
Auf dieser Seite verwendete Medien
Manganese(II) fluoride, MnF2
Autor/Urheber: Solid State, Lizenz: CC BY-SA 3.0
Kristallstruktur von Rutil (Titan(IV)-oxid, TiO2). Kristallographische Daten: https://dx.doi.org/10.1107/S0365110X56001388


