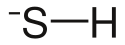Magnesiumhydrogensulfid
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| Allgemeines | |||||||
| Name | Magnesiumhydrogensulfid | ||||||
| Summenformel | Mg(HS)2 | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 90,45 g·mol−1 | ||||||
| Löslichkeit | löslich in Wasser[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Magnesiumhydrogensulfid ist eine nur in wässriger Lösung beständige, chemische Verbindung.[3] Sie besteht aus Magnesium-Ionen (Mg2+) sowie dem Hydrogensulfid-Ion (HS−).
Gewinnung und Darstellung
Magnesiumhydrogensulfid bildet sich bei Kontakt von Magnesiumsulfid mit Wasser oder Feuchtigkeit, wobei Magnesiumhydroxid und Magnesiumhydrogensulfid entstehen:[3]
Verwendung
Magnesiumhydrogensulfid wird unter anderem zur Herstellung von reinem Schwefelwasserstoff (H2S) oder dessen Reinigung im labortechnischen Bereich verwendet.[1][4]
Dies kann auch zur Bestimmung des Alkalisulfidgehaltes von Stoffgemischen verwendet werden, in dem man das Stoffgemisch mit Magnesiumchlorid in Kohlensäure und Wasser erhitzt, wobei Schwefelwasserstoff entsteht.[5]
Einzelnachweise
- ↑ a b Y. Mido & Iqbal: Chemistry Of S Block Elements. Discovery Publishing House, 1994, ISBN 978-81-7141-241-9, S. 104 (books.google.de).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b F. G. REICHEL: Inorganic chemistry. In: Journal of the Chemical Society. Band 29, Nr. 0, 1. Januar 1876, doi:10.1039/JS8762900038.
- ↑ Elemente der zweiten Nebengruppe: Zink - Cadmium - Quecksilber. Springer-Verlag, 2013, ISBN 978-3-642-48019-5, S. 273 (books.google.de).
- ↑ Rudolf Sieber: Die Chemisch-Technischen Untersuchungs-Methoden der Zellstoff- und Papier-Industrie. Springer-Verlag, 2013, ISBN 978-3-642-92265-7, S. 152 (books.google.de).
Auf dieser Seite verwendete Medien
Struktur des Hydogensulfid-Ions
Struktur des Mg2+-Ions