Methylentetrahydrofolat-Reduktase
| Methylentetrahydrofolat-Reduktase | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 656 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Kofaktor | FAD | |
| Bezeichner | ||
| Gen-Name | MTHFR | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.5.1.20, Oxidoreduktase | |
| Reaktionsart | Übertragung eines Reduktionsäquivalents | |
| Substrat | 5,10-Methylen-FH4 + NAD(P)+ | |
| Produkte | 5-Methyl-FH4 + NAD(P)H | |
| Vorkommen | ||
| Homologie-Familie | MTHFR | |
| Übergeordnetes Taxon | Wirbeltiere | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 4524 | 17769 |
| Ensembl | ENSG00000177000 | ENSMUSG00000029009 |
| UniProt | P42898 | Q9WU20 |
| Refseq (mRNA) | NM_005957 | NM_001161798 |
| Refseq (Protein) | NP_005948 | NP_001155270 |
| Genlocus | Chr 1: 11.79 – 11.81 Mb | Chr 4: 148.04 – 148.06 Mb |
| PubMed-Suche | 4524 | 17769 |
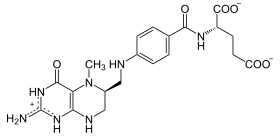
Methylentetrahydrofolat-Reduktase (MTHFR) ist dasjenige Enzym in Wirbeltieren, das 5,10-Methylen-FH4 mithilfe von NAD(P)H zu 5-Methyl-FH4 reduziert. Da so das Methylierungsmittel 5-Methyl-FH4 zur Verfügung gestellt wird, ist MTHFR bei vielen Stoffwechselwegen unentbehrlich, unter anderem beim Abbau des schädlichen Homocystein zu Methionin, und bei der bakteriellen Methanbildung.[1][2]
Das kodierende Gen MTHFR wird vom Mensch in vielen Gewebetypen exprimiert und das Protein anschließend ins Blut abgegeben. Varianten des und Mutationen im MTHFR-Gen können zu vermehrter, vor allem aber zu verringerter Produktion und Wirksamkeit des MTHFR-Enzyms führen. Enzymmangel bei Schwangeren kann Ursache für Neuralrohrfehlbildungen wie Spina bifida beim Neugeborenen sein; weiterhin kann MTHFR-Mangel zu Homocystinurie führen und das Risiko für Schlaganfall oder Darmkrebs erhöhen.[1][3][4][5][6]
Katalysierte Reaktion
5,10-Methylen-FH4 wird zu 5-Methyl-FH4 reduziert. Die Enzymaktivität wird allosterisch durch S-Adenosylmethionin reguliert.[1]
Weblinks
- Enzym – 1.5.1.20 in der Kyoto Encyclopedia of Genes and Genomes
- reactome.org: Metabolism of folate and pterines
Einzelnachweise
- ↑ a b c UniProt P42898
- ↑ Methylierung von Corrinoid Reaktion – R02289 in der Kyoto Encyclopedia of Genes and Genomes.
- ↑ M. Sawabe, T. Arai, A. Araki u. a.: Smoking confers a MTHFR 677C>T genotype-dependent risk for systemic atherosclerosis: results from a large number of elderly autopsy cases that died in a community-based general geriatric hospital. In: J. Atheroscler. Thromb. Band 16, Nr. 2, April 2009, S. 91–104, PMID 19403988.
- ↑ C. Antoniades, C. Shirodaria, P. Leeson u. a.: MTHFR 677 C>T Polymorphism reveals functional importance for 5-methyltetrahydrofolate, not homocysteine, in regulation of vascular redox state and endothelial function in human atherosclerosis. In: Circulation. Band 119, Nr. 18, Mai 2009, S. 2507–2515, doi:10.1161/CIRCULATIONAHA.108.808675, PMID 19398669.
- ↑ Y. I. Kim: Methylenetetrahydrofolate reductase polymorphisms, folate, and cancer risk: a paradigm of gene-nutrient interactions in carcinogenesis. In: Nutr. Rev. Band 58, Nr. 7, Juli 2000, S. 205–209, PMID 10941256.
- ↑ Y. I. Kim: Role of the MTHFR polymorphisms in cancer risk modification and treatment. In: Future Oncol. Band 5, Nr. 4, Mai 2009, S. 523–542, doi:10.2217/fon.09.26, PMID 19450180.
Auf dieser Seite verwendete Medien
Struktur von 5,10-Methylen-5,6,7,8-tetrahydrofolat (5,10-Methynen-THF)
Struktur von 5-Methyl-5,6,7,8-tetrahydrofolat (5-Methyl-THF)