Afrikanische Elefanten
| Afrikanische Elefanten | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Familiengruppe des Afrikanischen Elefanten (Loxodonta africana) in der Serengeti | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Loxodonta | ||||||||||||
| Anonym, 1827 |
Die Afrikanischen Elefanten (Loxodonta) sind eine Gattung der Elefanten (Elephantidae). Sie enthält mit dem Afrikanischen Elefanten (L. africana) und dem Waldelefanten (L. cyclotis) zwei der drei rezenten Elefantenarten. Die dritte stellt der Asiatische Elefant (Elephas maximus) dar, der sich von den Elefanten Afrikas in mehreren anatomischen Details unterscheidet. Beide Arten kommen auf dem afrikanischen Kontinent vor. Erstere bewohnt eine Vielzahl verschiedener Landschaftsräume, letztere ist in waldreichen Habitaten beheimatet. Die Tiere leben in Sozialverbänden mit komplexen Verwandtschaftsverhältnissen und variantenreicher Kommunikation. Sie wandern in einem jährlichen Rhythmus, der weitgehend vom Nahrungsangebot bestimmt wird. Ernährungsgrundlage bilden harte und weiche Pflanzenteile, die Zusammensetzung der Nahrung variiert regional und saisonal. Die Fortpflanzung erfolgt ganzjährig, wobei zumeist ein Kalb pro Muttertier geboren wird. Die Brunft der Kühe setzt in einem mehrjährigen Abstand ein, Bullen kommen einmal jährlich in die Musth. Die Stammesgeschichte der Afrikanischen Elefanten reicht mehrere Millionen Jahre in die Vergangenheit. Sie differenzierten sich als Gattung im Übergang vom Miozän zum Pliozän heraus. Es sind mehrere ausgestorbene Arten belegt, die allesamt ein afrikanisches Verbreitungsgebiet besaßen. Der heute gültige Gattungsname wurde im Jahr 1827 etabliert, basiert aber auf einem älteren Namensvorschlag. Der Gesamtbestand der Afrikanischen Elefanten gilt als gefährdet.
Merkmale
Habitus

Die beiden heutigen Arten der Gattung Loxodonta zeichnen sich durch den typischen Körperbau der Elefanten, der aus einem kompakten Körper mit säulenförmigen Beinen, kurzen Hals und massigen Kopf mit Stoßzähnen in der oberen Zahnreihe und typischer Rüsselbildung besteht. Der Afrikanische Elefant (Loxodonta africana) ist der größere der beiden Vertreter und repräsentiert das größte landlebende Säugetier der heutigen Zeit, der Waldelefant (Loxodonta cyclotis) ist kleiner und kann als typische Waldform angesehen werden. Vom Asiatischen Elefanten (Elephas maximus) unterscheiden sich die Afrikanischen Elefanten in erster Linie durch einzelne äußerliche Merkmale. Hinsichtlich der Körpergröße steht der Asiatische Elefant zwischen den beiden anderen Arten. Zu den anatomischen Unterschieden gehören unter anderem die höheren Schultern. Der höchste Punkt der Afrikanischen Elefanten sind die Schultern, der Rücken ist konkav ausgebildet. Beim Asiatischen Elefanten ist der höchste Punkt hingegen der Kopf, während der Rücken gerade oder konvex verläuft. Die Ohren der afrikanischen Elefanten sind, im Verhältnis zum Kopf, sehr viel größer als die des Asiatischen Elefanten. An der Rüsselspitze tragen Afrikanische Elefanten zwei gegenüberliegende Rüsselfinger, während der Asiatische Elefant nur einen besitzt. Zudem haben bei Loxodonta in der Regel beide Geschlechter ausgeprägte Stoßzähne, beim Asiatischen Elefanten häufig nur die Bullen. Bei allen heutigen Elefanten weisen die Hände und Füße jeweils fünf Strahlen auf mit einem sechsten zusätzlichen Knorpelstrahl (Präpollex und Prähallux).[1][2] Sie sind in einer runden bis ovalen Sohle ohne äußerlich getrennte Finger oder Zehen eingebettet. An der vorderen Außenseite bestehen aber nagelartige Strukturen, deren Anzahl an Vorder- und Hinterfüßen häufig zur Unterscheidung der Arten herangezogen werden. Allerdings variiert die Anzahl stark. Der Afrikanische Elefant besitzt so häufig je vier an den Händen und drei an den Füßen. Innerhalb einzelner Populationen variiert der Wert jedoch zwischen fünf und vier an den vorderen und drei und vier an den hinteren Füßen. Beim Waldelefanten liegen die entsprechenden Werte bei fünf vorn und vier hinten, ebenso beim Asiatischen Elefanten.[3][4][5]
Schädel- und Gebissmerkmale
In Bezug auf die Schädelanatomie und Zahnmorphologie stellen die Afrikanischen Elefanten gegenüber dem Asiatischen die konservativeren Formen dar. Allen Vertretern der Gattung Loxodonta gemein ist ein rundlicher Schädel, der nicht so nach oben gestreckt erscheint wie beim Asiatischen Elefanten. Die Stirnlinie wölbt sich in Vorderansicht auf oder verläuft weitgehend gerade, während der Asiatische Elefant dort zwei Buckel mit einer tiefen Eindellung dazwischen besitzt. Weitere Merkmale finden sich in den nicht verlängerten Scheitelbeinen und den am Ende divergierenden Alveolen der oberen Stoßzähne. Ein auffälliges Kennzeichen aller Elefantenarten findet sich in den luftgefüllten, bienenwabenförmigen Kammern, die die Schädeldecke ausfüllen. Durch diese Pneumatisierungen vergrößert sich die Oberfläche des Schädels, wodurch mehr Ansatzfläche für die Nacken- und Kaumuskulatur zur Verfügung steht, gleichzeitig vermindert sie das Gesamtgewicht des Schädels. Der Unterkiefer verfügt im Vergleich zum Asiatischen Elefanten über einen gestreckten horizontalen Knochenkörper. Der aufsteigende Ast strebt senkrecht nach oben, während sich der Kronenfortsatz in der zweiten Hälfte des Unterkiefers befindet. Beim Asiatischen Elefanten ist der aufsteigende Ast nach innen gerichtet und der Kronenfortsatz erhebt sich über der Mitte des stark gestauchten horizontalen Knochenkörpers. Die Symphyse am vorderen Ende des Unterkiefers ist bei den Vertretern der Gattung Loxodonta nach vorn orientiert und nicht nach unten wie beim asiatischen Vetter.[4][6][7]

Das Gebiss zeigt den typischen Aufbau der Elefanten. Es setzt sich im vorderen Gebiss aus den oberen Stoßzähnen, die den jeweils zweiten Schneidezahn repräsentieren, und im hinteren Gebiss aus je drei Prämolaren und drei Molaren je Kieferbogen zusammen. Die Zahnformel lautet demzufolge: , die Anzahl der Zähne beträgt 26. Bedingt durch die Form der Stoßzahnalveolen ragen die Stoßzähne bei den Afrikanischen Elefanten seitlich schräg nach unten. Sie sind außerdem über ihre gesamte Länge leicht gekrümmt und nicht wie beim Asiatischen Elefanten nur im letzten Drittel. Im hinteren Gebiss werden die Zähne horizontal gewechselt, ein typisches Charakteristikum zahlreicher Rüsseltiere, das sich vom vertikalen Zahnwechsel der meisten anderen Säugetiere unterscheidet. Dadurch befindet sich in der Regel nur ein oder anderthalb Zähne je Kieferast gleichzeitig in Kauposition, ein nachfolgender Zahn schiebt sich durch das Abkauen des voranliegenden Zahnes heraus. Der horizontale Zahnwechsel führt dazu, dass die heutigen Elefanten im Laufe des Lebens und nach der Eruption des ersten Zahns fünfmal den Zahn in jedem Kieferbogen austauschen können. Generell sind die hinteren Zähne bei den Elefanten durch einen lamellenartigen Aufbau bestehend aus mehreren hintereinanderliegenden Schmelzfalten charakterisiert. Bei den Afrikanischen Elefanten zeigen sich die Schmelzfalten dicker und weniger eng gesetzt als beim Asiatischen, so dass letzterer durchschnittlich mehr aufweist. Die Lamellenformel der Afrikanischen Elefanten lautet 4 bis 5 (Anzahl der Lamellen auf 10 cm Zahnlänge), auf dem jeweils letzten Molaren können 10 bis 14 Schmelzfalten auftreten. Auffälligster Unterschied der Afrikanischen Elefanten zum Asiatischen Elefanten ist die in der Mitte rautenförmige Ausbuchtung der Schmelzfalten. Die Zähne sind außerdem weniger hochkronig als beim Asiatischen Elefanten, die Höhe eines Zahns übertrifft in nur geringem Maße dessen Breite.[4][6][7]
Verbreitung
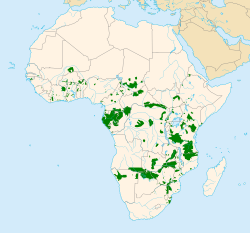
Die Afrikanischen Elefanten sind heute auf das Afrika südlich der Sahara beschränkt. Der Afrikanische Elefant bewohnt unterschiedlichste Landschaftsräume, die von teils geschlossenen Wäldern über offene Gras- und Savannenlandschaften, Feuchtgebiete wie Überflutungsflächen oder Sümpfe bis hin zu wüstenartigen Arealen reichen und sich sowohl in Tieflands- als auch in höheren Gebirgslagen bis über 4000 m befinden können. Sein Verbreitungsgebiet umfasst den östlichen, südlichen und westlichen Teil des Kontinentes. Der Waldelefant ist dagegen an die tropischen Regenwälder des zentralen und des westlichen Afrikas angepasst. Beide Elefantenarten hybridisieren im Kontaktbereich ihrer jeweiligen Lebensräume.[8][9][10] Die gesamte, von den Afrikanischen Elefanten bewohnte Fläche wird mit rund 5,2 Millionen Quadratkilometern angegeben, dies macht aber nur rund 20 % des nutzbaren Lebensraumes aus.[11]
Lebensweise
Territorialverhalten
Die Lebensweise der Afrikanischen Elefanten ist vor allem für die größere Savannenform, in geringerem Maße auch für die kleineren Waldform umfangreich erforscht. Die Tiere leben in Sozialverbänden, die Kerneinheit bildet die Herde oder Familiengruppe bestehend aus einer oder mehreren, häufig miteinander verwandten Kühen und deren Nachwuchs. Die Herde führt eine Leitkuh an, die einzelnen Rangstufen sind linear organisiert. Dadurch übernimmt nach dem Tod der Leitkuh zumeist die älteste Tochter die Gruppe. Mitunter können sich größere Verbände dann auch in einzelne kleinere aufspalten. Mehrere Herden wiederum bilden übergeordnet Clans, die häufig ähnliche Aktionsräume nutzen. In gewissen Abständen treffen sich die einzelnen, zusammengehörigen Familiengruppen und trennen sich nach einer Weile wieder. Die Lebensweise wird als fission-fusion-Sozialgemeinschaft („Trennen und Zusammengehen“) bezeichnet. Die Bullen des Afrikanischen Elefanten formen wiederum „Junggesellenverbände“, während die des Waldelefanten in der Regel einzelgängerisch leben. Die Aktionsräume haben je nach Landschaft unterschiedliche Ausdehnungen. Sie sind in offenen Gebieten generell ausgedehnter mit den größten in trockenen bis wüstenartigen Lebensräumen. In Waldhabitaten weisen sie dagegen geringere Größen auf. Die Kommunikation innerhalb der Herde und zwischen den verschiedenen Herden findet mittels Lautgebung im niederfrequenten Bereich statt. Warnrufe liegen zumeist in einem Wellenbereich, der auch für den Menschen hörbar ist. Ansonsten besteht ein reichhaltiges Spektrum an verschiedenen Gesten und Körperhaltungen, die ebenfalls der Verständigung untereinander dienen, ebenso wie chemische Signale über den Kot und Urin wahrgenommen werden. Aktivitäten der Afrikanischen Elefanten sind sowohl tagsüber als auch nachts zu verzeichnen.[4][12][13][14][15]
Ernährung
Die Afrikanischen Elefanten ernähren sich von gemischter Pflanzenkost (mixed feeder), wobei harte Grasnahrung überwiegend in der Regenzeit im frischen Zustand bevorzugt wird. Weichere Pflanzen wie Blätter oder Früchte dominieren in der Trockenzeit. Die genaue Zusammensetzung der Nahrung ist aber abhängig von regionalen Gegebenheiten, wodurch eine große geographische Variabilität besteht. Die jeweilige Verfügbarkeit verschiedener Nahrungspflanzen bestimmt auch das Wanderungsverhalten der Familiengruppen. Einen Großteil ihres täglichen Zeitbudgets verbringen die Afrikanischen Elefanten mit der Nahrungsaufnahme. Sie sind außerdem wichtige Verbreiter von Samen, die sie durch den Kot ausscheiden. Hohe Bedeutung haben darüber hinaus Minerallecken und Wasser.[4][12][13][14][15]
Fortpflanzung
Die Fortpflanzung erfolgt ganzjährig, es können regional aber jahreszeitlich bedingte Häufungen auftreten. Bei Bullen kommt es jährlich zur Musth, die individuell einsetzt und deren Dauer mit dem Alter der Tiere zunimmt. Erkennbar ist die Musth unter anderem an Sekretausscheidungen an den Temporaldrüsen. Während der Musth sind Bullen mitunter sehr aggressiv und bestreiten Dominanzkämpfe. Der Paarungszyklus der Kühe folgt dagegen in einem mehrjährigen Abstand. Dies führt dazu, dass paarungswillige Kühe innerhalb einer Population eher selten sind und die Bullen so auf Wanderschaft gehen und mehrere Herden aufsuchen. Dort werben sie um fortpflanzungsbereite Kühe. Die Tragzeit dauert etwa 660 Tage. In der Regel kommt ein Kalb zur Welt, die Geburt findet in der Familiengruppe statt. Häufig kümmert sich die gesamte Herde um den Nachwuchs, teilweise übernehmen ältere weibliche Geschwister die Aufsicht („allomaternale Pflege“). Allerdings säugen Muttertiere jeweils nur ihr eigenes Kalb. Weibliche Jungtiere erreichen mit rund 14 Jahren die sexuelle Reife, männliche verlassen etwa im gleichen Zeitraum die mütterliche Herde. Ihre Fortpflanzungsaktivitäten beginnen erst später, da sie zu diesem Zeitpunkt noch nicht ausgewachsen sind und somit nicht mit den Altbullen konkurrieren können. Sie durchlaufen ihre erste Musth mit rund 29 Jahren. Das Höchstalter wird für beide Geschlechter mit rund 60 bis 65 Jahren angenommen, es liegt in freier Wildbahn aber zumeist darunter.[4][12][13][14][15]
Systematik
Innere Systematik der heutigen Elefanten nach Meyer et al. 2017[16]
|
Die Afrikanischen Elefanten (Loxodonta) sind eine Gattung innerhalb der Familie der Elefanten (Elephantidae), die wiederum zur Ordnung der Rüsseltiere (Proboscidea) gehört. Sie stellen das Schwestertaxon der Gattung Elephas mit dem Asiatischen Elefanten (Elephas maximus) als einzigem Mitglied dar. Gemeinsam gehören beide Gattungen zur Unterfamilie der Elephantinae. Hierin werden die Afrikanischen Elefanten zur Tribus der Loxodontini, der Asiatische Elefant hingegen zur Tribus der Elephantini verwiesen.[17] Die Rüsseltiere selbst bilden eine sehr alte Gruppe originär afrikanischer Tiere. Ihre Ursprünge lassen sich rund 60 Millionen Jahre in die Vergangenheit zurückverfolgen. Im Laufe ihrer Stammesgeschichte erwiesen sie sich als sehr formenreich mit vielfältigen Anpassungen an unterschiedliche Biotope und Klimaregionen. Dabei breiteten sich die Rüsseltiere über weite Teile Eurasiens und Amerikas aus. Dem gegenüber sind die Elefanten als relativ junge Entwicklungslinie anzusehen. Ihre frühesten Nachweise datieren in das ausgehende Miozän vor rund 7 Millionen Jahren zurück.[18][19] Gemäß molekulargenetischen Untersuchungen trennten sich die afrikanischen und die asiatischen Elefanten vor rund 7,6 Millionen Jahren voneinander ab.[20][21]
Die Gattung Loxodonta enthält zwei rezente Arten:[22]
- Loxodonta africana (Blumenbach, 1797) (Afrikanischer Elefant)
- Loxodonta cyclotis (Matschie, 1900) (Waldelefant)
Der Afrikanische Elefant ist der größere der beiden Vertreter und tritt hauptsächlich in offenen Savannenlandschaften auf, ist aber auch in Wäldern und in wüstenartigen Regionen anzutreffen. Der Waldelefant repräsentiert die kleinere Art und ist auf die Regenwälder des zentralen und westlichen Afrikas beschränkt. Die Linien der beiden Arten differenzierten sich aus genetischer Sicht vor 5,6 bis 2,6 Millionen Jahren heraus.[20][21]
Neben den beiden rezenten Vertretern sind noch einige ausgestorbene Arten anerkannt:[7]
- Loxodonta adauroraMaglio, 1970
- Loxodonta atlantica (Pomel, 1879)
- Loxodonta cookeiSanders, 2007
- Loxodonta exoptata (Dietrich, 1942)
Neueren genetischen Daten aus dem Jahr 2017 zufolge scheinen die Verwandtschaftsverhältnisse innerhalb der Gattung Loxodonta und zu anderen Vertretern der Familie relativ komplex zu sein. So ergaben DNA-Proben an rund 200.000 Jahre alten Knochenresten des Europäischen Waldelefanten (Palaeoloxodon antiquus), dass dieser dem Waldelefanten des westlichen Afrikas näher steht als dem Afrikanischen Elefanten. Untergeordnet treten aber auch Beziehungen zum Afrikanischen Elefanten und zusätzlich zur Gattung Mammuthus auf. Erklärt wird dies mit möglichen Vermischungen zwischen Vertretern von Palaeoloxodon, Loxodonta und Mammuthus in der Frühphase ihrer Stammesentwicklung.[16][23]

Die Gattungsbezeichnung Loxodonta geht auf Frédéric Cuvier im Jahr 1825 zurück. Er verwendete sie in einem zweiseitigen Porträt des Afrikanischen Elefanten innerhalb des von ihm und von Étienne Geoffroy Saint-Hilaire zwischen 1824 und 1842 herausgegebenen Werkes Histoire naturelle des mammifères. Darin setzte er den Afrikanischen Elefanten aufgrund unterschiedlicher Zahnmerkmale von seinem asiatischen Verwandten ab und untermauerte dies mit dem neuen Gattungsnamen, den er mit Loxodonte angab. F. Cuvier verzichtete somit auf eine Latinisierung seiner vorgeschlagenen Bezeichnung,[24] weswegen seine Urheberschaft nach den Regeln der zoologischen Nomenklatur nicht anerkannt ist. Im Jahr 1827 erschien eine Rezension zur Histoire naturelle des mammifères ohne Angabe eines Autorennamens. In dieser Rezension wird der Name der Gattung mit Loxodonta korrekt wiedergegeben.[25] Für die Autorenschaft wird teilweise Nicholas Aylward Vigors vermutet, da er zu diesem Zeitpunkt als Herausgeber der Zeitschrift fungierte, in der die Rezension abgedruckt war. In einigen Fachaufsätzen findet sich daher auch der Hinweis LoxodontaVigors, 1827.[26][27] Der Name Loxodonta leitet sich von den griechischen Wörtern λοξός (loxos für „schräg“) und ὀδούς (odoús für „Zahn“) ab. Er bezieht sich dabei auf die rautenförmige Ausprägung der Schmelzfalten auf der Kauoberfläche.[17]
Stammesgeschichte
Der früheste Fossilnachweis der Gattung Loxodonta datiert in das ausgehende Miozän und den Beginn des Pliozäns vor rund 7 bis 5 Millionen Jahren. Es handelt sich dabei um einzelne isolierte Zähne aus der Lukeino-Formation und der Chemeron-Formation in den Tugen-Bergen in Kenia sowie aus der Region Nkondo-Kaiso im westlichen Grabensystem in Uganda im östlichen Afrika. Sie zeigen bereits die typische rautenförmige Aufweitung der Schmelzfalten der Afrikanischen Elefanten. Ihr Alter liegt bei 6,2 bis 4,0 Millionen Jahren. Möglicherweise sind sie identisch mit Loxodonta cookei, das von nahezu gleich alten Funden aus dem südwestlichen Afrika, genauer von der Varswater-Formation an der Fundstelle Langebaanweg in Südafrika, bekannt ist. Auch hier sind meist isolierte Zähne zuzüglich einzelner Kieferreste überliefert. Die Form zeichnet sich durch urtümliche Backenzähne mit niedrigen Zahnkronen aus, deren Höhe geringer als deren Breite war. Sie besaßen außerdem dicke Zahnschmelzlamellen, die Lamellenfrequenz war gering (4), am letzten Molar kamen insgesamt sieben bis acht Lamellen vor. Als relativ primitiv kann auch das Vorhandensein von permanenten hinteren Prämolaren gewertet werden.[28][29] Nach Isotopenanalysen, die an den Zähnen vorgenommen wurden, ernährte sich Loxodonta cookei deutlich flexibler als das gleichzeitig hier auftretende Anancus und bezog neben Blattkost auch Gräser mit ein.[30] Wesentlich häufiger als Loxodonta cookei trat im Verlauf des Pliozäns Loxodonta adaurora auf. Erstmals beschrieben wurde die Form anhand eines nahezu vollständigen Skelettes aus dem Unteren Pliozän von Kanapoi in Kenia,[31][32] rekonstruiert wies das Tier wohl eine Schulterhöhe von 386 cm und ein Gewicht von rund 9 t auf.[33] Es werden zwei Arten unterschieden. Neben der Nominatform L. a. adaurora besteht mit L. a. kararae eine Zwergform aus Koobi Fora, wiederum Kenia, und vom Fundgebiet am Fluss Omo in Äthiopien. Zusätzlich zu den relativ niedrigen Zahnkronen und den breiten Schmelzlamellen, die eine Lamellenformel von 2,5 bis 4 bei maximal zehn Lamellen auf dem letzten Mahlzahn bedingen, zeichnen sich die Zähne von Loxodonta adaurora durch eine weniger prägnante rautenförmige Aufweitung der Schmelzlamellen aus. Dies impliziert, dass Loxodonta adaurora möglicherweise eine frühe Abspaltung innerhalb der Gattung Loxodonta darstellt und demzufolge wohl nicht in die direkte Vorfahrenlinie der heutigen Afrikanischen Elefanten gehört. Im weiteren Schädelbau ähnelte Loxodonta adaurora den heutigen Afrikanischen Elefanten, allerdings waren der Gesichtsbereich breiter, die Alveolen für die oberen Stoßzähne ausladender und das Stirnbein langgezogener.[7][5] Besonders gut ist dies an einem immensen, nahezu vollständigen Schädel von 137 cm Gesamtlänge und 73 cm Höhe aus der unterpliozänen Koobi-Fora-Formation des Turkana-Beckens nachvollziehbar. Dessen bereits ausgeprägten Verschmälerungen im vorderen und hinteren Bereich zeigen eine Veränderung im Kaumechanismus an und lassen sich als stärkere Anpassungen an eine Grasnahrung interpretieren.[33]

Aus dem Pliozän und dem Pleistozän des nördlichen, östlichen und südlichen Afrika wiederum ist Loxodonta atlantica belegt. Dieser extrem große Vertreter der Gattung übertraf in seinen Ausmaßen den heutigen Afrikanischen Elefanten. Ersichtlich wird dies an der Größe des unteren letzten Molaren, der bei Loxodonta atlantica durchschnittlich 35 cm, bei Loxodonta africana aber durchschnittlich 21 cm lang ist.[32] Von allen Angehörigen von Loxodonta stellt Loxodonta atlantica die wohl modernste Form dar. Die Zähne waren stark hochkronig mit einer Höhe doppelt so groß wie die Breite, was weitaus markanter ist als beim heutigen Afrikanischen Elefanten. Zudem besaßen sie 10 bis 15 Schmelzfalten auf dem letzten Molaren und damit mehr als die heutigen afrikanischen Arten. Die Lamellenfrequenz betrug 3,4 bis 5,4. Der Schädel entsprach weitgehend dem der rezenten Vertreter, Unterschiede betreffen die größeren Hinterhauptsgelenke und die engere Mittelkieferregion. Eingeführt wurde Loxodonta atlantica von Auguste Pomel im Jahr 1879 anhand von Backenzähnen und Stoßzahnfragmenten aus Ternifine im nördlichen Algerien.[34] Heute werden zwei geographisch getrennte Unterarten unterschieden: einerseits L. a. atlantica aus dem nördlichen Afrika, andererseits L. a. zulu aus dem südlichen. Letztere besaß deutlich dünnere Zahnschmelzlamellen. Für eine dritte Form, L. a. angammensis aus dem Unteren Pleistozän von Angamma-Yayo im Tschad, ist eine Stellung innerhalb der Art Loxodonta atlantica umstritten, da ihre Zahnmerkmale auffallend ursprünglicher ausfallen. Der Erstbeschreiber der Unterart, Yves Coppens, spekulierte daher später, dass es sich hierbei um eine Frühform des Afrikanischen Elefanten handeln könnte.[35] Insgesamt erscheint Loxodonta atlantica zu weit entwickelt zu sein, um in die Vorfahrenlinie der heutigen Arten zu gehören. Vermutlich handelt es sich um einen spezialisierten Grasfresser, der einzelne parallele Entwicklungen zur Gattung Elephas zeigt. Als möglicher Vorläufer des Afrikanischen Elefanten könnte dafür Loxodonta exoptata in Frage kommen, welcher im Unteren und Oberen Pliozän im östlichen Afrika vorkam. Die Art wurde 1942 von Wilhelm Otto Dietrich benannt, basierend auf rund 100 Zahnfunden aus der südlichen Serengeti. Dietrich führte seine neue Art zwar innerhalb der Gattung Archidiskodon (heute zumeist mit Mammuthus gleichgesetzt), erkannte aber die engen Beziehungen zu Loxodonta.[36] Im Laufe der Forschungsgeschichte wurde Loxodonta exoptata teilweise mit Loxodonta adaurora sowie mit Palaeoloxodon recki gleichgesetzt,[32][35] heute gilt sie wieder als eigenständig. Der Schädel ist bisher unbekannt, die Backenzähne waren weniger hochkronig als bei Loxodonta atlantica, ihre Höhe übertraf nur geringfügig ihre Breite, aber deutlich höher als bei Loxodonta cookei. Die Lamellenfrequenz betrug 4,1 bis 5,5 bei maximal elf bis zwölf Lamellen auf dem letzten Molaren. Dadurch war auch der Zahnschmelz nur moderat dick im Vergleich zu Loxodonta cookei. Die bisher bedeutendsten Funde kamen in Laetoli in Tansania zum Vorschein. Da hier Palaeoloxodon recki fehlt, das stärker an trockene Klimate angepasst war, wurde für Loxodonta exoptata ursprünglich ein feuchteres Lebensumfeld rekonstruiert. Mittlerweile ergaben Interpretationen des paläontologischen Befundes von Laetoli ein diverseres Bild, das von halbtrockenen Buschländern bis zu geschlossenen Wäldern reicht. Möglicherweise war Loxodonta exoptata wie der heutige Afrikanische Elefant und zahlreiche frühe, heute ausgestorbene Elefantenformen auf gemischte Pflanzenkost spezialisiert.[7][5]
Fossilfunde vom Afrikanischen Elefanten reichen gesichert bis in das Mittlere Pleistozän des östlichen und nördlichen Afrikas zurück, einzelne Reste aus dem südlichen Afrika sind zeitlich etwas jünger. Der Waldelefant verfügt über keinen fossilen Nachweis.[7][5]
Bedrohung und Schutz
Die beiden Arten der Afrikanischen Elefanten sind durch Wilderei, im überwiegenden Maße befördert durch die Jagd nach Elfenbein, in ihrem Bestand bedroht. Hinzu kommen die Umweltzerstörung und die Ausbreitung der menschlichen Bevölkerung, was die Zersplitterung der bewohnbaren Lebensräume zur Folge hat. Die IUCN führt den Afrikanischen Elefanten als „stark gefährdet“ (endangered) sowie den Waldelefanten als „vom Aussterben bedroht“ (critically endangered). Beide Arten sind in zahlreichen Naturschutzgebieten vertreten.[37][38]
Seit dem Jahr 1989 wird die Gesamtpopulation im Anhang I des Washingtoner Artenschutzübereinkommen (CITES) gelistet, wodurch sich die Vertragsstaaten zum Verbot des kommerziellen Handels mit den Tieren verpflichteten.[39] Für die Mitgliedstaaten der Europäischen Union wurde das durch Aufnahme in Anhang A der EU-Artenschutzverordnung umgesetzt, womit hier etwa auch die Einfuhr, das Zurschaustellen oder Vorrätighalten zu kommerziellen Zwecken oder Kauf- oder Verkaufsangebote bei lebenden Tieren wie Teilen toter Exemplare verboten wurden. Mit der 12. Tagung der CITES-Vertragsstaaten vom 3.–15. November 2002 in Chile wurden die Populationen Botswanas, Namibias, Südafrikas und Simbabwes von diesem Höchstschutz ausgenommen und seit 2003 auch in der EU in Anhang B ihrer Artenschutzverordnung herabgestuft, so dass unter mehrfach neu formulierten Bedingungen für größere Kontingente Vermarktungshandlungen legalisiert sind.[40]
Literatur
- Larry Laursen, Marc Bekoff: Loxodonta africana. In: Mammalian Species. Band 92, 1972, S. 1–8.
- William J. Sanders, Emmanuel Gheerbrant, John M. Harris, Haruo Segusa, Cyrille Dellmer: Proboscidea. In: Lars Werdelin, William Joseph Sanders (Hrsg.): Cenozoic Mammals of Africa. University of California Press, Berkeley/Los Angeles/London 2010, S. 161–251.
- Pascal Tassy, Jehehskel Shoshani: Genus Loxodonta African Elephants. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold, Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London 2013, S. 178–180.
- G. Wittemyer: Family Elephantidae. In: Don E. Wilson, Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 50–79.
Einzelnachweise
- ↑ G. E. Weissengruber, G. F. Egger, J. R. Hutchinson, H. B. Groenewald, L. Elsässer, D. Famini, G. Forstenpointner: The structure of the cushions in the feet of African elephants (Loxodonta africana). In: Journal of Anatomy. Band 209, 2006, S. 781–792
- ↑ John R. Hutchinson, Cyrille Delmer, Charlotte E. Miller, Thomas Hildebrandt, Andrew A. Pitsillides, Alan Boyde: From Flat Foot to Fat Foot: Structure, Ontogeny, Function, and Evolution of Elephant “Sixth Toes”. In: Science. Band 334, 2011, S. 1699–1703
- ↑ Ian S. C. Parker, Alistair D. Graham: The African elephants’ toe nails. In: Journal of East African Natural History. Band 106, Nr. 1, 2017, S. 47–51
- ↑ a b c d e f Larry Laursen, Marc Bekoff: Loxodonta africana. In: Mammalian Species. Band 92, 1972, S. 1–8.
- ↑ a b c d Pascal Tassy, Jehehskel Shoshani: Genus Loxodonta African Elephants. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold, Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London 2013, S. 178–180
- ↑ a b Nancy E. Todd: Qualitative Comparison of the Cranio-Dental Osteology of the Extant Elephants, Elephas Maximus (Asian Elephant) and Loxodonta africana (African Elephant). In: The Anatomical Record. Band 293, 2010, S. 62–73
- ↑ a b c d e f William J. Sanders, Emmanuel Gheerbrant, John M. Harris, Haruo Segusa, Cyrille Dellmer: Proboscidea. In: Lars Werdelin, William Joseph Sanders (Hrsg.): Cenozoic Mammals of Africa. University of California Press, Berkeley/Los Angeles/London 2010, S. 161–251
- ↑ Régis Debruyne: A case study of apparent conflict between molecular phylogenies: the interrelationships of African elephants. In: Cladistics. Band 21, 2005, S. 31–50
- ↑ Yumie Murata, Takahiro Yonezawa, Ichiro Kihara, Toshihide Kashiwamura, Yuji Sugihara, Masato Nikaidoa, Norihiro Okada, Hideki Endo, Masami Hasegawa: Chronology of the extant African elephant species and case study of the species identification of the small African elephant with the molecular phylogenetic method. In: Gene. Band 441, 2009, S. 176–186
- ↑ Samrat Mondol, Ida Moltke, John Hart, Michael Keigwin, Lisa Brown, Matthew Stephens, Samuel K. Wasser: New evidence for hybrid zones of forest and savanna elephants in Central and West Africa. In: Molecular Ecology. Band 24, 2015, S. 6134–6147
- ↑ Iain Douglas-Hamilton und Frances Michelmore: Loxodonta africana: range and distribution, past and present. In: Jeheskel Shoshani und Pascal Tassy (Hrsg.): The Proboscidea. Evolution and palaeoecology of elephants and their relatives. Oxford University Press, 1996, S. 321–326
- ↑ a b c Ian Whyte: Loxodonta africana (Blumenbach1797) – African savanna elephant. In: John D. Skinner, Christian T. Chimimba (Hrsg.): The Mammals of the Southern African Subregion. Cambridge University Press, 2005, S. 51–59
- ↑ a b c G. Wittemyer: Family Elephantidae. In: Don E. Wilson, Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 50–79 (S. 77)
- ↑ a b c Joyce Poole, Paula Kahumbu, Ian Whyte: Loxodonta africana Savanna Elephant (African Bush Elephant). In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold, Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London 2013, S. 181–194
- ↑ a b c Andrea Turkalo, Richard Barnes: Loxodonta cyclotis Forest Elephant. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold, Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London 2013, S. 195–200
- ↑ a b Matthias Meyer, Eleftheria Palkopoulou, Sina Baleka, Mathias Stiller, Kirsty E. H. Penkman, Kurt W. Alt, Yasuko Ishida, Dietrich Mania, Swapan Mallick, Tom Meijer, Harald Meller, Sarah Nagel, Birgit Nickel, Sven Ostritz, Nadin Rohland, Karol Schauer, Tim Schüler, Alfred L Roca, David Reich, Beth Shapiro, Michael Hofreiter: Palaeogenomes of Eurasian straight-tusked elephants challenge the current view of elephant evolution. In: eLife. 6, 2017, S. doi:10.7554/eLife.25413
- ↑ a b Jeheskel Shoshani: Taxonomy, Classification, History, and Evolution of Elephants. In: Murray Fowler, Susan K. Mikota (Hrsg.): Biology, Medicine, and Surgery of Elephants. Blackwell Publishing, 2006, S. 3–14
- ↑ Jan van der Made: The evolution of the elephants and their relatives in the context of a changing climate and geography. In: Harald Meller (Hrsg.): Elefantenreich – Eine Fossilwelt in Europa. Halle/Saale 2010, S. 340–360
- ↑ Jeheskel Shoshani, Pascal Tassy: Family Elephantidae Elephants. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold, Jan Kalina (Hrsg.): Mammals of Africa Volume I. Introductory Chapters and Afrotheria. Bloomsbury, London 2013, S. 176–178
- ↑ a b Nadin Rohland, Anna-Sapfo Malaspinas, Joshua L. Pollack, Montgomery Slatkin, Paul Matheus, Michael Hofreiter: Proboscidean Mitogenomics: Chronology and Mode of Elephant Evolution Using Mastodon as Outgroup. In: PLoS Biology. Band 5, Nr. 8, 2007, S. e207, doi:10.1371/journal.pbio.0050207
- ↑ a b Nadin Rohland, David Reich, Swapan Mallick, Matthias Meyer, Richard E. Green, Nicholas J. Georgiadis, Alfred L. Roca, Michael Hofreiter: Genomic DNA Sequences from Mastodon and Woolly Mammoth Reveal Deep Speciation of Forest and Savanna Elephants. In: PLoS Biology. Band 8, Nr. 12, 2010, S. e1000564, doi:10.1371/journal.pbio.1000564
- ↑ Don E. Wilson, DeeAnn M. Reeder (Hrsg.): Mammal Species of the World. A taxonomic and geographic reference. Johns Hopkins University Press, Baltimore, Md., 2005, ISBN 0-8018-8221-4 (departments.bucknell.edu)
- ↑ Eleftheria Palkopoulou, Mark Lipson, Swapan Mallick, Svend Nielsen, Nadin Rohland, Sina Baleka, Emil Karpinski, Atma M. Ivancevic, Thu-Hien To, R. Daniel Kortschak, Joy M. Raison, Zhipeng Qu, Tat-Jun Chin, Kurt W. Alt, Stefan Claesson, Love Dalén, Ross D. E. MacPhee, Harald Meller, Alfred L. Roca, Oliver A. Ryder, David Heiman, Sarah Young, Matthew Breen, Christina Williams, Bronwen L. Aken, Magali Ruffier, Elinor Karlsson, Jeremy Johnson, Federica Di Palma, Jessica Alfoldi, David L. Adelson, Thomas Mailund, Kasper Munch, Kerstin Lindblad-Toh, Michael Hofreiter, Hendrik Poinar, David Reich: A comprehensive genomic history of extinct and living elephants. In: PNAS. 2018, doi:10.1073/pnas.1720554115
- ↑ Fréderic Cuvier: Eléphant d’Afrique. In: Étienne Geoffroy Saint-Hilaire, Fréderic Cuvier (Hrsg.): Histoire naturelle des mammifères: avec des figures originales, coloriées, dessinées d'après des animaux vivans. Tome sixième. Paris 1825. (biodiversitylibrary.org)
- ↑ Anonym: Histoire naturelle des mammifères: avec des figures originales, coloriées, dessinées d'après des animaux vivans; &c. par MM. Geoffroy Saint-Hilare et F. Cuvier. Livraisons 52de et 53eme. In: The Zoological Journal. Band 3, 1827, S. 140–142. (biodiversitylibrary.org)
- ↑ Miklós Kretzoi: Stegeloxodon nov. gen., a loxodonta elefántok esetleges ázsiai öse (Stegoloxodon nov. gen., a possible Asiatic ancestor of true loxodonts). In: Földtani Közlöny. Band 80, 1950, S. 405–408
- ↑ Jeheskel Shoshani, Pascal Tassy (Hrsg.): The Proboscidea. Evolution and palaeoecology of the Elephants and their relatives. Oxford/New York/Tokyo 1996, S. 361 (Appendix C)
- ↑ William J. Sanders: Taxonomic review of fossil Proboscidea (Mammalia) from Langebaanweg, South Africa. In: Transactions of the Royal Society of South Africa. Band 62, Nr. 1, 2007, S. 1–16
- ↑ William J. Sanders: Horizontal tooth displacement and premolar occurrence in elephants and other elephantiform proboscideans. In: Historical Biology. Band 30, Nr. 1–2, 2018, S. 137–156, doi:10.1080/08912963.2017.1297436
- ↑ Patricia A. Groenewald, Judith Sealy, Deano Stynder, Kathlyn M. Smith: Dietary resource partitioning among three coeval proboscidean taxa (Anancus capensis, Mammuthus subplanifrons, Loxodonta cookei) from the South African Early Pliocene locality of Langebaanweg E Quarry. In: Palaeogeography, Palaeoclimatology, Palaeoecology. Band 543, 2020, S. 109606, doi:10.1016/j.palaeo.2020.109606
- ↑ Vincent J. Maglio: Four new species of Elephantidae from the Plio-Pleistocene of northwestern Kenya. In: Breviora. Band 341, 1970, S. 1–43
- ↑ a b c Vincent J. Maglio: Origin and Evolution of the Elephantidae. In: Transactions of the American Philosophical Society. Band 63, Nr. 3, 1973, S. 1–149 (S. 29–31)
- ↑ a b William Sanders, Meave Leakey, Louise Leakey, Craig Feibel, Timothy Gichunge Ibui, Cyprian Nyete, Mbatha P. Mbete und Francis Brown: Morphological description and identification of an extraordinary new elephant cranium from the early Pliocene of Ileret, Kenya. In: Palaeovertebrata. Band 44, Nr. 2, 2021, S. e3, doi:10.18563/pv.44.2.e3
- ↑ Auguste Pomel: Ossements d’Élephants et d’Hippopotames découverte dans une stationpréhistorique de la plaine d’Eghis (province d’Oran). In: Bulletin de la Sociètè geologique de France. Band 3, Nr. 7, 1879, S. 44–51 (biodiversitylibrary.org)
- ↑ a b Yves Coppens, Vincent J. Maglio, Cary T. Madden, Michel Beden: Proboscidea. In: Vincent J. Maglio, H. B. S. Cooke (Hrsg.): Evolution of African Mammals. Harvard University Press, 1978, S. 336–367
- ↑ Wilhelm Otto Dietrich: Ältestquartäre Säugetiere aus der südlichen Serengeti, Deutsch-Ostafrika. In: Palaeontographica A. Band 94, 1942, S. 43–133
- ↑ K. S. Gobush, C. T. T. Edwards, F. Maisels, G. Wittemyer, D. Balfour und R. D. Taylor: Loxodonta cyclotis. The IUCN Red List of Threatened Species 2021. e.T181007989A181019888 ([1]); zuletzt abgerufen am 26. März 2021
- ↑ K. S. Gobush, C. T. T. Edwards, D. Balfour, G. Wittemyer, F. Maisels und R. D. Taylor: Loxodonta africana. The IUCN Red List of Threatened Species 2021. e.T181008073A181022663 ([2]); zuletzt abgerufen am 26. März 2021
- ↑ CITES: African elephant. Abgerufen am 7. September 2018
- ↑ auch zur Grundlage siehe Verordnung (EG) Nr. 1497/2003 ([3]) der Kommission vom 18. August 2003, zur Änderung der Verordnung (EG) Nr. 338/97 des Rates über den Schutz von Exemplaren wild lebender Tier- und Pflanzenarten durch Überwachung des Handels, insbesondere Erwägung Nr. 1. Stand 2020 nach VO (EU) 2019/2117 ([4]) der Kommission vom 29. November 2019, zur Änderung der Verordnung (EG) Nr. 338/97 des Rates über den Schutz von Exemplaren wild lebender Tier- und Pflanzenarten durch Überwachung des Handels mit den Ausnahmeregelungen in Fußnote 5 des Anhangs
Weblinks
- Loxodonta africana in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: K. S. Gobush, C. T. T. Edwards, D. Balfour, G. Wittemyer, F. Maisels & R. D. Taylor, 2021. Abgerufen am 26. März 2021.
- Loxodonta cyclotis in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: K. S. Gobush, C. T. T. Edwards, F. Maisels, G. Wittemyer, D. Balfour & R. D. Taylor, 2020. Abgerufen am 26. März 2021.
Auf dieser Seite verwendete Medien
Vergleichende Anatomie von Kopf und vorderer Körperpartie von Asiatischem Elefant (Elephas maximus, 1) und Afrikanischem Elefant (Loxodonta africana, 2).
Autor/Urheber: DagdaMor, Lizenz: CC BY-SA 4.0
Elefantenmolaren, oben: Loxodonta, Mitte: Elephas, unten: Mammuthus, fotographiert im Phyletischen Museum in Jena
Autor/Urheber: VIGNA christian, Lizenz: CC BY-SA 4.0
African forest elephant (Loxodonta cyclotis)
Autor/Urheber: Ikiwaner, Lizenz: GFDL 1.2
Herde Afrikanischer Elefanten (Loxodonta africana) verschiedenen Alters in der Serengeti
Loxodonta atlantica, zweiter unterer und dritter oberer Molar, die Cotypen der Art, wiederabgebildet von Osborn 1942 nach Auguste Pomel 1895: Paleontologie Monographies, no. 6. Les elephants Quaternaires." Carte Géol. I'Algérie, plate 8, fig. 1 and 3; Ternifine, Algerien; Pleistozän
Autor/Urheber: Bamse, Lizenz: CC BY-SA 3.0
range map of the African Elephant (Loxodonta): that includes the Savanna Elephant (Loxodonta africana) and Forest Elephant (Loxodonta cyclotis), and colonial borders.
French zoologist and paleontologist Frédéric Cuvier (1773-1838) by Ambroise Tardieu (1788-1841).






