Lofepramin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
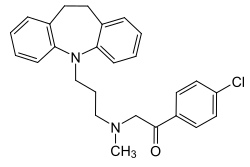
| Freiname | Lofepramin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C26H27ClN2O | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | N06AA07 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 418,96 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Lofepramin ist eine chemische Verbindung aus der Klasse der Dibenzazepine, die als Arzneistoff zur Behandlung von Depressionen angewandt wird. Sie gehört zur Wirkstoffgruppe der trizyklischen Antidepressiva.
Der Arzneistoff wurde 1970 und 1972 von der schwedischen Aktiengesellschaft Leo (Leo Läkemedel AB) patentiert und war in Deutschland unter dem Handelsnamen Gamonil von Merck auf dem Markt.
Darstellung und Gewinnung
Die Synthese geht vom Wirkstoff Desipramin aus, wobei die sekundäre Aminstruktur mit 2-Brom-4'-chloracetophenon alkyliert wird.[4]
Klinische Angaben
Die mittlere Tagesdosis von Lofepramin liegt zwischen 70 und 210 mg.[5]
Pharmakologische Eigenschaften
Lofepramin ist strukturell ein Derivat des Imipramins, das zu dem aktiven Metaboliten Desipramin verstoffwechselt wird. Verwendet wird der Arzneistoff in Form seines Hydrochlorids.
Die Substanz hemmt die Wiederaufnahme von Noradrenalin aus dem synaptischen Spalt wesentlich stärker als die von Serotonin. Lofepramin wirkt zudem als FIASMA (funktioneller Hemmer der sauren Sphingomyelinase).[6]
Literatur
- Harald Schmidt (Hrsg.), begründet von Claus-Jürgen Estler: Pharmakologie und Toxikologie. 6. Auflage. Schattauer, Stuttgart/ New York 2007. S. 241 und 245.
Einzelnachweise
- ↑ Römpp Lexikon Chemie. 10 Aufl. Thieme, Stuttgart u. New York 1996–1999. S. 2441.
- ↑ a b Datenblatt Lofepramine hydrochloride bei Sigma-Aldrich, abgerufen am 1. Februar 2013 (PDF).
- ↑ a b Eintrag zu Lofepramine hydrochloride in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- ↑ A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances - Synthesis, Patents, Applications, 4. Auflage (2001) Thieme-Verlag Stuttgart, ISBN 978-1-58890-031-9.
- ↑ Ernst Mutschler: Arzneimittelwirkungen. 7. Aufl. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1996. S. 156.
- ↑ Kornhuber J, Muehlbacher M, Trapp S, Pechmann S, Friedl A, Reichel M, Mühle C, Terfloth L, Groemer T, Spitzer G, Liedl K, Gulbins E, Tripal P: Identification of novel functional inhibitors of acid sphingomyelinase. In: PLoS ONE. 6, Nr. 8, 2011, S. e23852. doi:10.1371/journal.pone.0023852.
Auf dieser Seite verwendete Medien
Synthese von Lofepramin
Struktur von Lofepramin


