Lithiumphosphat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Lithiumphosphat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
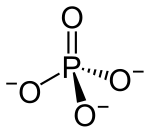
| Summenformel | Li3PO4 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 115,79 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | 837 °C[5] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Lithiumphosphat ist eine chemische Verbindung aus der Gruppe der Phosphate.
Vorkommen
Lithiumphosphat kommt natürlich als seltenes Mineral Lithiophosphatit vor.[6]
Gewinnung und Darstellung
Lithiumphosphat kann aus alkalischen (z. B. Natriumhydroxid-), mit etwas Dinatriumhydrogenphosphat Na2HPO4 versetzten Lösungen gewonnen werden. Beim Erhitzen fällt bei Anwesenheit von Li+ (gelösten anderen Lithiumsalzen, z. B. Lithiumchlorid) Lithiumphosphat als weißer Niederschlag aus:[7]
Ebenfalls möglich ist die Gewinnung durch Reaktion einer wässrigen Suspension von Lithiumcarbonat mit Phosphorsäure und anschließendem Erhitzen bis zum Sieden. Es existiert auch eine bei normalen Temperaturen stabile Hochtemperaturform von Trilithiumphosphat die bei Temperaturen oberhalb der Umwandlungstemperatur von 502 °C z. B. aus geschmolzenem Lithiumchlorid kristallisiert werden kann.[4]
Eigenschaften
Lithiumphosphat ist ein farbloser Feststoff. Er kristallisiert orthorhombisch mit den Gitterkonstanten a=6,12 Å, b=10,53 Å und c=4,93 Å mit der Raumgruppe Pmnb (Raumgruppen-Nr. 62, Stellung 2).[3] Es kommt auch als Lithiumphosphat-Hemihydrat Li3PO4·½H2O vor. Die Hochtemperaturvariante besitzt eine Kristallstruktur mit der Raumgruppe Pcmn (Nr. 62, Stellung 4).[8] Daneben existieren auch noch Lithiummetaphosphat LiPO3 (monoklin, Raumgruppe Pn (Nr. 7, Stellung 2)), Lithiumpolyphosphat (P2O5:Li2O > 1), Lithiumdihydrogenphosphat LiH2PO4 (orthorhombisch, Raumgruppe Pna21 (Nr. 33)) und Lithiumdihydrogendiphosphat Li2H2P2O7.
Verwendung
Lithiumphosphat kann zum Nachweis von Lithium per Fällungsreaktion im alkalischen Medium verwendet werden.[9] Es wird weiterhin als Bestandteil von bestimmten Emailen und als Polymer-Zwischenprodukt eingesetzt.[5] Daneben wird es zur Gewinnung von Lithium-Eisenphosphat für Lithium-Eisenphosphat-Akkumulatoren und mit Stickstoff dotiert auch als Lithium-Ionenleiter verwendet.[4]
Einzelnachweise
- ↑ Datenblatt Lithium phosphate bei Sigma-Aldrich, abgerufen am 26. Januar 2019 (PDF).
- ↑ a b c Eintrag zu Lithiumphosphat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2025. (JavaScript erforderlich)
- ↑ a b c J. Zemann: Die Kristallstruktur von Lithiumphosphat, Li3PO4. In: Acta Cryst. (1960). 13, 863–867, doi:10.1107/S0365110X60002132
- ↑ a b c d e Eintrag zu Lithiumphosphate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Dezember 2014.
- ↑ a b fmclithium:Lithium Orthophosphine Tertiary ( vom 11. November 2011 im Internet Archive) (PDF; 208 kB).
- ↑ Mindat: Lithiophosphate
- ↑ H. L. Buff: Kurzes Lehrbuch der anorganischen Chemie entsprechend den neueren Ansichten. 1868, S. 186 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ American Mineralogist Crystal Structure Database: lithiophosphate.
- ↑ Karl-Heinz Lautenschläger, Werner Schröter und Andrea Wanninger: Taschenbuch der Chemie. 2005, ISBN 3-8171-1760-4, S. 662 (eingeschränkte Vorschau in der Google-Buchsuche).



