Lithiumamid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| _ Li+ _ N3− _ H+ | ||||||||||||||||
| Kristallsystem | ||||||||||||||||
| Raumgruppe | I4 (Nr. 82) | |||||||||||||||
| Gitterparameter | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Lithiumamid | |||||||||||||||
| Verhältnisformel | LiNH2 | |||||||||||||||
| Kurzbeschreibung | farb- und geruchloser Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 22,96 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | 1,178 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | 430 °C[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Lithiumamid ist eine chemische Verbindung des Lithiums aus der Stoffgruppe der Metallamide.
Gewinnung und Darstellung
Lithiumamid wird industriell durch Erhitzen von Lithium oder Lithiumhydrid in einem Strom von Ammoniak hergestellt. Außerdem bildet es sich langsam, wenn Lithium in flüssigem Ammoniak gelöst wird.[5] Wie auch bei anderen Alkali- und Erdalkaliamiden wird diese Reaktion durch die Anwesenheit von Eisen(II)-chlorid erheblich beschleunigt.[6]
Eigenschaften
Lithiumamid ist ein farb- und geruchloser Feststoff, der sich in Wasser zersetzt.[2]
Die Verbindung ist allgemein sehr hydrolyseempfindlich und greift Glas schwach an.[3][7] Beim Erhitzen im Vakuum gibt sie oberhalb von 300 °C Ammoniak ab. Der quantitative Abbau zu Lithiumimid erfolgt jedoch erst bei 400 °C und erst oberhalb 750–800 °C zersetzt sie sich unter Abgabe von Stickstoff, Wasserstoff und Ammoniak.[7]
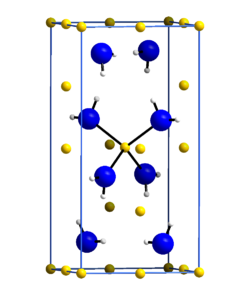
Kristallstruktur
Die Kristallstruktur des Lithiumamids wurde im Jahr 1951 von Robert Juza und Karl Opp in der tetragonalen Raumgruppe I4 (Nr. 82) mit a = 501,6 pm und c = 1022 pm anhand von Pulveraufnahmen bestimmt[8]. Hierbei wurde die Lage der Stickstoffatome und der Lithiumatome bestimmt, jedoch nicht des Wasserstoffs. In einer späteren Arbeit im Jahre 1972 wurde die Kristallstruktur anhand eines Lithiumamid-Einkristalls neu bestimmt. Hierbei wurden auch die Lagen der Wasserstoffatome bestimmt. Die Gitterparameter wurden zu a = 503,7 pm und c = 1027,8 pm bestimmt. Die Stickstoffatome bilden eine verzerrte kubisch dichteste Kugelpackung, in der jede zweite Tetraederlücke von Lithium besetzt ist. Die ABC-Abfolge der Schichten ist entlang [112] angeordnet. In z = 0 sind es drei Li+, in z = 1/4 ein Li+, in z = 1/2 wieder drei Li+ und in z = 3/4 wieder ein Li+. Die Struktur steht in Verwandtschaft zu der des Lithiumhydroxides, unterscheidet sich aber von dieser.[9][10]
Verwendung
Lithiumamid wird in der organischen Chemie bei Claisen-Kondensationen, bei der Alkylierung von Nitrilen und Ketonen sowie der Synthese von Ethinyl-Verbindungen und Carbinolen verwendet.[5] Sie wird weiterhin als Reagenz zur Kreuzkupplung von Arylchloriden und Aminen eingesetzt.[11]
Einzelnachweise
- ↑ W.I.F. David, M.O. Jones, D.H. Gregory, C.M. Jewell, S.R. Johnson, A. Walton, P.P. Edwards: A mechanism for non-stoichiometry in the lithium amide/lithium imide hydrogen storage reaction. In: Journal of the American Chemical Society, 2007, Bd. 129(6), S. 1594–1601, doi:10.1021/ja066016s.
- ↑ a b c d e f Datenblatt Lithiumamid bei Merck, abgerufen am 27. März 2013.
- ↑ a b Roger Blachnik (Hrsg.): Taschenbuch für Chemiker und Physiker. Begründet von Jean d’Ans, Ellen Lax. 4., neubearbeitete und revidierte Auflage. Band 3: Elemente, anorganische Verbindungen und Materialien, Minerale. Springer, Berlin 1998, ISBN 3-540-60035-3, S. 536 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Eintrag zu Lithiumamid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18. November 2022. (JavaScript erforderlich)
- ↑ a b Eintrag zu LITHIUM AMIDE in der Hazardous Substances Data Bank (via PubChem), abgerufen am 28. März 2013.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 666.
- ↑ a b Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 448.
- ↑ R. Juza und K. Opp: Die Kristallstruktur des Lithiumamides. In: Z. Anorg. Allg. Chem, 1951, Bd. 266, S. 313–324, doi:10.1002/zaac.1951266060.
- ↑ H. Jacobs und R. Juza: Neubestimmung der Kristallstruktur des Lithiumamids. In: Z. Anorg. Allg. Chem, 1972, Bd. 391, S. 271–279, doi:10.1002/zaac.19723910308.
- ↑ Theresia M. M. Richter und Rainer Niewa: Chemistry of Ammonothermal Synthesis. In: Inorganics, 2014, Bd. 2, S. 29–78, doi:10.3390/inorganics2010029.
- ↑ Datenblatt Lithium amide, powder, 95% bei Sigma-Aldrich, abgerufen am 28. März 2013 (PDF).
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances




