Lazarus-Effekt
Unter dem Lazarus-Effekt versteht man in der Paläontologie das vorübergehende Nichterscheinen von Taxa (beispielsweise im Rang von Familien) im Fossilbericht, häufig mit Bezug auf die Zeit von Massenaussterben. In der Naturschutzbiologie bezieht sich der Ausdruck auf die Wiederauffindung von Taxa (in der Regel im Rang von Arten oder Unterarten), die bereits als ausgestorben gelistet worden waren, also auf ihre Entfernung von der Liste ausgestorbener Arten.
Namensherkunft
Der naturwissenschaftliche Begriff wurde nach dem biblischen Charakter Lazarus des Neuen Testaments benannt, der nach religiösem Glauben Tage nach seinem Tod eine Auferweckung durchlief,[1] also durch ein Wunder von den Toten wiederauferstand.[2][3]
Begriffsgeschichte und Bedeutung
Der Begriff wurde ursprünglich in der Paläontologie für vorübergehend im Fossilbericht fehlende Taxa definiert,[2] nachträglich aber in anderem Sinn auf rezente Arten oder Taxa, die wiederentdeckt wurden, nachdem sie einige Zeit als ausgestorben galten, übertragen.[4]
Die von dem Lazarus-Effekt betroffenen Taxa können auch als „Lazarus-Taxa“ angesprochen werden.[2]
Paläontologische Konzepte
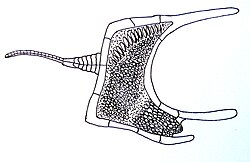
Rechts: Darstellung des Lazarus-Effekts (im Sinne von Wignall & Benton 1999, hier als graue Fläche markiert) am schematischen Beispiel der Diversitätsänderungen eines Taxons (im Rang einer Klasse) durch das Massenaussterben an der Perm-Trias-Grenze, wie er sich in ähnlicher Form weltweit bei den Gastropoden (Schnecken) ereignet hat.[6][7]
In der Paläontologie bezeichnet der Lazarus-Effekt ein vorübergehendes Verschwinden von Taxa aus dem Fossilbericht.[2] Bei einem Lazarus-Taxon handelt es sich also um ein Taxon, dessen Fossilienbestand eine oder mehrere signifikante Lücken aufweist, ohne dass sich zwischen dem ersten und letzten Exemplar morphologische Veränderungen ergeben haben.[8]
Allerdings ist es im Zusammenhang mit dem „Lazarus-Effekt“ zu einer Vielzahl an Definitionen und Auslegungen gekommen, die zu erheblicher Begriffsverwirrung geführt haben:[2]
- Viele Wissenschaftler beschränken die Verwendung des Begriffes auf die Zeitspannen während der Massenaussterben-Ereignisse.[2]
- Einige andere Autoren sprechen dagegen damit ein Muster an, das sich auf bestimmte Zeitspannen bezieht, aber nicht auf Massenaussterben beschränkt ist.[2]
- Weitere, wiederum abweichende Definitionen fassen die „Lazarus-Taxa“ im Sinne des – erst später – als „Ghost lineage“ beschriebenen Phänomens auf oder umfassen damit sämtliche Taxa, die erhebliche Lücken in ihrem Fossilienbestand aufweisen.[2]
Blau: Fossilien eines Taxons werden in Sedimentgesteinen einer begrenzten Altersspanne gefunden.
Rot: Doch dann wird ein Fossil von einem ähnlichen Organismus in Millionen Jahre jüngeren Sedimentgesteinen entdeckt.
Gelb: Eine Deutungsmöglichkeit ist, dass das Taxon zwischen den beiden Perioden, in denen es im Fossilbericht erscheint, nicht ausgestorben ist, sondern dass eine große (langanhaltende) Lücke im Fossilbericht des Taxons besteht.
Neben der nicht einheitlich verwendeten Definition des Muster des Ausfalls von Taxa, das als „Lazarus-Effekt“ angesprochen werden soll, hat auch die fehlende Unterscheidung zwischen diesem in der Fachwissenschaft einheitlich zu definierenden Muster und den wissenschaftlich kontrovers interpretierbaren potenziellen Prozessursachen, die zu diesem Ausfall der Taxa geführt haben, maßgeblich zur Begriffsverwirrung beigetragen.[2]
Die Widersprüchlichkeit der in der Literatur bestehenden Konzepte zum „Lazarus-Effekt“ kann zum Teil damit erklärt werden, dass sowohl solche für die beobachteten „Lazarus“-Phänomene verantwortliche Faktoren zu existieren scheinen, die über alle Zeitintervalle – einschließlich der Massenaussterbeereignisse – hinweg wirken, als auch solche, die spezifischer im Rahmen der Massenaussterbeereignisse zur Geltung kommen. Bei ersteren handelt es sich um „stratigraphische Faktoren“, durch die Lücken in den stratigraphischen Verbreitungsgebieten der Taxa entstehen. Bei letzteren handelt es sich um „biologische Faktoren“, die etwa die Abwanderung von Taxa in Refugialräume oder geringe Populationsgrößen nach dem Massenaussterbeereignis betreffen können.[2]
Entscheidend für die Bestimmung, was genau mit dem Begriff „Lazarus-Effekt“ bezeichnet werden soll, ist, ob der Fossilbericht als eine die angesprochenen evolutiven Abläufe angemessen darstellende Quelle angenommen werden soll oder ob der Fossilbericht für den angesprochenen Fall als unvollständig aufzufassen sein soll.[2]
Lazarus-Taxa als stratigraphisches Phänomen
Wird von einem unvollständigen Fossilbericht ausgegangen, dann wird mit dem Lazarus-Effekt die Unvollständigkeit der geologischen Überlieferung angesprochen, also ein stratigraphisches Phänomen.[2]
In Anlehnung an frühere Beobachtungen von Batten (1973) prägte David Jablonski 1983 den Begriff Lazarus-Effekt (englisch Lazarus effect, Fessa & Jablonski 1983[13]) am Beispiel einer Anzahl von Familien und vieler Gattungen, die kurz vor der Perm-Trias-Grenze (und dem damit verbundenen Massenaussterben) oder kurz vor der Kreide-Paläogen-Grenze (und dem damit verbundenen Massenaussterben) aus dem Fossilbericht verschwinden, kurz nach der jeweiligen Grenze dann aber wieder im Fossilbericht erscheinen.[13] 1986 entwickelte Jablonski das Konzept der Lazarus-Taxa (englisch Lazarus Taxa, Jablonski 1986) weiter.[2] Er beschrieb damit das Phänomen, dass einige Taxa vor einem Massenaussterbeerereignis aus dem Fossilbericht verschwinden (scheinbar aussterben), später aber wieder im Fossilbericht erscheinen, dass also für diese Taxa „Lücken“ im Fossilbericht während einer Zeit des Massenaussterbens entstehen.[14] Trotz des Nichterscheinens dieser Taxa in einer bestimmten Zeitspanne, also trotz dieser „Lücke“ in der geologischen Überlieferung während eines Massenaussterbens, kann ihr Fortbestehen während der Zeitspanne dieser „Lücke“ aus ihrem Erscheinen im Fossilbericht jüngerer und älterer Schichten geschlossen werden.[2] Der Lararus-Effekt (im Sinne von Jablonski, 1986) bezeichnet also im Fossilbericht das „Verschwinden und scheinbare Aussterben von Taxa, die später unversehrt wieder auftauchen“.[15]
Das Wissen um das Konzept der „Lazarus-Taxa“ erlangt dadurch Bedeutung, dass ihr Vorkommen Hinweise auf die Qualität des Fossilberichts während eines Massenaussterbens geben kann.[16][2] Die „Lazarus-Taxa“ belegen das Fortbestehen vieler Gruppen mit geringen Bestandsgrößen während der Aussterbeereignisse. Sie mahnen zur Vorsicht bei der Deutung des Fossilberichts, indem sie an den oft fragmentarischen Charakter erinnern, den der Fossilbericht in der Erholungsphase nach dem Aussterbeereignis haben kann.[17] Je mehr Lazarus-Taxa vorliegen und je größer die „Lücke“ in der geologischen Überlieferung während eines Massenaussterbens ist, desto unvollständiger ist der Fossilbericht.[16]
Jüngere Entdeckungen von Taxa (beispielsweise die Gattungen Cteniogenys und Lazarussuchus), die den Fossilbericht des übergeordneten Taxons (beispielsweise Choristodera) an seinen beiden Enden verlängern, unterstreichen die Grenzen von Konzepten wie Taxon-Langlebigkeit und Aussterbemuster, bei denen es sich um Verallgemeinerungen und lediglich um minimale Schätzungen handelt, die durch neue Entdeckungen leicht geändert werden können.[11]
Lazarus-Taxa als biologisches Phänomen
Wird von einem adäquat vorliegenden Fossilbericht ausgegangen, dann wird mit dem Lazarus-Effekt ein echtes, mit dem Aussterben verbundenes Phänomen angesprochen, also ein biologisches Phänomen.[2] Grund für das Fehlen einiger Taxa während einer bestimmten Zeitspanne der geologischen Überlieferung kann eine tatsächliche Erholung nach einem Beinahe-Aussterben sein.[2] Diese biologische Auslegung ist als der stratigraphischen Interpretation untergeordnet zu betrachten und nur zu bevorzugen, wenn die stratigraphische Auslegung nicht dokumentiert werden kann.[2]
Zu den „biologische Faktoren“, die anstelle von „stratigraphische Faktoren“ offenbar auch für „Lazarus“-Phänomene verantwortlich sein können, zählt neben geringen Populationsgrößen nach einem Massenaussterbeereignis zum Beispiel auch die Abwanderung von Taxa in Refugialräume.[2] Die Kolonisierung Nordamerikas durch die nur aus der Spätphase des frühen Oligozäns im Westen Nordamerikas bekannte Gattung Ekgmowechashala gilt als ein Beispiel des Lazarus-Effekts, da hiermit ein Taxon – die Ordnung der Primaten – nach einem längeren Hiatus von rund 4,5 Millionen Jahren unvermittelt wieder im Fossilienbericht dieses Kontinents auftaucht, also in Nordamerika nur scheinbar „ausgestorben“ (im Sinne von englisch: extirpated, nicht von: extinct) war.[18] Im Gegensatz zu den modernen Lazarus-Taxa (im neontologischen Konzept der Naturschutzbiologie) wie etwa dem Schwarzbrauen-Mausdrossling (der im Jahr 2020 nach 170 Jahren wiederentdeckt wurde), die in der Regel spätestens nach ein paar Jahrhunderten des vermuteten Aussterbens wieder in Erscheinung treten, taucht die Art Ekgmowechashala philotau (deren Fossilien 30 Millionen Jahre alt und die ältesten der Gattung Ekgmowechashala sind) also erst Jahrmillionen nach den anderen nordamerikanischen Primaten im Fossilienbericht auf (und entspricht damit einem Lazarus-Taxon im paläontologischen Konzept).[19][18] Während aber das Phänomen des Lazarus-Effekts im paläontologischen Kontext sonst oft als Ergebnis eines nur sporadisch (zeitlich lückenhaft) dokumentierten lokalen oder regionalen Fossilienberichts erklärt wird (wie beispielsweise im Fall der Laotischen Felsenratte im Sinne von Dawson und andere, 2006[20]), ist der Fossilienbericht des mittleren Känozoikums in Nordamerika anerkanntermaßen sehr gut belegt, also nicht lückenhaft.[18] – Der Lazarus-Effekt spiegelt daher im Fall von Ekgmowechashala mit dem Fossilbericht der Primatenentwicklung in Nordamerika ein biogeografisches Signal wider und stellt kein Artefakt der Taphonomie (Fossilisationslehre) oder Konservierung (Erhaltung) dar.[18] Die Vorstellung, dass Ekgmowechashala philotau eine Relikt- oder überlebende Art früherer Primaten in Nordamerika ist, wurde in einer 2023 publizierten Studie widerlegt und stattdessen dargelegt, dass es sich um eine eingewanderte Art handelt, die sich in Asien entwickelt hat und in einer auffallend kühlen Phase nach Nordamerika eingewandert ist, möglicherweise über die Beringia.[19]
Abgrenzung zum Konzept der Elvis taxa
Während das Konzept der Lazarus-Taxa im Rahmen eingehender Studien auf Ebene der Biospezies als sehr nützlich erachtet wird, kann es für Taxa oberhalb des Art-Ranges zu Missverständnissen führen, da bei der Erholung von Taxa unter identischen Umweltbedingungen das Phänomen der Konvergenz zu beachten ist und die in der Erholungsphase nach einem Massenaussterbeereignis beobachtbaren neuen Taxa solchen Taxa in der Gestalt ähneln können, die vor dem Massenaussterben lebten, aber entwicklungsgeschichtlich andere Vorfahren besitzen, deren morphologische Ähnlichkeit also nicht auf evolutionärer Verwandtschaft mit den neuen Taxa beruht, sondern auf Homoplasie. Diese Taxa, die ausgestorbenen Taxa aufgrund von Homoplasie ähneln, aber keine Fortsetzung von deren Entwicklungslinie darstellen, werden Elvis-Taxa (englisch Elvis taxa, Erwin & Droser 1993) genannt.[21][2] Bereits Batten (1973) und Erwin & Droser (1993) haben darauf hingewiesen, dass die verglichenen Taxa exakt und konsistent taxonomisch einander zugeordnet sein müssen, damit entschieden werden kann, ob bei einem Befund tatsächliche Lazarus-Taxa vorliegen oder aber davon zu unterscheidende Elvis-Taxa.[2]
Das paläontologische Konzept der Elvis-Taxa betrifft also Taxa im Fossilbericht, die einander ähnlich im Sinne von morphologisch konvergent, aber nicht miteinander stammesgeschichtlich verwandt sind.[16][2][22] Die Elvis taxa sind als taxonomische Artefakte aufzufassen. Die Bezeichnung leitet sich vom Vornamen Elvis Presleys ab und bezieht sich auf die vielen „Elvis-Imitatoren“, die nach dessen Tod in Erscheinung traten.[16]
Der Begriff Elvis-Taxa wurde ursprünglich eingeführt, um lediglich vermeintliche Abstammungslinien von Gastropoden, articulaten Brachiopoden und Bivalvia zu beschreiben, die nach dem an der Perm-Trias-Grenze stattgefundenen Massenaussterben erschienen.[23][24]
Die Erstbeschreibung von Schinderhannes bartelsi im Jahr 2009 schien auf überraschende Weise die Langlebigkeit der Familie Anomalocarididae, die Ähnlichkeit mit den Arthropoda aufweist,[25] um die beachtliche Spanne von rund 100 Millionen Jahren zu verlängern,[26] doch blieb die tatsächliche stammesgeschichtliche Verwandtschaft von Schinderhannes bartelsi weiter umstritten, sodass es sich hierbei möglicherweise um ein Elvis-Taxon oder aber auch um ein Lazarus-Taxon handeln kann.[26]
Beispiele für Lazarus-Taxa (im paläontologischen Sinn)
Ein Beispiel für Lazarus-Arten im Zusammenhang mit dem Massenaussterben an der Perm-Trias-Grenze sind Seeigel und andere Gruppen, die etwa in der Mitte des Trias, etwa 25 Millionen Jahre nach dem großen Massenaussterben, wieder im Fossilbericht erscheinen und als verhältnismäßig empfindlich auf Umweltveränderungen reagierende Organismen die Normalisierung der marinen Lebensbedingungen kennzeichnen.[27] Während des gleichen Massenaussterbenereignisses gab es auch unter Gastropoden, Bivalvien und articulaten Brachiopoden eine erhebliche Anzahl von Lazarus-Taxa.[23]

- Gurbanodelta kara: diese nur aus einem in Xinjiang (im Dsungarischen Becken) gefundenen Kieferfragment aus dem späten Paläozän (Gashatan) bekannte, 2016 erstbeschriebene[28] Species gehört zu den basalen („primitiven“) Metatheria und unter diesen wahrscheinlich zur Ordnung Deltatheroida.[29][28] Da es als 10 Millionen Jahre jünger datiert wurde als alle zuvor bekannten Vertreter der Deltatheroida, würde es sich bei Bestätigung seiner Einordnung um ein mit den Beuteltieren verwandtes Säugetierbeispiel für ein Lazarus-Taxon handeln,[29][28] das das Massenaussterben an der Kreide-Paläogen-Grenze überlebt hat.[28]
Sonderfall: Rezent lebende Beispiele für Lazarus-Taxa (im paläontologischen Sinn)
Das paläontologische Konzept des „Lazarus-Effekts“, das ursprünglich für Taxa definiert wurde, die nach einer langen Periode scheinbarer Nichtexistenz innerhalb des Fossilberichts wiedererscheinen, wurde nachträglich auf die Entdeckung lebender Vertreter längst ausgestorben geglaubter Taxa erweitert.[30] Die Entdeckung lebender Exemplare ausgestorben geglaubter Taxa stellt nach Dawson somit einen Sonderfall des Lazarus-Effekts im Sinne des Wiedererscheinens von Taxa nach einem längeren Hiatus im Fossilbericht dar (nach Dawson & al., 2006).[20][30]
- Beispiele aus dem Tierreich
Solche Entdeckungen wurden bei Säugetieren und anderen Wirbeltieren nur selten dokumentiert.[20]
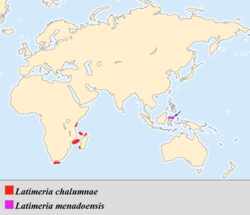
Zum Verbreitungsgebiet der rezenten Quastenflosser: Der Lebensraum der verbliebenen Populationen des Komoren-Quastenflossers liegt im tieferen Gewässer um zwei der vier Komoren-Hauptinseln, während es sich beim Erstfund an der Chalumna-Mündung in Südafrika und bei den vereinzelten Funden an der Ostküste Afrikas offenbar um zufällige „Verdriftungen“ durch die Meeresströmung handelt.[31] Es wird vermutet, dass Indonesien als Verbreitungsgebiet des Manado-Quastenflossers auch das eigentliche Reliktareal der Vorgänger der rezenten Quastenflosser war, von wo sie erst durch Meeresströmungen zu den Komoren „verdriftet“ wurden.[32]
- Quastenflosser oder Hohlstachlerartige (Coelacanthiformes): Diese zunächst nur aus dem Fossilbericht bekannte Gruppe der Knochenfische mit rezent überlebenden Vertretern innerhalb der Gattung Latimeria gehört zu den aufsehenerregendsten Beispielen von Lazarus-Taxa.[34] Die Ordnung der Quastenflosser galt lange Zeit mangels Funden aus dem Känozoikum als vor 50 oder über 65 Millionen Jahren ausgestorben. Ihre „Wiederentdeckung“ in der Rezentfauna im Jahr 1938 in Form eines in einer Tiefe von 80 Metern nahe der Flussmündung des Chalumna an der Küste Südafrikas gefangenen Exemplars stellte deshalb eine wissenschaftliche Sensation höchsten Ranges als „lebendes Fossil“ dar,[33][31][32] obwohl ihre Existenz in der lebenden Tierwelt zwar neu für die Wissenschaft war, nicht aber für in der Region einheimische Fischer, die die Tiere bereits als Beifang kannten.[31] Eine wissenschaftliche Sensation bestand durch die Entdeckung bereits allein dadurch, dass den Quastenflossern zur Zeit dieser Entdeckung als vermeintliche Vorfahren der Amphibien eine phylogenetisch entscheidende Rolle beim Landgang der Wirbeltiere zugewiesen wurde.[31][32] Die anhand eines bereits fortgeschritten zersetzten Kadavers angefertigte Erstbeschreibung wurde teilweise wissenschaftlich angefochten, konnte aber 1952 durch einen in der Nähe der Komoren getätigten weiteren Fund erhärtet werden.[31] 1988 konnte der Komoren-Quastenflosser (L. chalumnae) durch Tauchboote in so guter Qualität im Lebensraum gefilmt werden, dass erstmals Details der Lebensweise der in einer Tiefe von 120 bis 200 Metern in den Abhängen der vulkanischen Inseln lebenden Art dokumentiert wurden.[35][36] 1998 wurde dann vor der Nordküste der von den Komoren weit entfernt gelegenen und zu Indonesien gehörenden Insel Manado Tua vor Sulawesi (ehemals: Celebes) ein weiterer Quastenflosser gefangen,[35][31][32] der auf Basis seiner von L. chalumnae abweichenden Färbung und genetischen Merkmale als eigenständige Art, Manado-Quastenflosser (L. menadoensis), beschrieben wurde.[35][31][32] – Der Komoren-Quastenflosser wird allerdings inzwischen als „vom Aussterben bedroht“ eingestuft (IUCN, 2000[37]), der Manado-Quastenflosser als „gefährdet“ (IUCN, 2008).[38] Die hauptsächliche Ursache für die massive Gefährdung des Komoren-Quastenflosser soll nicht in der lokalen Fischerei bestehen, sondern in der nach 1952 entbrannten weltweiten Sammelbegierde von Museen, Forschungseinrichtungen, Naturalienhändlern und Kuriösitätensammlern, die hohe Preise für dieses bekannteste „lebende Fossil“ bieten, obwohl der fortlaufende Fang der Tiere aufgrund der bereits an über 200 Exemplaren erfolgten, intensiven Erforschung kaum mehr mit wissenschaftlichem Bedarf zu rechtfertigen ist.[31]
- Laotische Felsenratte (Laonastes aenigmamus): Die Art gilt als besonders eindrückliches Beispiel für den „Lazarus-Effekt“ in der Gruppe rezenter Säugetiere. In diesem Fall wurde demnach nach einer zeitlichen Nachweis-„Lücke“ von rund 11 Millionen Jahren ein ehemals als ausgestorben betrachtetes Taxon (die sonst zuletzt aus den frühen Oligozän- und späten Miozän-Schichten fossil belegte Nagetier-Familie der Diatomyidae) in der Biota der Gegenwart in der Region Khammuan wiederentdeckt.[40][41][42][32][30] 1996 wurden erstmals Kadaver der Art als angebotenes Nahrungsmittel in Süd-Laos von Wissenschaftlern entdeckt.[43] 2005 wurde anhand des Materials die Familie Laonastidae, die Gattung Laonastes und die Art L. aenigmamus wissenschaftlich beschrieben.[43][41] Lebende Exemplare konnten gefilmt und eingefangen werden.[42] 2006 wurde die Art in die Familie Diatomyidae gestellt.[40][41] 2007 wurde die umstrittene taxonomische Stellung der Art im Stammbaum der Säugetiere und damit die umstrittene Einordnung als Lazarus-Art mit molekularbiologischen Methoden überprüft und die Zugehörigkeit zur Familie Diatomyidae bestätigt. Aufgrund dieser anhand von morphologischen und molekularen Daten vorgenommenen Klassifikation wurde die Hypothese aufgestellt, dass es sich bei der Art um ein lebendes Fossil handelt.[41][40][42] Die Art wird als „nicht gefährdet“ eingestuft (IUCN, 2016).[44]
Einige Taxa wurden zunächst fossil oder subfossil aus dem Pleistozän beschrieben, dann aber nachträglich auch in der Biota der Gegenwart entdeckt und den aus dem Pleistözän beschriebenen Taxa zugeordnet:
- Chaco-Pekari (Catagonus wagneri): rezente Individuen der Art wurden in den 1920er Jahren im bolivianischen Teil des Gran Chaco als unbeschriebene dritte und scheinbar neuentdeckte Art der damals bekannten Vertreter der Familie Nabelschweine oder Pekaris entdeckt und konnten später vom Mammalogen Martin Eisentraut gesichtet werden.[45] Erst 1975 wurde diese dritte rezente Pekari-Art dann anhand von 1972 im paraguayischen Teil des Gran Chaco entdeckten rezenten Individuen wissenschaftlich beschrieben, wobei diese Individuen jedoch der in der Paläontologie 1930 bereits erstbeschriebenen Art Catagonus wagneri zugeordnet werden konnten, die anhand von fossil und subfossil im unteren und mittleren Pleistozän Nordargentiniens erhaltenen Knochenresten bekannt war,[46][47][48][45] bereits zum Zeitpunkt ihrer Erstbeschreibung als seit 20.000 Jahren ausgestorben galt[49][30] und nun also in gewissem Sinne in der rezenten Tierwelt „wiederentdeckt“ wurde.[46][47][48][45] 1985 wurde die Art durch Eisentraut auch für ihr zuvor schon gemeldetes Verbreitungsareal in Bolivien bestätigt. – Dieser Fall ist ein aufsehenerregendes Beispiel für den Nachweis einer Säugetierart mit beachtlicher Körpergröße in der rezenten Fauna, die der Wissenschaft zunächst nur fossil bis subfossil bekannt war.[45][48][50] Allerdings reagieren die vereinzelten Freilandpopulationen sehr empfindlich auf anthropogene Eingriffe und der Gesamtbestand der als „stark gefährdet“ eingestuften Art (IUCN, 2015[51]) wird auf nur noch wenige tausend Individuen geschätzt.[52]
- Bergbilchbeutler (Burramys parvus): Diese Bilchbeutlerart wurde 1895 anhand von fossilem Material aus New South Wales beschrieben, das als dem Pleistozän zugehörig gedeutet wurde. Sie wurde für eine bis dahin unbekannte und ausgestorbene Beuteltier-Art gehalten. 1966 wurde dann in einer Skihütte auf dem Mount Hotham ein lebendes Individuum entdeckt, womit die fossil bekannte Art als alpines und subalpines Element der Rezentfauna wiederentdeckt wurde. – Kaum als rezent überlebendes Faunenelement „wieder“entdeckt, wurde die Art allerdings als „vom Aussterben bedroht“ (IUCN, 2008[53]) eingestuft. Denn aufgrund fehlender höher gelegener Rückzugsgebiete oder Korridore zum Ausweichen in den klimatisch kälteren Süden der Südhalbkugel wird für den erwarteten Fall des Eintretens der prognostizierten globalen Erwärmung vom sicheren Aussterben dieser in ihrem Verbreitungsgebiet stenök an Hochgebirge gebundenen Art in der Wildbahn ausgegangen.[54]
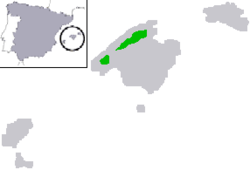
- Mallorca-Geburtshelferkröte (Alytes muletensis): 1979 (nominell: 1977) wurde die Art nach auf Mallorca gefundenen Knochenresten aus dem Pleistozän beschrieben und dafür die neue Gattung Baleaphryne in der Familie Scheibenzüngler geschaffen.[45][55] 1980 wurde an sehr unzugänglicher Stelle im Nordosten Mallorcas ein rezent lebender Bestand entdeckt, der als der aus dem Pleistozän beschriebenen Art zugehörig identifiziert wurde. Aufgrund des beobachteten Brutpflegeverhaltens der lebenden Männchen wurde die Art dabei aber in die von festlandbewohnenden Vertretern bekannte Gattung Alytes (Geburtshelferkröten) gestellt.[45] – Dieser Fall ist ein Beispiel für eine Froschlurchart mit Verbreitungsgebiet in Europa, die zunächst paläontologisch beschrieben, dann aber auch rezent nachgewiesen wurde.[45] An diesem Fall der als „stark gefährdet“ eingestuften Art (IUCN, 2020[56]) zeigt sich zudem exemplarisch, wie eingehende wissenschaftliche Studien in eine erfolgreiche Erhaltungszucht mündeten.[45]
- La-Gomera-Rieseneidechse (Gallotia bravoana): die Art wurde 1985 anhand von auf der Kanarischen Insel La Gomera gefundenen Skelettresten als zwei subfossile Unterarten (Gallotia simonyi bravoana und Gallotia simonyi gomerana) der auf der Kanarischen Insel El Hierro beheimateten El-Hierro-Rieseneidechse erstbeschrieben[45] und für seit langem ausgestorben gehalten.[57] 1999 wurden lebendige Individuen bekannt und damit die beiden Taxa als rezente Form wiederentdeckt,[45][57] die zu dieser Zeit nach Bischoff (1998) als Unterart Gallotia simonyi bravoana zusammengeführt worden waren.[45] Seit 2006 wird die einst auf La Gomera weit verbreitete Art, die heute auf einem weniger als einen Hektar großen Areal lebt, offiziell als „vom Aussterben bedroht“ eingestuft (IUCN, 2009).[57] Neben rund 90 in der Wildbahn lebenden Tieren[57][58] existiert auch eine erfolgreiche Erhaltungszucht in einer Zuchtanlage (2004: 44 Tiere).[57][45][58]
- Beispiele aus dem Pflanzenreich
- Gattung Metasequoia mit der einzigen rezenten Art Urweltmammutbaum (Metasequoia glyptostroboides):[59][61] Nachdem die Erstbeschreibung der Gattung Metasequoia 1941 anhand fossiler Reste aus dem Tertiär (genauer: Pliozän) erfolgt war, wurde einige Jahre später eine ebenfalls in den 1940er Jahren neu entdeckte Baumart aus China, der Urweltmammutbaum, als in allen wesentlichen Merkmalen übereinstimmend mit Metasequoia erkannt und dieser Gattung zugeordnet.[61][59] Ob Metasequoia nicht nur als „Lazarus-Taxon“, sondern auch als ein „lebendes Fossil“ betrachtet werden kann, hängt davon ab, für wie bedeutend die evolutiven Veränderungen dieser Bäume in den letzten rund fünf Millionen Jahren eingeschätzt werden.[59]
- Gattung Wollemia mit der einzigen rezenten Art Wollemie (Wollemia nobilis): Dieses Lazarus-Taxon wurde zunächst anhand von Fossilien entdeckt und galt als vor 2 Millionen Jahren ausgestorben, bis 1994 in einem etwa 200 Kilometer von Sydney entfernten, abgelegenen Gebiet des Wollemi-Nationalparks ein 20 Altbäume und ähnlich viele Jungbäume umfassender Reliktbestand entdeckt[62][63][64][65] und 1995 die Gattung Wollemia erstbeschrieben wurde.[66] Der Pollen von Wollemia weist praktisch keinen Unterschied zum fossilen Pollen der fossilen Gattung Dilwynites auf, deren Fossilbericht rund 90 Millionen Jahre bis in die Kreidezeit (genauer: Turonium) zurückreicht. Dies wird als Anzeichen dafür gewertet, dass die Gattung – nicht die noch existierende Art – einen sehr langen Fossilbericht besitzt.[66] Heute existieren weniger als 100 Bäume der Wollemie,[64][63] einige davon vermutlich zwischen 500 und 1000 Jahre alt.[63] Die Art hat nur im Wollemi-Nationalpark überlebt und wird als „vom Aussterben bedroht“ eingestuft (IUCN, 2011).[66] – Die Wollemie ist ein Beispiel für ein botanisches Lazarus-Taxon nach dem paläontologischen Konzept, das über die Botanik hinaus weltweit große Berühmtheit erlangt hat.[65] Die Entdeckung der in Form großer Bäume wachsenden Wollemie als rezente Art in weniger als 100 Kilometer Entfernung von Australiens größter Stadt wurde auch als spektakulärer Beleg für das Phänomen herangezogen, dass die relativ geringe Anzahl botanischer Sammler in Australien vor dem 20. Jahrhundert kaum das Spektrum der gesamten Flora der Gefäßpflanzen Australiens erfasst und beschrieben haben dürfte, so dass es möglich erscheint, dass nicht nur eine wahrscheinlich hohe Anzahl wenig bekannter Taxa wie Mikroorganismen, Pilze, Nicht-Gefäßpflanzen oder Wirbellose Tiere bereits im Zuge des modernen Artenschwundes ausgestorben waren, bevor sie gesammelt oder beschrieben wurden, sondern auch eine bedeutende Anzahl besser untersuchter und auffälligerer Taxa wie beispielsweise Gefäßpflanzen.[4]
- Matoniaceae: diese auch rezent noch vorkommende, zur Klasse der Echten Farne gehörende Familie aus der Ordnung der Gleicheniales erscheint im Fossilbericht erstmals im Perm, verbreitete sich dann weltweit im Jura und in der Kreidezeit, verschwand jedoch am Ende der Kreidezeit auf der Nordhalbkugel. Wegen drei rezent vorkommenden Gattungen der Familie in Südostasien wurde zwischenzeitlich angenommen, dass die Matoniaceae ein Lazarus-Taxon darstellen, doch ist die Familie inzwischen im Fossilbericht in der Antarktis, Argentinien, Australien und Neuseeland auch für das Känozoikum belegt.[67]
Neontologische Konzepte (Naturschutzbiologie)
Der Begriff „Lazarus-Taxon“ hat auch in der Neontologie, also der Erforschung noch existierender Organismen, ein gewisses Maß an Akzeptanz gefunden, und bezeichnet dort – anders als bei der Verwendung in der Paläontologie – eine wiederentdeckte Gruppe von noch lebenden Organismen, die bereits jahrelang allgemein als ausgestorben gegolten hatte.[65] Der ursprünglich im Kontext der Paläontologie geprägte Begriff „Lazarus-Effekt“ wird heute in der Biologie also häufig verwendet, um das Überleben jedes (rezenten) Taxons anzusprechen, das – unabhängig von der dazwischen liegenden Zeitdauer – zunächst als ausgestorben gilt, dann aber „wieder aufgetaucht“ ist.[30]
Dieses nicht seltene Phänomen vorzeitiger Einstufungen von Arten als ausgestorben hat zu verschiedenen Begriffsbildungen geführt. Neben dem Begriff Lazarus-Effekt (englisch Lazarus effect im Sinne von Keith & Burgman, 2004[4]) existiert auch der Terminus Romeo-Irrtum (englisch Romeo error im Sinne von Collar, 1998[69]).[70] Die Phänomene Lazarus-Effekt und Romeo-Irrtum sind zwar beides Fälle einer irrtümlichen Einordnung in die Gefährdungskategorie „ausgestorben“, behandeln jedoch verschiedene Seiten der Problematik des Datenmangels im Bereich der Biodiversität, denn sie befassen sich mit unterschiedlichen Aspekten dieser Problematik und beschreiben unterschiedliche Folgen, die daraus entstehen.[71]
Lazarus-Effekt als Entfernung eines Taxons aus der Liste der ausgestorbenen Taxa
Der Lazarus-Effekt bezieht sich auf den Wechsel in der Zusammensetzung von Listen ausgestorbener Arten aufgrund von Änderungen im Wissen über die als ausgestorben geltenden Arten oder Populationen (etwa auf Basis von Verbesserungen im Wissen über ihre Taxonomie oder Verbreitung)[71] und behandelt die Entfernung eines Taxons aus der Liste der ausgestorbenen Taxa.[72][73][71][74]
Häufigkeit der Wiederentdeckungen und Ausmaß des Biodiversitätsverlusts
In der Literatur sind zahlreiche Fälle dokumentiert.[30] In einer Übersichtsarbeit im Jahr 2011[75] wurde nach Auswertung der wissenschaftlichen Literatur identifiziert, dass mindestens 351 Arten (103 Arten von Säugetieren, 144 Vogelarten und 104 Amphibienarten) nach einem angenommenen Aussterben in den vorangegangenen 122 Jahren wiederentdeckt worden waren,[75][30][76] und seit Veröffentlichung der Übersichtsarbeit steigt die Zahl der wiederentdeckten Arten durch zusätzliche Fälle noch weiter an.[30][76] Im Durchschnitt lagen zwischen der Meldung des Aussterbens und dem Wiederfund etwa 60 Jahre.[75]
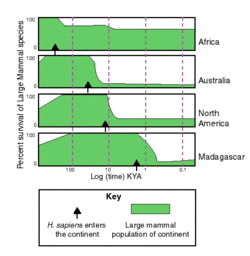
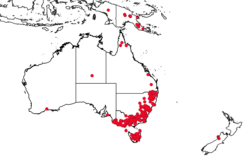
Rechts: Anteil der Wirbellosen, Pflanzen, Reptilien und Säugetiere in Sub-Sahara-Afrika, die als seit dem Jahr 1500 oder später „ausgestorben“, „ausgestorben in der Natur“ oder „wahrscheinlich ausgestorben“ eingestuft sind. – Die gestrichelte Linie stellt die natürliche Aussterberate dar, die ohne Einflüsse der Menschen zu erwarten wäre.[79]
Die Rote Liste der IUCN führte im Jahr 2020 878 Arten (755 Tiere und 123 Pflanzen) auf, die seit Beginn der Neuzeit (vor rund 500 Jahren) offiziell als ausgestorben gelten. Tatsächlich ist davon auszugehen, dass die Anzahl der rezent ausgestorbenen Arten, die durch die Kategorie „Ausgestorben“ auf der Roten Liste der IUCN dokumentiert sind, signifikant unterschätzt ist, also eine hohe Dunkelziffer ausgestorbener Arten existiert. Der zu geringe Wissensstand und die Gefahr eines unbemerkten Aussterbens zahlreicher Arten wird daran deutlich, dass in die erst vor wenigen Jahren eingeführte IUCN-Kategorie „Möglicherweise ausgestorben“ bereits 935 Arten fallen, also mehr als in die Kategorie „Ausgestorben“. Nach Ansicht vieler Wissenschaftler und Naturschützer repräsentieren die offiziellen Zahlen der IUCN-Kategorien den dramatischen Biodiversiätsverlust nicht adäquat. Jüngere Schätzungen der Aussterberaten lassen vermuten, dass jedes Jahr Hunderte von Arten an den Rand des Aussterbens geraten.[80]
Viele Wissenschaftler vertreten die Ansicht, dass die Artenvielfalt vermutlich weltweit bedroht ist, weil ein Artensterben enormen Ausmaßes bereits begonnen habe, das als „sechstes Massenaussterben“ (englisch auch: Holocene extinction oder Anthropocene extinction) bekannt ist und im Gegensatz zu den prähistorischen „großen Fünf“ (englisch auch: Big Five) Aussterbeperioden katastrophalen Ausmaßes in der Erdgeschichte anthropogen bedingt, also größtenteils auf menschliche Einflüsse oder Faktoren zurückzuführen sei,[80][76] wie die übermäßige Ausbeutung natürlicher Ressourcen („Übernutzung“), die Fragmentierung von Lebensräumen („Habitattrennung“), die Urbanisierung, der Handel mit Wildtieren, die Einführung invasiver Arten („biologische Invasion“), die Umweltverschmutzung und die Globale Erwärmung im Zuge des anthropogenen Klimawandels.[76][81]
Bedeutung der Wiederentdeckungen für Naturschutz und Biogeographie
In diesem Zusammenhang haben Wiederentdeckungen für ausgestorben gehaltener Arten sowohl anspornende, als auch alarmierende Wirkung und sind von großem potenziellem Interesse für Naturschützer und Biogeographen.[76][80]
2017 wurde von der Nichtregierungsorganisation Global Wildlife Conservation (GWC, später „re:wíld“) ein Programm mit einer Liste von „25 meistgesuchten verlorenen Arten“ zur Suche und Wiederentdeckung von Arten angestoßen, über die wenig Kenntnisse vorliegen und die seit vielen Jahrzehnten oder seit Jahrhunderten nicht mehr erfasst wurden.[80] Dazu hatte GWC in Zusammenarbeit mit über 100 wissenschaftlichen Experten aus den Fachgruppen der Species Survival Commission (SSC) der IUCN eine Liste von zunächst 1.200 (Stand Winter 2023: über 2.200) Tier- und Pflanzenarten zusammengestellt, die für die Wissenschaft seit mindestens 10 Jahren verschollen geblieben waren und von denen die „25 meistgesuchten verlorenen Arten“ als Teilmenge für die Öffentlichkeitsarbeit herausgesucht wurden.[85][86]
Der Wiederentdeckung „verlorener“ Arten kommt im Naturschutz hohe Bedeutung zu, weil sie zum einen wichtige Daten für Erhaltungsmaßnahmen beisteuern kann[80] und zum andern auch den Motivationsfaktor Hoffnung trotz der im Zusammenhang mit dem „sechsten Massenaussterben“ bestehenden Biodiversitätskrise nährt.[80][76] Die Wiederentdeckung von Arten kann jedoch nicht nur mediales Interesse, Naturschutzanstrengungen und wissenschaftliche Studien zum Verständnis des Bestandsrückgangs für die betroffenen Arten nach sich ziehen, sondern auch eine ungerechtfertigt optimistische Einschätzung zum Überleben der Art.[76]
Die meisten wiederentdeckten Arten leben in abgelegenen Regionen der Tropen.[75] In den meisten Fällen handelt es sich bei der Wiederentdeckung der Art um die erste Gelegenheit seit ihrer Erstbeschreibung, Daten über die Art zu erheben, unter anderem, weil viele Arten anhand von lediglich einem oder wenig mehr als einem Museumsexemplar beschrieben wurden, das Jahrzehnte oder sogar Jahrhunderte zuvor gesammelt worden war. Durch eine verbesserte Charakterisierung ihrer Lebensräume können einige wiederentdeckte Arten nach ihrer Wiederentdeckung häufiger angetroffen werden und es kann zur Anpassung ihres eingeschätzten Gefährdungsgrads kommen.[76]
Fast 90 Prozent der wiederentdeckten Arten waren so selten, dass sie anschließend als vom Aussterben bedroht eingeschätzt werden mussten.[75] Viele wiederentdeckte Arten stellen sich also nach ihrer Wiederentdeckung als tatsächlich vom Aussterben bedroht heraus und benötigen aufeinander abgestimmte Anstrengungen zu ihrer Erhaltung, damit ihr Aussterben abgewendet werden kann. Insbesondere bei den nur unzulänglich ökologisch charakterisierten Fällen stellt die Wiederentdeckung der Art somit nur einen ersten Schritt dar, dem zahlreiche weiter Maßnahmen folgen müssen.[76] Die Wiederentdeckung einer ausgestorben geglaubten Art kann Naturschützer und Naturschutzbehörden vor verschiedene Probleme und Dilemmas stellen, die eine Entscheidung erfordern, welche geeignete Schritte unternommen werden können und in welche Richtung künftige Schutzmaßnahmen gehen sollten.[87][88]
Abgrenzung zum Konzept des Romeo-Irrtums
Die Bedeutung der Untersuchung von „Lazarus-Arten“ für den Naturschutz wurde von Collar (1998) aufgezeigt, als er den Begriff „Romeo-Irrtum“ prägte.[30] Im Gegensatz zum Lazarus-Effekt bezieht sich das Phänomen des Romeo-Irrtums auf die Auswirkungen auf die Artenschutzbemühungen[71] und behandelt das verfrühte Aufgeben eines Taxons durch den Natur-oder Artenschutz,[72][73][71][74] ist also begrifflich zu trennen sowohl von dem in der Paläontologie als Lazarus-Effekt bekannten Phänomen (im Sinne von Wignall & Benton, 1999[3]),[72][73][71][74] als auch von dem in der Naturschutzbiologie als Lazarus-Effekt bekannten Phänomen (im Sinne von Keith & Burgman 2004[4]).[72]
Beispiele für Tiere
Beim Lazarus-Effekt im Sinne der Wiederentdeckung von Arten, die in der Roten Liste der IUCN bereits als „ausgestorben“ aufgeführt worden waren, handelt es sich um ein recht häufiges Phänomen[89] mit hunderten beschriebenen Fällen allein im Bereich der Amphibien, Vögel und Säugetiere.[1][75] Die Rote Liste der IUCN gilt als maßgeblichste Grundlage, wie die Arten nach ihrem Aussterberisiko zu klassifizieren sind und welche Arten als rezent „ausgestorben“ einzuordnen sind.[90]
Rechts: Die größten Bedrohungen (Habitatverlust, Übernutzung, invasive Arten und Krankheiten, Umweltverschmutzung) für verschiedene Tiergruppen (Säugetiere, Vögel, Knochenfische, Weichtiere) Afrikas. Der Einfluss des Klimawandels wird unterschätzt, da seine Auswirkungen auf die meisten Arten noch abzuschätzen sind[81]
Grundlegend kann zum Verbreitungsspektrum der betroffenen Arten angemerkt werden, dass es sich bei einem Großteil der vom Aussterben bedrohten, im Aussterben befindlichen oder (gegebenenfalls auch nur scheinbar) ausgestorbenen Tierarten um inselbewohnende Endemiten handelt. Weltweit gilt, dass der Hauptgrund für das Aussterben von Tierarten auf Inseln in der Einführung invasiver Neozoen liegt.[92] Allerdings ist beispielsweise von der Avifauna belegt, dass der Anteil der inselbewohnenden an den ausgestorbenen Arten rückläufig ist, während der Anteil der festlandbewohnenden Arten zunimmt, möglicherweise, weil die meisten potenziellen Neozoen auf ursprünglich beutegreiferlosen Inseln bereits eingeführt worden sind und sich nun verstärkt die auch auf dem Festland stark wirkende, anthropogene Lebensraumzerstörung auswirkt.[90] Von aussterbenden inselbewohnenden Reptilientaxa ist mehrfach das Phänomen beobachtet worden, dass sie länger auf einer kleinen Rand- oder Nebeninsel eines Archipels als auf dessen Hauptinsel zu überdauern scheinen.[45]
Die wiederentdeckten Taxa innerhalb der Reptilien und Amphibien leben häufig stärker verborgen und sind oft schwerer aufzuspüren als Vertreter anderer landbewohnender Tiergruppen.[34]
Vögel
Den besten Grad an Dokumentation auf der Roten Liste weist die Organismen-Klasse der Vögel auf, für deren Erhaltungszustand beziehungsweise Gefährdungsstatus bereits mehrfach vollständige Bewertungen auf weltweiter Ebene von BirdLife International und IUCN veröffentlicht wurden.[90] In der Ornithologie kam es auch zur intensivsten Beschäftigung mit Fragen, die Rückstufungen in der Gefährdungskategorie betreffen, sowie zum Versuch einer differenzierten Behandlung der Thematik, die durch eine Vielzahl spektakulärer Wiederentdeckungen verschollener und als ausgestorben eingestufter Vogeltaxa veranschaulicht werden kann.[93]
| Wissenschaftlicher Name | Trivialname des Taxons | Jahr der letzten Sichtung | Jahr der Wiederentdeckung | Jahre verschollen | IUCN-Status | Typ der Wiederentdeckung *) |
|---|---|---|---|---|---|---|
| Acrocephalus orinus | Großschnabel-Rohrsänger | 1867 | 2006 | 139 | LC[94] | „Holotyp“ |
| Actenoides bougainvillei | Bartliest[95] | 1953 | 1994 | 41 | LC[95] | „Zeit“ |
| Aegotheles savesi | Schwarzrücken-Höhlenschwalm | 1880 | 1998 | 118 | CR[96] | „Holotyp“ |
| Aegotheles tatei | Tiefland-Höhlenschwalm | 1969 | 2003 | 34 | LC[97] | „Holotyp“ |
| Aepypodius bruijnii | Braunbrust-Buschhuhn | 1938 | 2002 | 64 | EN[98] | „Zeit“ |
| Motacilla bocagii | Stummelschwanzstelze | 1928 | 1990 | 62 | VU[99] | „Zeit“ |
| Saucerottia castaneiventris (Syn. Amazilia castaneiventris)[100] | Braunbauchamazilie | 1979 | 2004 | 25 | NT[100] | „Zeit“ |
| Amazilia luciae | Hondurasamazilie | 1950 | 1988 | 38 | VU[101] | „Zeit“ |
| Amblyornis flavifrons | Gelbscheitel-Laubenvogel | 1895 | 1981 | 86 | LC[102] | „Holotyp“ |
| Anas nesiotis | Campbellente | 1886 | 1975 | 89 | VU[103] | „ausgestorben“ |
| Anodorhynchus leari | Learara | 1856 | 1978 | 122 | EN[104] | „Holotyp“ |
| Aplonis pelzelni | Pelzelnstar | 1956 | 1995 | 39 | CR[105] | „ausgestorben“ |
| Arborophila davidi | Orange-necked Partridge[106] | 1927 | 1991 | 64 | NT[106] | „Holotyp“ |
| Atlapetes pallidiceps | Pale-headed Brush-finch[107] | 1969 | 1998 | 29 | EN[107] | „ausgestorben“ |
| Atrichornis clamosus | Lärmdickichtvogel | 1889 | 1961 | 72 | EN[108] | „ausgestorben“ |
| Aythya innotata | Madagaskarmoorente | 1991 | 2006 | 15 | CR[109] | „ausgestorben“ |
| Bangsia melanochlamys | Blauschulter-Bergtangare[110] | 1948 | 1999 | 51 | VU[110] | „Zeit“ |
| Bostrychia bocagei | São-Tomé-Ibis | 1920 | 1990 | 70 | CR[111] | „Zeit“ |
| Bradypterus seebohmi (Syn. Amphilais seebohmi)[112] | Madagaskar-Grassänger | 1894 | 2004 | 110 | LC[112] | „Holotyp“ |
| Cacicus koepckeae | Koepckekassike | 1965 | 1998 | 33 | NT[113] | „Holotyp“ |
| Calyptura cristata | Goldhähnchentyrann | 1890 | 1996 | 106 | CR[114] | „Zeit“ |
| Campephilus principalis | Elfenbeinspecht | 1944 | 2004 | 60 | CR[115] | „ausgestorben“ |
| Antrostomus noctitherus (Syn. Caprimulgus noctitherus)[116] | Puerto Rican Nightjar[116] | 1911 | 1961 | 50 | VU[116] | „ausgestorben“ |
| Carpococcyx viridis | Sumatra-Laufkuckuck | 1916 | 1997 | 81 | CR[117] | „Zeit“ |
| Celeus obrieni | Caatingaspecht | 1926 | 2006 | 80 | VU[118] | „Holotyp“ |
| Bangsia flavovirens (Syn. Chlorospingus flavovirens)[119] | Yellow-green Tanager[119] | 1935 | 1972 | 37 | VU[119] | „Holotyp“ |
| Chondrohierax wilsonii | Kubaweih | 2001 | 2009 | 8 | CR[120] | „Zeit“ |
| Cisticola melanurus | Black-tailed Cisticola[121] | 1972 | 2005 | 33 | DD[121] | „Zeit“ |
| Clytoctantes alixii | Recurve-billed Bushbird[122] | 1965 | 2004 | 39 | EN[122] | „Zeit“ |
| Clytoctantes atrogularis | Rondoniaameisenwürger | 1986 | 2004 | 18 | NT[123] | „Zeit“ |
| Clytorhynchus sanctaecrucis | Nendo Shrikebill[124] | 1927 | 2004 | 77 | EN[124] | „Holotyp“ |
| Coeligena orina | Antioquiakolibri | 1951 | 2004 | 53 | EN[125] | „Holotyp“ |
| Coracornis sanghirensis (Syn. Colluricincla sanghirensis)[126] | Sangihedickkopf | 1881 | 1995 | 114 | CR[126] | „Holotyp“ |
| Columba argentina | Silbertaube | 1931 | 2008 | 77 | CR[127] | „Zeit“ |
| Conothraupis mesoleuca | Witwentangare | 1938 | 2003 | 65 | EN[128] | „Holotyp“ |
| Copsychus cebuensis | Cebuschama | 1965 | 1981 | 16 | LC[129] | „Zeit“ |
| Corvus unicolor | Banggai-Krähe | 1900 | 2007 | 107 | CR[130] | „Holotyp“ |
| Cossypha heinrichi | White-headed Robin-chat[131] | 1957 | 2005 | 48 | LC[131] | „Zeit“ |
| Laniellus langbianis (Syn. Crocias langbianis)[132] | Grey-crowned Crocias[132] | 1938 | 1994 | 56 | EN[132] | „Holotyp“ |
| Dicaeum quadricolor | Vierfarben-Mistelfresser | 1906 | 1992 | 86 | CR[133] | „ausgestorben“ |
| Diglossa gloriosissima | Maronenbauch-Hakenschnabel | 1965 | 2003 | 38 | NT[134] | „Zeit“ |
| Dysithamnus occidentalis | Bicolored Antvireo[135] | 1941 | 1991 | 50 | NT[135] | „Zeit“ |
| Eleoscytalopus psychopompus | Bahiatapaculo | 1983 | 2004 | 21 | EN[136] | „ausgestorben“ |
| Embernagra longicauda | Pale-throated Pampa-finch[137] | 1918 | 1928 | 10 | LC[137] | „Holotyp“ |
| Eriocnemis mirabilis | Blaubauch-Höschenkolibri | 1987 | 1997 | 10 | EN[138] | „Zeit“ |
| Estrilda poliopareia | Anambraastrild | 1987 | 2002 | 15 | NT[139] | „ausgestorben“ |
| Eurostopodus diabolicus | Teufelsnachtschwalbe | 1931 | 1996 | 65 | LC[140] | „Holotyp“ |
| Eutrichomyias rowleyi | Blaumonarch | 1878 | 1998 | 120 | CR[141] | „Holotyp“ |
| Eutriorchis astur | Geckoweih | 1950 | 1993 | 43 | EN[142] | „ausgestorben“ |
| Ficedula bonthaina | Lompobattang Flycatcher[143] | 1935 | 1995 | 60 | EN[143] | „Zeit“ |
| Ficedula disposita | Furtive Flycatcher[144] | 1967 | 1991 | 24 | NT[144] | „Holotyp“ |
| Ficedula henrici | Damar Flycatcher[145] | 1898 | 2001 | 103 | NT[145] | „Zeit“ |
| Formicarius rufifrons | Rufous-fronted Antthrush[146] | 1955 | 1995 | 40 | LC[146] | „Zeit“ |
| Formicivora erythronotos | Black-hooded Antwren[147] | 1850 | 1987 | 137 | EN[147] | „Zeit“ |
| Pampusana hoedtii (Syn. Alopecoenas hoedtii, Gallicolumba hoedtii)[148] | Wetartaube | 1898 | 2008 | 110 | EN[148] | „Zeit“ |
| Ianthocincla bieti (Syn. Garrulax bieti)[149] | Perlenhäherling | 1989 | 2008 | 19 | VU[149] | „Zeit“ |
| Pterorhinus courtoisi (Syn. Garrulax courtoisi)[150] | Blue-crowned Laughingthrush[150] | 1919 | 2000 | 81 | CR[150] | „Holotyp“ |
| Grallaria alleni | Moustached Antpitta[151] | 1979 | 1990 | 11 | VU[151] | „ausgestorben“ |
| Grallaria milleri | Brown-banded Antpitta[152] | 1942 | 1994 | 52 | VU[152] | „Holotyp“ |
| Hapalopsittaca fuertesi | Fuertespapagei | 1911 | 2002 | 91 | EN[153] | „Holotyp“ |
| Akialoa ellisiana (Syn. Hemignathus ellisianus)[154] | Oahu-Akialoa | 1895 | 1960 | 65 | EX[154] | „ausgestorben“ |
| Hemitriccus inornatus | Pelzeln's Tody-tyrant[155] | 1831 | 1992 | 161 | LC[155] | „Holotyp“ |
| Hemitriccus kaempferi | Ockerbrust-Todityrann | 1929 | 1991 | 62 | VU[156] | „Zeit“ |
| Athene blewitti, (Syn. Heteroglaux blewitti)[157] | Blewittkauz | 1884 | 1997 | 113 | EN[157] | „ausgestorben“ |
| Hylopezus auricularis | Masked Antpitta[158] | 1937 | 1994 | 57 | VU[158] | „Holotyp“ |
| Laniarius brauni | Angolawürger | 1957 | 2005 | 48 | EN[159] | „Zeit“ |
| Lanius newtoni | São-Tomé-Würger | 1928 | 1990 | 62 | CR[160] | „Zeit“ |
| Lepidothrix vilasboasi | Gelbscheitelpipra | 1957 | 2002 | 45 | LC[161] | „Holotyp“ |
| Leptodon forbesi | Kragenweih | 1922 | 1987 | 65 | EN[162] | „Holotyp“ |
| Loddigesia mirabilis | Violettscheitel-Flaggensylphe | 1835 | 1965 | 130 | NT[163] | „Zeit“ |
| Lophura edwardsi | Edwardsfasan | 1928 | 1996 | 68 | CR[164] | „ausgestorben“ |
| Lophura inornata | Salvadorifasan | 1950 | 1985 | 35 | NT[165] | „Zeit“ |
| Luscinia ruficeps | Rotkopfnachtigall | 1905 | 1963 | 58 | EN[166] | „Holotyp“ |
| Macroagelaius subalaris | Braunachselstärling | 1953 | 2005 | 52 | EN[167] | „Zeit“ |
| Madanga ruficollis | Burupieper | 1923 | 1995 | 72 | EN[168] | „Holotyp“ |
| Chlorophoneus kupeensis (Syn. Malaconotus kupeensis ssp. kupeensis)[169] | Mount Kupe Bush-shrike[169] | 1951 | 1989 | 38 | EN[169] | „Holotyp“ |
| Melanocharis arfakiana | Arfakbeerenpicker | 1933 | 1992 | 59 | LC[170] | „Zeit“ |
| Melanospiza richardsoni | Saint Lucia Black Finch[171] | 1886 | 1929 | 43 | EN[171] | „Holotyp“ |
| Merulaxis stresemanni | Stirnhaubentapaculo | 1945 | 1995 | 50 | CR[172] | „Zeit“ |
| Moho bishopi | Ohrbüschelmoho | 1904 | 1981 | 77 | EX[173] | „Zeit“ |
| Moho braccatus | Schuppenkehlmoho | 1945 | 1960 | 15 | EX[174] | „ausgestorben“ |
| Symposiachrus boanensis (Syn. Monarcha boanensis)[175] | Boanomonarch | 1918 | 1991 | 73 | CR[175] | „Holotyp“ |
| Symposiachrus julianae (Syn. Monarcha julianae)[176] | Kofiau Monarch[176] | 1955 | 1986 | 31 | NT[176] | „Holotyp“ |
| Myrmotherula luctuosa (Syn. Myrmotherula fluminensis)[177] | Rio-de-Janeiro-Ameisenschlüpfer | 1988 | 1994 | 6 | LC[177] | „Holotyp“ |
| Nemosia rourei | Rubinkehltangare | 1941 | 1998 | 57 | CR[178] | „Zeit“ |
| Crithagra concolor (Syn. Neospiza concolor)[179] | Einfarbgirlitz | 1888 | 1991 | 103 | CR[179] | „Holotyp“ |
| Newtonia fanovanae | Fanovananewtonie | 1933 | 1989 | 56 | VU[180] | „Holotyp“ |
| Nipponia nippon | Nipponibis | 1978 | 1981 | 3 | EN[181] | „Zeit“ |
| Nyctibius leucopterus | Weißflügel-Tagschläfer | 1817 | 1993 | 176 | LC[182] | „Holotyp“ |
| Fregetta maoriana (Syn. Oceanites maorianus)[183] | Neuseeländische Sturmschwalbe | 1850 | 2003 | 153 | CR[183] | „Holotyp“ |
| Ognorhynchus icterotis | Gelbohrsittich | 1919 | 2005 | 86 | VU[184] | „Zeit“ |
| Otus alfredi | Flores-Zwergohreule | 1897 | 1994 | 97 | EN[185] | „Holotyp“ |
| Otus capnodes | Anjouan-Zwergohreule | 1886 | 1992 | 106 | EN[186] | „ausgestorben“ |
| Otus insularis | Seychellen-Zwergohreule | 1906 | 1959 | 53 | CR[187] | „ausgestorben“ |
| Otus pauliani | Komoren-Zwergohreule | 1886 | 1989 | 103 | EN[188] | „Zeit“ |
| Parotia berlepschi | Berlepschparadiesvogel | 1981 | 2005 | 24 | LC[189] | „Holotyp“ |
| Penelope albipennis | White-winged Guan[190] | 1876 | 1977 | 101 | EN[190] | „Holotyp“ |
| Perdicula manipurensis | Manipurwachtel | 1932 | 2006 | 74 | EN[191] | „Zeit“ |
| Pezoporus occidentalis | Höhlensittich | 1912 | 1979 | 67 | CR[192] | „ausgestorben“ |
| Phodilus prigoginei | Kongomaskeneule | 1951 | 1996 | 45 | EN[193] | „Holotyp“ |
| Pithys castaneus | White-masked Antbird[194] | 1937 | 2001 | 64 | NT[194] | „Holotyp“ |
| Hydrornis gurneyi (Syn. Pitta gurneyi)[195] | Goldkehlpitta | 1952 | 1986 | 34 | CR[195] | „ausgestorben“ |
| Hydrornis schneideri (Syn. Pitta schneideri)[196] | Schneider’s Pitta[196] | 1918 | 1988 | 70 | LC[196] | „Zeit“ |
| Erythropitta venusta (Syn. Pitta venusta)[197] | Graceful Pitta[197] | 1918 | 1988 | 70 | LC[197] | „Zeit“ |
| Ploceus aureonucha | Goldnackenweber | 1993 | 2006 | 13 | EN[198] | „Zeit“ |
| Ploceus megarhynchus | Großschnabelweber | 1869 | 1889 | 20 | EN[199] | „Holotyp“ |
| Ploceus ruweti | Ruwet-Weber | 1960 | 2009 | 49 | LC[200] | „Holotyp“ |
| Poecilotriccus senex | Buff-cheeked Tody-flycatcher[201] | 1830 | 1993 | 163 | LC[201] | „Holotyp“ |
| Porphyrio hochstetteri | Südinseltakahe | 1898 | 1948 | 50 | EN[202] | „ausgestorben“ |
| Pseudobulweria becki | Salomonensturmvogel | 1929 | 2007 | 78 | CR[203] | „Holotyp“ |
| Pseudobulweria macgillivrayi | Macgillivray-Sturmvogel | 1855 | 1984 | 129 | CR[204] | „Holotyp“ |
| Pseudocalyptomena graueri | Grauer's Broadbill[205] | 1909 | 1929 | 20 | VU[205] | „Zeit“ |
| Pseudonestor xanthophrys | Maui Parrotbill[206] | 1895 | 1950 | 55 | CR[206] | „ausgestorben“ |
| Pterodroma cahow | Bermudasturmvogel | 1620 | 1951 | 331 | EN[207] | „ausgestorben“ |
| Pterodroma madeira | Madeira-Sturmvogel | 1965 | 1969 | 4 | EN[208] | „ausgestorben“ |
| Pterodroma magentae | Magentasturmvogel | 1869 | 1978 | 109 | CR[209] | „ausgestorben“ |
| Pycnonotus nieuwenhuisii | Blue-wattled Bulbul[210] | 1937 | 1992 | 55 | DD[210] | „Zeit“ |
| Pyrrhula murina | Azorengimpel | 1932 | 1967 | 35 | VU[211] | „Zeit“ |
| Rallus antarcticus | Austral Rail[212] | 1959 | 1998 | 39 | VU[212] | „Zeit“ |
| Eumyias additus (Syn. Rhinomyias additus)[213] | Buru Warbling-flycatcher[213] | 1925 | 1995 | 70 | NT[213] | „Zeit“ |
| Rhinoptilus bitorquatus | Godavarirennvogel | 1848 | 1986 | 138 | CR[214] | „ausgestorben“ |
| Rhipidura malaitae | Malaita Fantail[215] | 1930 | 1990 | 60 | NT[215] | „Zeit“ |
| Sarothrura watersi | Slender-billed Flufftail[216] | 1930 | 1987 | 57 | NT[216] | „Holotyp“ |
| Crithagra flavigula (Syn. Serinus flavigula)[217] | Yellow-throated Seedeater[217] | 1886 | 1989 | 103 | EN[217] | „Zeit“ |
| Syndactyla striata (Syn. Simoxenops striatus)[218] | Bolivian Recurvebill[218] | 1935 | 1989 | 54 | LC[218] | „Holotyp“ |
| Siphonorhis brewsteri | Least Poorwill[219] | 1928 | 1969 | 41 | NT[219] | „ausgestorben“ |
| Spelaeornis badeigularis | Rusty-throated Wren-babbler[220] | 1947 | 2004 | 57 | NT[220] | „Holotyp“ |
| Stachyris herberti | Sooty Babbler[221] | 1920 | 1994 | 74 | LC[221] | „Holotyp“ |
| Thalasseus bernsteini (Syn. Sterna bernsteini)[222] | Bernsteinseeschwalbe | 1991 | 2001 | 10 | CR[222] | „ausgestorben“ |
| Synallaxis kollari | Hoary-throated Spinetail[223] | 1832 | 1966 | 134 | CR[223] | „Holotyp“ |
| Tanygnathus gramineus | Black-lored Parrot[224] | 1922 | 1980 | 58 | VU[224] | „Holotyp“ |
| Thamnophilus praecox | Südlicher Schwarzameisenwürger | 1937 | 1991 | 54 | NT[225] | „Holotyp“ |
| Thaumatibis gigantea | Giant Ibis | 1962 | 1993 | 31 | CR[226] | „Zeit“ |
| Lipaugus conditus (Syn. Tijuca condita)[227] | Grey-winged Cotinga[227] | 1942 | 1980 | 38 | VU[227] | „Holotyp“ |
| Toxostoma guttatum | Cozumelspottdrossel | 1995 | 2004 | 9 | CR[228] | „Zeit“ |
| Cincloramphus rufus (Syn. Trichocichla rufa, Megalurulus rufus)[229] | Langbein-Buschsänger | 1894 | 2003 | 109 | EN[229] | „Zeit“ |
| Turnix worcesteri | Worcesterlaufhühnchen | 1902 | 2009 | 107 | DD[230] | „ausgestorben“ |
| Tyto sororcula | Molukkeneule | 1923 | 1996 | 73 | DD | „Zeit“ |
| Tyto soumagnei | Malegasseneule | 1973 | 1993 | 20 | VU[231] | „Zeit“ |
| Vermivora bachmanii | Gelbstirn-Waldsänger | 1833 | 1901 | 68 | CR(PE)[232] | „Holotyp“ |
| Xenoglaux loweryi | Perukauz | 1976 | 2007 | 31 | VU[233] | „Zeit“ |
| Zosterops meeki | Tagulabrillenvogel | 1990 | 2004 | 14 | NT[234] | „Zeit“ |
| Quelle für Einträge in der Tabelle, sofern nicht anders angegeben: Brett R. Scheffers, Ding Li Yong, J. Berton C. Harris, Xingli Giam, Navjot S. Sodhi: The World’s Rediscovered Species: Back from the Brink? In: PLoS ONE. Band 6, Nr. 7, 2011, S. e22531, hier 5. Seite, Table 1., doi:10.1371/journal.pone.0022531 (Erste Online-Veröffentlichung am 27. Juli 2011).[235] | ||||||
1. Solche, die für ausgestorben erklärt wurden (von der Quelle der Wiederentdeckung informell für ausgestorben erklärt), aber wiederentdeckt wurden. Dieser Typ der Wiederentdeckung wird in der Tabelle als „ausgestorben“ bezeichnet.
2. Solche, die über längere Zeiträume hinweg unentdeckt geblieben sind (das heißt, eine Art bleibt unentdeckt und es liegen für eine ungewöhnliche Zeitspanne keine bestätigten Sichtungen vor). Dieser Typ der Wiederentdeckung wird in der Tabelle als „Zeit“ bezeichnet. Dabei haben sich die Autoren dafür entschieden, keinen Mindestzeitraum zu definieren, für den eine Art verschollen sein muss, um als wiederentdeckt zu gelten, sondern sie verließen sich stattdessen auf eine Expertenmeinung (das Urteil des Autors oder Wissenschaftlers), um eine Art für wiederentdeckt zu erklären. Die Autoren verwiesen in diesem Zusammenhang auf das Fehlern anerkannter Richtlinien für die Definition einer Wiederentdeckung einer Art.
3. Solche, die erste Sichtungen seit der Erfassung der Typenreihe darstellen. Dieser Typ der Wiederentdeckung wird in der Tabelle als „Holotyp“ bezeichnet und bedeutet, dass die Art vor ihrer Wiederentdeckung nur aus Typusexemplaren bekannt war (dies trifft auf 40 % der Vogelarten zu).
Alle Arten von Wiederentdeckungen wurden von der Quelle der Wiederentdeckung informell gemeldet und/oder quantifiziert. Wiederentdeckungen von Typusexemplaren aus Museumssammlungen und genetische Wiederentdeckungen (manchmal auch als Neubeschreibungen) wurden nicht berücksichtigt. (Quelle: Brett R. Scheffers, Ding Li Yong, J. Berton C. Harris, Xingli Giam, Navjot S. Sodhi: The World’s Rediscovered Species: Back from the Brink? In: PLoS ONE. Band 6, Nr. 7, 2011, S. e22531, doi:10.1371/journal.pone.0022531 (Erste Online-Veröffentlichung am 27. Juli 2011).).
- Elfenbeinspecht (Campephilus principalis): seit den 1920er Jahren mehrfach verloren gegangen geglaubte (1994 und 1996 auf der Roten Liste der IUCN als ausgestorben gelistet[115]) und wiederentdeckte Art. - Die letzte offizielle Sichtung erfolgte 1944, doch wurden erneut Hinweise auf ein mögliches Fortbestehen der Art gemeldet.[236] Die als „vom Aussterben bedroht“ (IUCN, 2020) geführte[115] und möglicherweise ausgestorbene Art gilt als Beispiel der charismatischen Megafauna (Flaggschiffart)[237][238] und hat im Zuge der Frage über ihr Aussterben sowohl im akademischen wie auch im Amateurbereich viel Aufmerksamkeit von Ornithologen erhalten.[237] Ihre zwischenzeitliche Wiederentdeckung war von Umweltskeptikern genutzt worden,[239][240] um die unter Ökologen vorherrschende Ansicht in Frage zu stellen, dass der Erde eine globale anthropogene Massenaussterben-Krise bevorsteht.[240] Ron Rohrbaugh (Cornell Lab of Ornithology), der im April 2004 die Sichtung eines Elfenbeinspechts in Arkansas gemeldet hatte, warnte im Jahr 2010 davor, aus dem Fehlen neuerer erhärtender Belege für seine und andere zurückliegenden Sichtungen der Vogelart voreilig die Ausrottung des Elfenbeinspechts zu schlussfolgern und begründete dies mit den drohenden tiefgreifenden negativen Folgen eines möglichen Romeo-Irrtums.[241] Andererseits wurde der Fall des Elfenbeinspechts, der nach seiner angeblichen Wiederentdeckung im Jahr 2004 trotz fünf Jahre andauernder intensiver Suche nicht mehr entdeckt wurde und für dessen Erhaltung ein hoher finanzieller Aufwand betrieben wurde, in der Wissenschaft aber auch als eindrückliches jüngeres Beispiel dafür genannt, dass aus dem Unterlassen der Aufführung einer ausgestorbenen Art in die Gefährdungskategorie „ausgestorben“ Kosten für den Naturschutz resultieren, insbesondere in Form eines vergeudeten Investierens von Ressourcen für Erhaltungsmaßnahmen in eine bereits ausgestorbene Art. Selbst wenn von diesen Erhaltungsmaßnahmen andere Arten profitieren sollten, könnten die Ressourcen in einem solchen Fall jedoch wohl effizienter eingesetzt werden. Für den Fall, dass die Art nach einiger Zeit doch als ausgestorben bestätigt wird, könnte es – ähnlich wie beim Lazarus-Effekt – zum Reputations- und Glaubwürdigkeitsverlust des Naturschutzes kommen.[89]

- Großschnabelweber (Ploceus megarhynchus): Die Wiederentdeckung dieser Art geschah 1889 und stellt damit den ersten dokumentierten Fall einer Wiederentdeckung dar.[75] Die Art wird seit 2021 als „stark gefährdet“ eingestuft (IUCN, 2021).[242]
- Fuertespapagei (Hapalopsittaca fuertesi): Die Art war seit 1911 nur von der Typserie sicher bekannt. Nach möglichen Sichtungen zwischen 1980 und 2000 erfolgte die erste bestätigte Sichtung und somit Wiederentdeckung 2002. Die Art ist seit 1994 als „stark gefährdet“ eingestuft (IUCN, 2021).[153]
- Gelbscheitelpipra (Lepidothrix vilasboasi): Die Art wurde seit 1957 nur von fünf am Typenfundort gesammelten Exemplaren bekannt, bis 2002 ein Männchen beobachtet und per Japannetz an einem 200 Kilometer entfernten Standort gefangen werden konnte. Seit 2021 als Least Concern („nicht gefährdet“), zuvor ab 1994 als Vulnerable („gefährdet“) und davor (1988) als „Threatened“ eingestuft (IUCN, 2021).[161]
- Bermuda-Sturmvogel (Pterodroma cahow): Die Art wurde 1620 zuletzt beobachtet, bis sie 1906 erneut gesichtet wurde.[45][207] Es dauerte jedoch bis 1951, bis das Brutgebiet entdeckt und damit die Wiederentdeckung gesichert war. Man fand damals 18 Brutpaare auf einer suboptimal geeigneten Felseninsel mit einer Gesamtfläche von einem Hektar in der Bucht Castle Harbour. Durch intensives Schutzmanagement wuchs die Population seitdem stetig an. Die Art wird immer noch als „stark gefährdet“ eingestuft (IUCN, 2018).[207] Im Jahre 2022 gab es 155 Brutpaare, die 77 Jungvögel aufzogen, was eine Gesamtbestand von etwa 550 Vögeln entspricht.[243]
- Neuseeländische Sturmschwalbe (Oceanites maorianus): Da nach der Sammlung von drei Exemplaren im 19. Jahrhundert keine weiteren Nachweise verzeichnet wurden,[183] galt die Art als seit 1850 ausgestorben[50] und wurde auch von der IUCN seit 1988 bis einschließlich 2000 offiziell als ausgestorben eingeordnet.[183] Seit 2000 wurde sie jedoch wieder verzeichnet[50] und seitdem als „vom Aussterben bedroht“ eingeordnet (IUCN, 2018).[183] – Der Fall gilt als besonders bemerkenswerter Forschungsgegenstand, da die Art möglicherweise dadurch überleben konnte, dass sie andere Nistgewohnheiten angenommen hat, als noch für das 19. Jahrhundert für die Art bekannt waren.[50]
- Salomonensturmvogel (Pseudobulweria becki): Diese Art war lediglich von einem einzelnen, 1928 auf dem Meer östlich von Neuirland (Bismarck-Archipel) und nördlich von Buka (Salomonen) gefangenen Weibchen, sowie von einem einzelnen, 1929 östlich von Rendova (New-Georgia-Archipel) gefangenen Männchen bekannt und galt dann seit 1929 als verschollen,[203] wurde seit 1994 (IUCN) als „vom Aussterben bedroht“ gelistet, jedoch von der Wissenschaft nicht ganz aufgegeben,[203] bis sie schließlich möglicherweise 2006,[45] gesichert aber 2007 (mit mindestens 30 Individuen)[235][203] und 2008 (mit maximal 160 Individuen) wiederentdeckt wurde.[244][203] Da Sturmvögel sich oft nachtaktiv verhalten, zuweilen auf unzugänglichen Felsgraten tropischer Berge mit dichter Vegetation nisten und sich über einen Großteil ihrer Zeit über dem offenen Meer befinden, können sie auch von Experten nur schwer gezielt gesichtet werden.[203] Die Entdeckung von einer hohen Anzahl (30 Individuen, darunter auch Jungtiere) Salomonensturmvögeln durch den israelischen Tourleiter und Ornithologen Hadoram Shirihai im Rahmen einer Beobachtungsreise auf dem Ozean vor dem Bismarck-Archipel bei Papua-Neuguinea im Jahr 2008 kann daher als Glücksfall gewertet werden. – Dieser Fall einer Wiederentdeckung löste Expeditionen von Birdlife International zur Suche nach den Brutkolonien der Art aus, da die Anwesenheit der Jungvögel die Nähe solcher Brutkolonien nahelegte und die Gefährdung vieler Sturmvogel-Arten dadurch erhöht wird, dass sie als Nistplätze Erdlöcher wählen, die leicht von durch den Mensch eingeführten, invasiven Fressfeinden wie Katzen und Ratten geplündert werden können.[244][203] Die Art wurde nach ihrer Entdeckung weiterhin als „vom Aussterben bedroht“ eingestuft (IUCN, 2018), da zu diesem Zeitpunkt noch immer lediglich eine sehr geringe Anzahl geschlechtsreifer Individuen bekannt war, die zudem sämtlich einer einzigen, vermutlich in der Bestandsgröße geschwundenen, Subpopulation angehörten.[203]
Die über 150 Jahre lang nicht mehr nachgewiesene Neuseeländische Sturmschwalbe und der fast 80 Jahre lang nicht mehr gesichtete Salomonensturmvogel sind, wie der über 100 Jahre verschwundene Magentasturmvogel (Pterodroma magentae), der ebenfalls über 100 Jahre verschwundene Macgillivray-Sturmvogel (Pseudobulweria macgillivrayi), der und – besonders spektakulär – der fast 300 Jahre lang verschollene Bermuda-Sturmvogel, Beispiele dafür, dass eine Anzahl auf Inseln brütender Meeresvögel vor ihrer Wiederentdeckung auffällig lange nicht mehr nachgewiesen worden waren.[45][244] Da die Brutplätze auf Inseln von vielen Meeresvogelarten nachts aufgesucht werden und die dafür genutzten Nischen und Höhlen – auch bei sich tagsüber dort aufhaltenden Arten – leicht übersehen werden, bleiben ihre Brutplätze häufig unentdeckt, was auch für manche häufige Arten mit Populationsstärken von bis zu Zehntausenden Tieren gilt.[45][244]
- Langbein-Buschsänger (Megalurulus rufus): Diese Singvogel-Art war historisch von vier, in den 1890er Jahren gesammelten Exemplaren bekannt und wurde lange Zeit für ausgestorben gehalten. Nach einer unbestätigten Meldung der Art im Jahr 1973 gelang die erste bestätigte Wiederentdeckung im Jahr 2003 im Wabu Forest Reserve (Fidschi), wo zwölf Pärchen entdeckt wurden. Die Art wird als „stark gefährdet“ eingestuft (IUCN, 2020).[229]
Mitte: Subfossile und rezente Fundorte der Takahen auf Neuseeland
Rechts: Fundorte der Nordinseltakahe auf der Nordinsel
- Südinseltakahe (Porphyrio hochstetteri): Die ehemals als eine Art (Porphyrio mantelli) zusammengefassten Takahan galten um 1930 als ausgestorben,[245] nachdem die letzten vier bekannten Exemplare 1898 entnommen worden sein sollen.[246] 1948 wurden diese größten und flugunfähigen Rallen jedoch auf der Südinsel in der Nähe vom Lake Te Anau wiedergefunden.[245][246] Als Hauptfeinde der Bestände in der Wildbahn werden vom Menschen nach Neuseeland eingeführte Arten wie der das Grasland abweidende Rothirsch und das nesträubernde Hermelin genannt.[245] Bei der „Wiederentdeckung“ der Art 1948 war das Vorkommen der Südinseltakahe auf die Murchison Mountains (Fiordland-Nationalpark) begrenzt. In den 1980er Jahren wurde ein Aufzuchtprogramm begonnen und einige Exemplare konnten auf raubtierfreien „Festlandinseln“ freigelassen werden.[202] Der Bestand umfasst über 200 Exemplare.[245][202] Die Art wird als „stark gefährdet“ eingestuft (IUCN, 2020).[202] Im Gegensatz dazu wurde die auf der Nordinsel endemische Nordinseltakahe (P. mantelli) durch anthropogen verursachten Lebensraumverlust ausgerottet und wird von der IUCN seit dem Jahr 2000 als „ausgestorben“ aufgeführt (IUCN, 2016). Von ihr existiert nur ein einziger historischer Nachweis, der aus dem Jahr 1894 stammt.[247]
- Madagaskar-Schlangenhabicht (Eutriorchis astur): Zwischen 1930 und 1993 konnte die Art nicht sicher nachgewiesen werden. Sie wird als „stark gefährdet“ eingestuft (IUCN, 2016).[142]
- Banggai-Krähe (Corvus unicolor): Die Art war lange nur von zwei Museumsexemplaren unklarer Herkunft von den Banggai-Inseln bekannt. Ihr Überleben konnte aber nach einer unbestätigten Sichtung auf Peleng (1991) durch Suche auf dieser Insel in den Jahren 2004, 2006 und 2007 auf bestätigt und die Art somit wiederentdeckt werden. Seit 2005 wird die Art als „vom Aussterben bedroht“ eingeordnet (IUCN, 2017).[130]
- Flores-Zwergohreule (Otus alfredi): Die auf Flores endemische Art wurde nach ihrer ersten Sammlung im Jahr 1896 nicht mehr gesehen, bis im Jahr 1994 Exemplare gefangen wurden. Seit 2000 wird die Art als „stark gefährdet“ eingestuft (IUCN, 2016).[185]
- Vierfarben-Mistelfresser (Dicaeum quadricolor): Die Art gehört zu mehreren vorzeitig für ausgestorben erklärten Taxa auf der Insel Cebu[89][248][69][249] und wurde seit 1906 für ausgestorben erachtet,[250][251] dann aber 1992 – also nachdem sie seit 86 Jahre nicht nachgewiesen worden war[249][89] und seit mindestens 40 Jahren als ausgestorben galt[89][252] – in einem sehr kleinen Restwaldfragment wiederentdeckt.[250][251][248][69] – Es handelt sich beim Vierfarben-Mistelfresser zudem um den ersten Fall, für den das Phänomen des „Romeo-Irrtums“ beschrieben und verwendet wurde,[89][248][69][249] da die heute vom IUCN als „vom Aussterben bedroht“ (IUCN, 2021) eingestufte Art[133][248] nach Einschätzung der Wissenschaftler einen weitaus besseren Erhaltungszustand zeigen könnte, wenn die Schutzanstrengungen zwischenzeitlich nicht infolge der irrtümlichen Einordnung als „ausgestorben“ aufgegeben worden wären.[248][69][89]
- Cebuschama (Copsychus cebuensis): Rabor führte die Art 1959 als die einzige von zehn endemischen Vogel-Taxa auf der Insel Cebu auf, die noch vorgefunden wurde.[253] Nach Rabors Veröffentlichung wurde die endemische Avifauna der Insel 1960 von der Ornithologie weitestgehend regelrecht aufgegeben.[254] In den 1970er Jahren wurde der Cebuschama aufgrund der Annahme, dass seine letzte Sichtung 1956 geschehen sei, offiziell als ausgestorben aufgeführt.[255] 1995 führte die Rote Liste die Art dagegen wieder als existent und „gefährdet“ auf.[256]
- Príncipe-Drossel (Turdus xanthorhynchus): Die auf Príncipe (São Tomé und Príncipe) endemische Art wurde seit den 1920er Jahren nicht mehr verzeichnet, bis sie 1997 wiederentdeckt wurde. Seit 2011 wird die Art als „vom Aussterben bedroht“ eingeordnet (IUCN, 2021).[257]
- Stummelschwanzstelze (Motacilla bocagii): Die auf São Tomé endemische Art war nur aus sechs vor 1928 erfolgten Nachweisen bekannt, bis sie 1990 wiederentdeckt wurde. Die Art wird als „gefährdet“ eingestuft (IUCN, 2018).[99]
- Einfarbgirlitz (Crithagra concolor): Diese auf São Tomé endemische Art war nur aus einem verbliebenen von drei zwischen 1888 und 1890 gesammelten Exemplaren bekannt[179][258] und galt deshalb als ausgestorben,[258] bis sie 1991 wiederentdeckt wurde.[258][179] Die Art wird als „vom Aussterben bedroht“ eingestuft (IUCN, 2021).[179]
- São-Tomé-Würger (Lanius newtoni): Diese auf São Tomé endemische Art war nur aus Aufzeichnungen aus den Jahren 1888 und 1928 bekannt, bis sie 1990 wiederentdeckt wurde.[160][258] Die Art wird seit 1994 als „vom Aussterben bedroht“ eingestuft (IUCN, 2021).[160]
Sowohl der Einfarbgirlitz, als auch der São-Tomé-Würger, sind Beispiele dafür, dass die Wiederentdeckung von Arten, die einst als ausgestorben galten, nicht unbedingt als Zeichen von Fortschritten beim Artenschutz zu werten ist, sondern dass in vielen Fällen Lazarus-Arten schlicht übersehen werden, weil sie äußerst selten und auf isolierte Standorte beschränkt sind. Diese beiden auf dem Inselstaat São Tomé und Príncipe einheimischen Waldvögel weisen eine bemerkenswert ähnliche Entdeckungsgeschichte auf und existieren trotz ihrer jeweiligen Wiederentdeckungen weiterhin lediglich je als sehr kleine Population (mit weniger als 250 Individuen), die aufgrund des anhaltenden Verlusts ihres Lebensraums und der Auswirkungen invasiver Fressfeinde vom Aussterben bedroht sind.[258] Neben der Stummelschwanzstelze, dem Einfarbgirlitz und dem São-Tomé-Würger galt auch der laut IUCN als „vom Aussterben bedroht“ eingestufte Zwergolivenibis (Bostrychia bocagei), eine weitere endemische Vogelart São-Tomés,[111] jahrzehntelang als verschollen.[235]
- Antioquia-Buschammer (Atlapetes blancae): Die Art war nur von drei 1971 gesammelten Museumsexemplaren bekannt, bis sie 2018 in den kolumbianischen Anden wiederentdeckt wurde. Seit 2009 wird sie als „vom Aussterben bedroht“ eingeordnet (IUCN, 2021).[259]
- Godavarirennvogel (Rhinoptilus bitorquatus): Die lokal endemische Art war historisch nur aus wenigen Aufzeichnungen bekannt und galt als ausgestorben, bis sie 1986 wiederentdeckt wurde. Seit 2000 wird sie als „vom Aussterben bedroht“ eingeordnet (IUCN, 2017). Es existiert nur eine kleine, abnehmende Population, von der es aber seit 2009 keine bestätigten Sichtungen mehr gibt.[214]
- Schwarzbrauen-Mausdrossling (Malacocincla perspicillata): Für eine Einstufung in eine Gefährdungskategorie gab die IUCN 2016 und 2020 „ungenügende Datengrundlage“ an, denn die Art war bis dahin nur vom Typusexemplar unklaren Ursprungs bekannt.[260][261] 2020 wurde die Art nach 170 Jahren auf Borneo wiederentdeckt, gefangen und fotografiert[260] und wurde in Medien als Beispiel für Lazarus-Arten angeführt.[19]
Bild 3: Lage der WWF-Ökoregion Cerrado laut WWF
Bild 3 + 4: Goldhähnchentyrann mit Verbreitung
Bild 5: Ursprüngliche Ausdehnung des Atlantischen Regenwalds laut WWF
In den 1990er und 2000er Jahren wurden ungewöhnlich viele verschollene Vogelarten in Brasilien wiederentdeckt (bis 2007 mindestens 8 Vogelarten, die seit über 40 Jahren verschollen waren),[45] darunter etwa der je nach Angabe 48[45] oder 62[235] Jahre lang verschollen gebliebene Ockerbrust-Todityrann (Hemitriccus kaempferi, auch: „Braunrücken-Spateltyrann“),[45][235] sowie der zur gleichen Gattung gehörende und über 160 Jahre nur von seinem Holotypus bekannte, dann aber in der Nähe von Manaus wiederentdeckte Pelzeln-Spateltyrann (Hemitriccus inornatus).[45][235] Ein weiteres Beispiel ist die Witwentangare (Conothraupis mesoleuca), die trotz rund 65 Jahre nach ihrer Entdeckung in Resthabitaten wiederentdeckt wurde, obwohl ihr Lebensraum, die zentral in Brasilien gelegenen und ursprünglich weitläufigen Cerrado-Landschaften, durch landwirtschaftliche Nutzung weitgehend zerstört worden war.[45][235] Ebenfalls trotz der fast vollständigen Zerstörung seines Lebensraumes, des Regenwaldes an der Atlantikküste Brasiliens, wurde auch das Rubinkehltangare (Nemosia rourei) 1998 überraschend wiederentdeckt (nachdem es nach der Erstbeschreibung nur eine Sichtung, im Jahr 1941, gegeben hatte), sowie über 100 Jahre nach seiner letzten Sichtung der Goldhähnchentyrann (Calyptura cristata, auch: Rubinkrönchen).[45][235]
Säugetiere
Das Aussterben einer Art ist selbst bei gut bekannten Taxa wie Säugetieren schwer nachzuweisen.[262] 70 Prozent der angeblich ausgestorbenen Säugetierarten sind ohnehin von weniger als fünf Sichtungen bekannt.[263] Ähnlich wie bei den Vögeln liegt auch für die Säugetiere eine ganze Anzahl von Beispielen für bereits tot gehaltene und dann doch wiederentdeckte Taxa vor, sowohl im Rang von Arten, als auch im Rang von Unterarten oder auf Ebene von Populationen.[45]
Laut einer zuerst 2010 online veröffentlichten wissenschaftlichen Studie (Fisher & Blomberg, 2011) waren zu diesem Zeitpunkt mindestens 67 von 187 Säugetierarten, die seit dem Jahr 1500 für „ausgestorben“, „in der Natur ausgestorben“ oder „vermutlich ausgestorben“ erklärt worden waren, wiederentdeckt worden.[264][265][262] Die Studie kam zu dem Schluss, dass eine in ihrer Verbreitung nicht sehr stark eingegrenzte Säugetierart verhältnismäßig häufig fälschlicherweise als ausgestorben eingestuft wird oder vermisst bleibt, wenn ihr Bestand durch Lebensraumverlust (Abholzung, landwirtschaftliche Rodung, Fragmentierung, Degradierung, Überweidung) reduziert wurde. Als ausgestorben eingestufte Säugetierarten, die durch biologische Invasion (eingeschleppte Beutegreifer und Krankheiten, vor allem Hausratte, Hauskatze, Rotfuchs, Kleiner Mungo, Haushund, Wildschwein, Wanderratte, Pazifische Ratte und eine von der Hausratte übertragene Trypanosomen-Art) oder „overkill“ (Ausrottung durch Menschen, unter anderem durch Ernte, Jagd, Verfolgung, Beifang) im Bestand reduziert wurden, werden dagegen sehr selten wiederentdeckt, sondern sind häufiger tatsächlich ausgestorben.[262][264] Demnach sei das Aussterben einer Art aufgrund von Lebensraumverlust am schwierigsten zu erkennen und die Auswirkungen des Lebensraumverlusts auf das Aussterben werden laut der Studie insbesondere im Vergleich zu den Auswirkungen durch eingeschleppte invasive Arten möglicherweise überschätzt.[262] Laut der Studie steigt die Aussterberate von Säugetierarten mit der Körpermasse und der Populationsdichte der Art. Leben jedoch noch Exemplare verschollenener Säugetierarten, so werden die Arten mit größerer Körpergröße in der Regel schneller wiederentdeckt als die mit geringerer Körpergröße. Leben noch Exemplare verschollenener Säugetierarten, so kann zudem ein erhöhter Suchaufwand die Wahrscheinlichkeit die Wiederentdeckung bei Arten mit großer Körpergröße steigern, während die Auswirkungen eines erhöhten Suchwaufwandes bei Säugetierarten mit geringer Körpergröße minimal ist und deren Wiederentdeckung in der Regel mehr Zeit in Anspruch nimmt.[262][266] Die Auswirkungen der Körpergröße durch die Erhöhung der Aussterberate einerseits und durch die Erhöhung der Wiederentdeckungswahrscheinlichkeit andererseits könnte bedeuten, dass sich diese Auswirkungen gegenseitig aufheben, sodass die Körpergröße nicht mit der Wiederentdeckungsrate von Säugetieren insgesamt statistisch zusammenhängt.[266]
| Wissenschaftlicher Name | Trivialname des Taxons | Jahr der letzten Sichtung | Jahr der Wiederentdeckung | Jahre verschollen | IUCN-Status | Typ der Wiederentdeckung *) |
|---|---|---|---|---|---|---|
| Acerodon humilis | Talaud-Flughund | 1899 | 1999 | 100 | EN[267] | „ausgestorben“ |
| Acomys nesiotes | Zypern-Stachelmaus | 1980 | 2007 | 27 | DD[268] | „Zeit“ |
| Allocebus trichotis | Büschelohrmaki | 1875 | 1989 | 114 | EN[269] | „Holotyp“ |
| Arctocephalus philippii | Juan-Fernández-Seebär | 1900 | 1965 | 65 | LC[270] | „ausgestorben“ |
| Arctocephalus townsendi | Guadalupe-Seebär | 1850 | 1954 | 104 | LC[271] | „ausgestorben“ |
| Balantiopteryx infusca | Ecuador-Sackflügelfledermaus | 1891 | 1991 | 100 | VU[272] | „Holotyp“ |
| Brachytarsomys villosa | Hairy-tailed Tree Rat[273] | 1962 | 2001 | 39 | VU[273] | „Holotyp“ |
| Bunolagus monticularis | Buschmannhase | 1902 | 1929 | 27 | CR[274] | „Holotyp“ |
| Carpomys melanurus | Schwarzschwanz-Luzon-Baumratte | 1896 | 2008 | 112 | DD[275] | „ausgestorben“ |
| Sapajus flavius (Syn. Cebus flavius)[276] | Goldkapuziner | 1774 | 2006 | 232 | EN[276] | „Holotyp“ |
| Cercopithecus sclateri | Nigeria-Blaumaulmeerkatze | N/A | 1988 | N/A | EN[277] | „ausgestorben“ |
| Chacodelphys formosa | Chaco-Beutelratte | 1920 | 2004 | 84 | NT[278] | „Holotyp“ |
| Chaetomys subspinosus | Borstenbaumstachler | N/A | 1989 | N/A | VU[279] | nicht eingestuft |
| Cheirogaleus sibreei | Rückenstreifen-Fettschwanzmaki | 1894 | 2001 | 107 | CR[280] | nicht eingestuft |
| Chinchilla chinchilla | Kurzschwanz-Chinchilla | 1953 | 2001 | 48 | EN[281] | „ausgestorben“ |
| Chinchilla lanigera | Langschwanz-Chinchilla | 1955 | 1978 | 23 | EN[282] | „ausgestorben“ |
| Chodsigoa sodalis | Kleine Taiwan-Spitzmaus | 1913 | 1997 | 84 | DD[283] | „Holotyp“ |
| Crocidura andamanensis | Andamanen-Weißzahnspitzmaus | 1902 | 1999 | 97 | CR[284] | „Holotyp“ |
| Crocidura caliginea | N/A | 1990 | N/A | LC[285] | „Zeit“ | |
| Crocidura dhofarensis | Dhofarian Shrew[286] | 1977 | 2005 | 28 | DD[286] | „Zeit“ |
| Crocidura jenkinsi | Jenkins-Weißzahnspitzmaus | 1978 | 1999 | 21 | CR[287] | „Holotyp“ |
| Crocidura macmillani | Macmillan’s Shrew[288] | 1915 | 2002 | 87 | NT[288] | „Holotyp“ |
| Crocidura picea | Cameroon Shrew[289] | 1940 | 1999 | 59 | EN[289] | „Holotyp“ |
| Crocidura trichura | Weihnachtsinsel-Spitzmaus | 1908 | 1985 | 77 | CR(PE)[290] | „ausgestorben“ |
| Cryptochloris zyli | Van Zyls Goldmull | 1938 | 2003 | 65 | EN[291] | „Holotyp“ |
| Cryptotis endersi | Ender’s Small-eared Shrew[292] | 1941 | 1980 | 39 | EN[292] | „Holotyp“ |
| Cryptotis nelsoni | Nelson’s Small Eared Shrew[293] | 1900 | 2009 | 109 | CR[293] | „ausgestorben“ |
| Dactylopsila tatei | Tate-Streifenbeutler | 1932 | 1992 | 60 | EN[294] | „Zeit“ |
| Diplogale hosei | Schlichtroller | 1955 | 2005 | 50 | VU[295] | „Zeit“ |
| Dipodomys insularis | 1989 | 2005 | 16 | CR | „ausgestorben“ | |
| Dobsonia chapmani | Negros Naked-backed Fruit Bat[296] | 1975 | 2001 | 26 | CR[296] | „ausgestorben“ |
| Ectophylla alba | Weiße Fledermaus | 1885 | 1961 | 76 | NT[297] | „Holotyp“ |
| Eupetaurus cinereus | Felsgleithörnchen | 1924 | 1994 | 70 | EN[298] | „ausgestorben“ |
| Funisciurus duchaillui | Duchaillu-Rotschenkelhörnchen | 1952 | 1993 | 41 | DD[299] | „Holotyp“ |
| Geocapromys ingrahami | Bahaman Hutia[300] | N/A | 1966 | N/A | VU[300] | „ausgestorben“ |
| Glischropus javanus | Javan Thick-thumbed Bat[301] | 1939 | 2004 | 65 | DD[301] | „Zeit“ |
| Gymnobelideus leadbeateri | Hörnchenbeutler | 1910 | 1961 | 51 | CR[302] | „Zeit“ |
| Harpiola grisea | Peter’s Tube-nosed Bat[303] | 1872 | 2002 | 130 | DD[303] | „Holotyp“ |
| Hipposideros coronatus | Large Mindanao Leaf-nosed Bat[304] | 1871 | 2002 | 131 | DD[304] | „Holotyp“ |
| Hipposideros marisae | Aellen's Roundleaf Bat[305] | 1989 | 2009 | 20 | VU[305] | „Zeit“ |
| Hipposideros ridleyi | Ridley-Rundblattnase | 1910 | 1974 | 64 | VU[306] | „Zeit“ |
| Kerivoula africana | Tanzanian Woolly Bat[307] | N/A | 2000 | N/A | EN[307] | „Zeit“ |
| Latidens salimalii | Salim-Ali-Fruchtfledermaus | 1948 | 1993 | 45 | EN[308] | „Holotyp“ |
| Leptomys signatus | Fly River Leptomys[309] | 1936 | 2003 | 67 | LC[309] | „Holotyp“ |
| Notamacropus parma (Syn. Macropus parma)[310] | Parmawallaby | 1932 | 1966 | 34 | NT[310] | „ausgestorben“ |
| Marmosa andersoni | Andersons Zwergbeutelratte | 1954 | 1997 | 43 | DD[311] | „Holotyp“ |
| Mesocapromys angelcabrerai | Cabrera-Baumratte | 1979 | 2004 | 25 | CR[312] | „ausgestorben“ |
| Microakodontomys transitorius | Brasilia-Ratte | 1993 | 2003 | 10 | EN[313] | „Holotyp“ |
| Microcebus myoxinus | Zwerg-Mausmaki | 1893 | 1993 | 100 | VU[314] | „ausgestorben“ |
| Microtus bavaricus | Bayerische Kurzohrmaus | 1976 | 2004 | 28 | CR[315] | „ausgestorben“ |
| Muntiacus montanus | Sumatran Mountain Muntjac[316] | 1930 | 2008 | 78 | DD[316] | „ausgestorben“ |
| Muntiacus rooseveltorum | Roosevelts' Muntjac[317] | 1929 | 1994 | 65 | DD[317] | „ausgestorben“ |
| Mustela nigripes | Schwarzfußiltis | 1975 | 1981 | 6 | EN[318] | „ausgestorben“ |
| Myotis planiceps | Flat-headed Myotis[319] | 1970 | 2004 | 34 | EN[319] | „ausgestorben“ |
| Natalus primus | Großes Kuba-Trichterohr | 1919 | 1992 | 73 | VU[320] | „ausgestorben“ |
| Neopteryx frosti | Kleinzähniger Flughund | 1939 | 1985 | 46 | EN[321] | „Holotyp“ |
| Nesolagus netscheri | Sumatra-Kaninchen | 1972 | 2000 | 28 | DD[322] | nicht eingestuft |
| Nesoromys ceramicus | Seram-Ratte | 1920 | 1987 | 67 | EN[323] | „Holotyp“ |
| Nesoryzomys fernandinae | Fernandina Rice Rat[324] | 1979 | 1995 | 16 | VU[324] | „Zeit“ |
| Nesoryzomys swarthi | Santiago Galapagos Mouse[325] | 1906 | 1997 | 91 | VU[325] | „ausgestorben“ |
| Nomascus nasutus | Östlicher Schwarzer Schopfgibbon | 1965 | 2002 | 37 | CR[326] | „ausgestorben“ |
| Nyctimene malaitensis | Malaita Tube-nosed Bat[327] | 1968 | 2004 | 36 | LC[327] | nicht eingestuft |
| Onychogalea fraenata | Kurznagelkänguru | 1944 | 1974 | 30 | VU[328] | „ausgestorben“ |
| Oreonax flavicauda | Gelbschwanz-Wollaffe | 1926 | 1974 | 48 | CR[329] | „ausgestorben“ |
| Oryzomys gorgasi | 1971 | 2001 | 30 | EN[330] | „Holotyp“ | |
| Otomops formosus | Java Giant Mastiff Bat[331] | 1939 | 1990 | 51 | DD[331] | „Holotyp“ |
| Parantechinus apicalis | Sprenkelbeutelmaus | 1884 | 1967 | 83 | EN[332] | „ausgestorben“ |
| Catopuma badia (Syn. Pardofelis badia)[333] | Borneo-Goldkatze | 1928 | 1992 | 64 | EN[333] | „Zeit“ |
| Petaurus gracilis | Mahagoni-Gleithörnchenbeutler | 1886 | 1989 | 103 | EN[334] | nicht eingestuft |
| Petinomys fuscocapillus | Travancore-Gleithörnchen | 1889 | 1989 | 100 | LC[335] | „Holotyp“ |
| Phaenomys ferrugineus | Rio-de-Janeiro-Ratte | 1940 | 1998 | 58 | EN[336] | „Zeit“ |
| Phoniscus papuensis | Golden-tipped Bat[337] | 1897 | 1981 | 84 | VU[337] | „Zeit“ |
| Phyllomys unicolor | Einfarb-Küstenbaumratte | 1824 | 2004 | 180 | CR[338] | „Holotyp“ |
| Phyllonycteris aphylla | Jamaika-Blütenfledermaus | 1898 | 1957 | 59 | CR[339] | „ausgestorben“ |
| Plagiodontia aedium | Cuvier’s Hutia[340] | 1836 | 1948 | 112 | EN[340] | „ausgestorben“ |
| Porcula salvania | Zwergwildschwein | 1965 | 1971 | 6 | EN[341] | „ausgestorben“ |
| Potorous gilbertii | Gilbert-Kaninchenkänguru | 1900 | 1994 | 94 | CR[342] | „ausgestorben“ |
| Prionailurus planiceps | Flachkopfkatze | 1985 | 1995 | 10 | EN[343] | „Zeit“ |
| Prolemur simus | Großer Bambuslemur | 1955 | 1986 | 31 | CR[344] | „ausgestorben“ |
| Pseudantechinus mimulus | Kleine Fettschwanz-Beutelmaus | 1906 | 1967 | 61 | NT[345] | „Holotyp“ |
| Pseudomys novaehollandiae | New Holland Mouse[346] | 1887 | 1967 | 80 | VU[346] | „ausgestorben“ |
| Pteralopex anceps | Bougainville-Affengesichtflughund | 1925 | 1995 | 70 | EN[347] | „ausgestorben“ |
| Pteropus gilliardorum | Gilliard's Flying Fox[348] | 1959 | 1994 | 35 | VU[348] | „Holotyp“ |
| Pteropus nitendiensis | Temotu Flying Fox[349] | 1926 | 2001 | 75 | EN[349] | nicht eingestuft |
| Rattus giluwensis | Giluwe Rat[350] | 1983 | 2005 | 22 | LC[350] | „Zeit“ |
| Rhagomys rufescens | Brazilian Arboreal Mouse[351] | 1917 | 2003 | 86 | VU[351] | „ausgestorben“ |
| Rhinolophus maclaudi | Maclaud's Horseshoe Bat[352] | 1967 | 2007 | 40 | EN[352] | „Zeit“ |
| Rhinolophus osgoodi | Osgoods Hufeisennase | 1939 | 2003 | 64 | LC[353] | „Holotyp“ |
| Rhinopithecus avunculus | Tonkin-Stumpfnase | 1912 | 1992 | 80 | CR[354] | „Holotyp“ |
| Rhynchomys isarogensis | Mount-Isarog-Nasenratte | 1981 | 1988 | 7 | VU[355] | „Zeit“ |
| Rucervus eldii | Leierhirsche | N/A | 1975 | N/A | EN[356] | „ausgestorben“ |
| Santamartamys rufodorsalis | Rotschopf-Baumratte | 1899 | 2008 | 109 | CR[357] | „Holotyp“ |
| Sminthopsis longicaudata | Langschwänzige Schmalfußbeutelmaus | 1935 | 1984 | 49 | LC[358] | „ausgestorben“ |
| Sminthopsis psammophila | Dünen-Schmalfuß-Beutelmaus | 1894 | 1969 | 75 | VU[359] | „ausgestorben“ |
| Atopogale cubana (Syn. Solenodon cubanus)[360] | Kubanischer Schlitzrüssler | 1890 | 1975 | 85 | EN[360] | „ausgestorben“ |
| Solenodon paradoxus | Dominikanischer Schlitzrüssler | N/A | 2007 | N/A | LC[361] | „ausgestorben“ |
| Sus bucculentus | Annamitisches Pustelschwein | 1892 | 1995 | 103 | EX[362] | „Holotyp“ |
| Tarsius pumilus | Zwergkoboldmaki | 1921 | 2009 | 88 | EN[363] | „ausgestorben“ |
| Tokudaia muenninki | Okinawa Spiny Rat[364] | 1978 | 2008 | 30 | CR[364] | „Zeit“ |
| Tolypeutes tricinctus | Nördliches Kugelgürteltier | 1973 | 1993 | 20 | VU[365] | „ausgestorben“ |
| Viverra civettina | Malabar-Zibetkatze | 1971 | 1987 | 16 | CR(PE)[366] | „ausgestorben“ |
| Zaglossus attenboroughi | Attenborough-Langschnabeligel | 1961 | 2007 | 46 | CR[367] | „Holotyp“ |
| Zyzomys pedunculatus | Zentralaustralische Dickschwanzratte | 1966 | 1996 | 30 | CR[368] | „ausgestorben“ |
| Quelle für Einträge in der Tabelle, sofern nicht anders angegeben: Brett R. Scheffers, Ding Li Yong, J. Berton C. Harris, Xingli Giam, Navjot S. Sodhi: The World’s Rediscovered Species: Back from the Brink? In: PLoS ONE. Band 6, Nr. 7, 2011, S. e22531, hier 5. Seite, Table 1., doi:10.1371/journal.pone.0022531 (Erste Online-Veröffentlichung am 27. Juli 2011).[235] | ||||||
1. Solche, die für ausgestorben erklärt wurden (von der Quelle der Wiederentdeckung informell für ausgestorben erklärt), aber wiederentdeckt wurden. Dieser Typ der Wiederentdeckung wird in der Tabelle als „ausgestorben“ bezeichnet und trifft auf die Mehrheit der Säugetierarten zu.
2. Solche, die über längere Zeiträume hinweg unentdeckt geblieben sind (das heißt, eine Art bleibt unentdeckt und es liegen für eine ungewöhnliche Zeitspanne keine bestätigten Sichtungen vor). Dieser Typ der Wiederentdeckung wird in der Tabelle als „Zeit“ bezeichnet. Dabei haben sich die Autoren dafür entschieden, keinen Mindestzeitraum zu definieren, für den eine Art verschollen sein muss, um als wiederentdeckt zu gelten, sondern sie verließen sich stattdessen auf eine Expertenmeinung (das Urteil des Autors oder Wissenschaftlers), um eine Art für wiederentdeckt zu erklären. Die Autoren verwiesen in diesem Zusammenhang auf das Fehlern anerkannter Richtlinien für die Definition einer Wiederentdeckung einer Art.
3. Solche, die erste Sichtungen seit der Erfassung der Typenreihe darstellen. Dieser Typ der Wiederentdeckung wird in der Tabelle als „Holotyp“ bezeichnet und bedeutet, dass die Art vor ihrer Wiederentdeckung nur aus Typusexemplaren bekannt war.
Alle Arten von Wiederentdeckungen wurden von der Quelle der Wiederentdeckung informell gemeldet und/oder quantifiziert. Wiederentdeckungen von Typusexemplaren aus Museumssammlungen und genetische Wiederentdeckungen (manchmal auch als Neubeschreibungen) wurden nicht berücksichtigt. (Quelle: Brett R. Scheffers, Ding Li Yong, J. Berton C. Harris, Xingli Giam, Navjot S. Sodhi: The World’s Rediscovered Species: Back from the Brink? In: PLoS ONE. Band 6, Nr. 7, 2011, S. e22531, doi:10.1371/journal.pone.0022531 (Erste Online-Veröffentlichung am 27. Juli 2011).).
Ursäuger (Kloakentiere)
- Attenborough-Langschnabeligel (Zaglossus attenboroughi): Diese Art aus der kleinen Familie der Ameisenigel wurde bisher ausschließlich innerhalb der Zyklopenberge (englisch Cyclops Mountains) (im Norden Papuas) erfasst.[370] Die Art war lange nur aus einem einzigen Exemplar bekannt, das 1961 in den Zyklopenbergen im Norden von Niederländisch-Neuguinea (heute: indonesische Provinz Papua) entnommen und in eine wissenschaftliche Sammlung überführt wurde. Die Art galt daher als äußerst selten und es wurde damit gerechnet, dass sie ausgestorben sein könnte,[371] bis im Mai 2007 in den Zyklopenberge Feldstudien zur Untersuchung des weiteren Überlebens der Art durchgeführt wurden, während derer zwar keine Ameisenigel beobachtet, aber Ameisenigelaktivität (diagnostische Anzeichen von Ameisenigelfraß wie Abdrücke von Nasenstößen oder rezente Grabaktivitäten) festgestellt wurden.[371][367] Zusammen mit Berichten und Beobachtungen bestätigen diese Spuren den Fortbestand von Langschnabeligeln (Ameisenigel der Gattung Zaglossus), wobei Beschreibungen lokaler Informanten stark darauf hindeuteten, dass sich die Berichte auf den Attenborough-Langschnabeligel beziehen.[371][367] Scheffers und Andere (2011) führten die Art bereits als im Jahre 2007 wiederentdeckt auf.[235] Re:wild führte die Art als eine wiedergefundere Art ihrer 25 Arten umfassenden Liste der „Top Most Wanted Lost Species“ auf.[82] Im November 2023 wurde gemeldet, dass die Art in Form von Fotografien und Videoaufnahmen durch Wildkameras in den Zyklopenbergen dokumentiert wurde.[370][372][373] Gegenwärtig wird die Art als „vom Aussterben bedroht“ geführt (IUCN, 2016).[367]
Beuteltiere
- Hörnchenbeutler (Gymnobelideus leadbeateri): Die 1867 beschriebene Art galt seit Beginn des 20. Jahrhunderts als ausgestorben, wurde 1961 wiederentdeckt[89][235] und später in Australien aufgrund des im 20. Jahrhundert erfolgten und für die Zukunft erwarteten Lebensraumverlustes als gefährdet eingestuft.[89] – Da es als wahrscheinlich gilt, dass die inzwischen zum Erhalt der Art erfolgten Änderungen in der Waldbewirtschaftung früher erfolgt wären, wenn die Art nicht verfrüht als ausgestorben eingestuft worden wäre, handelt es sich bei diesem Fall um ein Beispiel für den Romeo-Irrtum.[89] Gegenwärtig wird die Art als „vom Aussterben bedroht“ geführt (IUCN, 2016).[302]
- Parmawallaby (Macropus parma): Nachdem 1932 die letzten bekannten Exemplare dieser in Australien endemischen Art in New South Wales entnommen waren, schien die Art dort aufgrund von anthropogener Lebensraumzerstörung verschwunden zu sein. Tatsächlich waren Parmawallabys jedoch bereits 1870 zusammen mit mehreren anderen Wallabys-Arten vom Menschen auf der vor Neuseeland liegenden Insel Kawau eingeführt worden, wo sich ein recht dichter Bestand der Art entwickelte. Aufgrund von Verwechslung mit den anderen dort vorkommenden Wallaby-Arten blieb dieser Bestand auf Kawau jedoch von der Wissenschaft unerkannt bis zum Jahr 1965. Nach Bekanntwerden seiner Zugehörigkeit zum Parmawallaby wurde er 1969 unter Schutz gestellt und es wurden intensive Maßnahmen ergriffen, um Exemplare einzufangen und mit ihnen an anderen Orten Zuchtkolonien zu gründen. 1967 wurde die Art dann auch in New South Wales wiederentdeckt, wo sie an einem langen Küstenstreifen überlebt hatte.[375] Die Art wird als „potenziell gefährdet“ eingestuft (IUCN, 2019).[310]
- Gilbert-Kaninchenkänguru (Potorous gilbertii): Diese Beuteltierart aus der Familie der Rattenkängurus lebte subfossilen und modernen Daten zufolge vermutlich auch in der Vergangenheit geografisch lediglich begrenzt auf die Region der Südküste Westaustraliens nahe Margaret River bis in die Nähe von Albany verbreitet. Nach Nachweisen zwischen 1840 und 1879 in der Region des King George Sound galt die Art trotz gezielter Suche als ausgestorben, bis 1994 eine Population der Art am Mount Gardner im Two Peoples Bay Nature Reserve wiederentdeckt wurde, die aber durch einen Waldbrand im November 2015 nahezu ausgelöscht wurde. Die Einführung der Art im Bald Island Nature Reserve, die Wiederansiedlung auf einer umzäunten Festlandinsel im Waychinicup-Nationalpark und die Zucht einer Kolonie in Gefangenschaft waren nur begrenzt erfolgreich, so dass die IUCN die Art seit 2016 (wie zuvor bereits 1996 und 2008) als „vom Aussterben bedroht“ einstuft.[342]
- Wondiwoi-Baumkänguru (Dendrolagus mayri): Die Art war bisher nur von einem einzigen, 1928 auf der Wandammenhalbinsel (Westneuguinea/Indonesien) gesammelten, adulten Männchen bekannt. Sie wurde 2016 als „vom Aussterben bedroht“ eingestuft (IUCN, 2016), weil ihr Bestand, falls ein solcher noch existieren sollte, nur weniger als 50 Tiere umfassen kann.[376] Es gab Befürchtungen, die Art könne bereits ausgestorben sein. 2018 meldeten Medien, es sei ein Exemplar fotografiert und das Foto von einem Experten als dem Wondiwoi-Baumkänguru zugehörig bestätigt worden.[377]
Höhere Säugetiere (Plazentatiere)
- Java-Nashorn (Rhinoceros sondaicus): die ursprünglich vom früheren Ostbengalen (heute Bangladesch) im Westen bis nach Südwestchina, Indochina, Sumatra und Java im Osten verbreitete Art ist auch in ihrem heutigen Hauptverbreitungsareal (die dicht menschlich besiedelte Insel Java, bekanntester Zufluchtsort des Nashorns ist das Ujung-Kulon-Reservat) sehr selten (heute rund 50 Individuen) und galt in ihrem einstigen Festlandsareal, wo sie als taxonomisch umstrittene Unterart R. s. inermis geführt worden war, rund 40 Jahre lang als vollständig ausgerottet, bis sie Ende des 20. Jahrhunderts mit großer sensationeller Wirkung im Süden Vietnams in Form eines sehr kleinen Bestands wiederentdeckt wurde,[379][45][380] von dem das letzte Tier dann aber doch 2010 von Wilderern erlegt aufgefunden wurde.[381][382][383] – Dieser Fall gilt als Beispiel dafür, dass auch äußerst aufsehenerregende Großsäuger vom Lazarus-Effekt betroffen sein können.[45] Er steht zudem beispielhaft dafür, dass Ökologen im Falle einer Lazarus-Art oft vor dem Dilemma stehen können, dass die Bekanntmachung einer Entdeckung zwar zur Mobilisierung der öffentlichen Unterstützung für den Schutz der Art beitragen kann, gleichzeitig aber auch die Aufmerksamkeit der Wilderer auf die Art lenken kann, die dadurch in einen selbstverstärkenden Prozess des Aussterbens geraten kann, wenn jede Tötung eines Individuums den Schwarzmarktwert der verbleibenden Tiere und damit den Anreiz zum Wildern erhöht.[381][383]
- Sumatra-Nashorn (Dicerorhinus sumatrensis): Die Art war bis ins frühe 20. Jahrhunderts im größten Teil Südostasiens weitverbreitet, bis zu den 1970er Jahren jedoch durch Bejagung auf der Malaiischen Halbinsel, auf Sumatra und auf Borneo mit Ausnahme kleiner Gebiete ausgerottet worden.[383] Weltweit überlebten nach Schätzungen, die auf Daten aus den Jahren 2005 bis 2009 beruhen, noch rund 200 bis 300 Individuen der gesamten Art,[383] nach neueren Schätzungen aus den Jahren 2013 und 2016 noch rund 100.[383][386][387] Es handelt sich bei diesen Tieren zugleich um die letzten lebenden Vertreter der 25 Millionen Jahren zurückreichenden eurasischen zweihörnigen Nashörner, zu denen im Quartär auch das Wollnashorn (Coelodonta antiquitatis) gehörte, und die die wohl ursprünglichste und bei weitem älteste noch existierenden Gruppe aus der im Eozän entstandenen Familie der Nashörner darstellen.[388][379][385][32] Innerhalb der Nashörner kann nur das Sumatranashorn als altertümlichste rezente Art der Familie als „lebendes Fossil“ angesehen werden.[32] Die im indonesischen Teil Borneos beheimatete Teilpopulation der Art galt bereits seit 1986 als ausgestorben, als 2013 Belege für das Überleben von Tieren dieser Population bekannt wurden und weltweit auf große mediale Resonanz stießen.[389][390] 2013 erfolgte dann laut dem WWF die erste bestätigte Sichtung eines Exemplars in diesem Gebiet seit der vorangegangenen 40 Jahre.[387] – Am Beispiel dieses Falls wurde diskutiert, dass das Vorgehen des Artenschutzmanagements im Falle einer Wiederentdeckung sorgfältig erwogen werden muss.[34] Es wurde argumentiert, dass die Population im indonesischen Teil Borneos möglicherweise gerade aufgrund des Mangels an Aufmerksamkeit überleben konnte, der aus der jahrzehntelangen Einschätzung als ausgestorben resultierte.[383] Es wurde vermutet, dass durch die Bekanntmachung der Wiederentdeckung in einem solchen Fall die Aufmerksamkeit der Wilderei für die betroffene Population und damit der Bejagungsdruck erhöht wird, so dass das tatsächliche Aussterben der Population ausgelöst werden könne,[383][391] wenn nicht sofortige Erhaltungsmaßnahmen dagegen ergriffen würden.[383][34]
- Zwergwildschwein (Porcula salvania, Syn.: Sus salvania): Diese Art galt seit den 1950er Jahren als durch Lebensraumzerstörung ausgestorben.[392][393][394] 1971 kam es zur Wiederentdeckung, als ein Bekannter Gerald Durrells für dessen Jersey Zoo in Indien vier auf einem Markt zum Verkauf angebotene Zwergwildschweine aus dem Manas-Nationalpark in Assam ausfindig machte.[394][393] Später erfolgten weitere Entdeckungen von Beständen im Barnardi Wildlife Sanctuary. Der Gesamtrestbestand der Art betrug zu jener Zeit rund 150 Individuen.[392] Anfängliche Züchtungsversuche blieben erfolglos.[394] Durrells Engagement führte zu Maßnahmen, die Individuen der Wildbestände aufzufinden, einzufangen und in menschlicher Obhut zu züchten, um die Bestände der Art durch das Zucht- und Auswilderungsprogramm zu sichern.[393] 1995 wurde das Pygmy Hog Research and Breeding Centre bei Guwahati gegründet, das zu erfolgreicher Nachzucht führte, die jedoch auf die sehr begrenzte Anzahl von 2 männlichen und 4 weiblichen Gründertieren aus dem Manas National Park zurückgeht.[392][394] 2005 kam der Balipara Reserve Forest in Potasali nahe dem Nameri National Park als zusätzliche Zuchtstation zur dezentralisierteren Anlage des Arterhaltungsbestandes dazu und es kam in der Folge zu erfolgreichen Auswilderungen von Nachzuchten in verschiedene Reservate.[392] Beim als „stark gefährdet“ (IUCN, 2019) eingestuften[341] Zwergwildschwein handelte oder handelt es sich um die weltweit seltenste Schweineart,[395] dem von seinem ursprünglichen Verbreitungsgebiet südlich des Himalajas von Uttar Pradesh im Westen bis Assam und Sikkim im Osten nur noch Reste in Schutzgebieten in Assam geblieben sind.[392] – Dieser Fall kann als Beispiel dafür genannt werden, dass die Wissenschaft informelle Datenquellen zum Vorkommen ausgestorben geglaubter Arten sorgfältig prüfen und berücksichtigen muss, um gegebenenfalls möglichst schnell Erhaltungsmaßnahmen einleiten zu können, da der Artenschutz sonst im Falle von unerwarteten Wiederentdeckungen unvorbereitet sein kann.[393]
- Juan-Fernández-Seebär (Arctocephalus philippii): Diese Art ist als „nicht gefährdet“ (IUCN, 2015) eingestuft. Sie galt aber um 1900 und bis Mitte des 20. Jahrhunderts als ausgestorben, bis sie 1965 durch Sichtung kleiner Gruppen von Individuen auf den Inseln Alejandro Selkirk und Robinson Crusoe wiederentdeckt wurde.[270]
- Guadalupe-Seebär (Arctocephalus townsendi): Diese Art ist als „nicht gefährdet“ (IUCN, 2015) eingestuft. Sie war aber Ende des 19. Jahrhunderts durch Bejagung fast ausgerottet und bis 1926 nicht mehr nachgewiesen worden. Daraufhin wurden alle noch aufgefundenen Tiere zur Pelzgewinnung getötet, das letzte im Jahr 1928, und die Art wurde zum zweiten Mal für ausgestorben erklärt. Nach vereinzelten, unbestätigten Meldungen in den 1930er Jahren wurde die Art 1954 durch eine Expedition nach Guadalupe wieder sicher nachgewiesen und von der Regierung Mexikos unter strengen Schutz gestellt.[271]
- Bayerische Kurzohrmaus (Microtus bavaricus): Die Art lebt endemisch in den nordöstlichen Alpen und war zunächst nur von einem Standort im Landkreis Garmisch-Partenkirchen bekannt, wo sie zuletzt 1962 nachgewiesen wurde.[315] 1976/1977 wurde ein zweiter Bestand in Nordtirol entdeckt, der aber erst im Jahr 2000 molekularbiologisch der Art zugeordnet wurde, worauf die Art 28 Jahre verschollen blieb, bis dieser Bestand im Jahr 2004 bestätigt werden konnte.[235] Von 1986 bis 2002 wurde die Art von der IUCN als „ausgestorben“ geführt, seit 2008 als „vom Aussterben bedroht“ (IUCN, 2019).[315] – Dieser Fall stellt insofern eine Ausnahme dar, als es in Deutschland nur selten zu einem Lazarus-Effekt kommt. Der Bereichsleiter Artenschutz des WWF Deutschland, Arnulf Köhncke, verwies in diesem Zusammenhang darauf, dass in der Flora und Fauna Deutschlands „nur ganz wenige endemische Arten“ – insbesondere von größerer Körpergröße – vorkommen. Da aber eine Art auch in jedem anderen Land ausgestorben sein muss, um weltweit wiederentdeckt zu werden, begrenzt der Mangel endemischer Arten die Anzahl der möglichen Lazarus-Arten in Deutschland. Als noch ausschlaggebenderen Grund für die geringe Anzahl an Lazarus-Arten in Deutschland nannte Köhncke den Umstand, dass in einer „industriell so flächendeckend überformten Welt“ wie in Deutschland Wiederentdeckungen weit weniger wahrscheinlich seien, als in naturnahen Gebieten, da die Arten in der Regel tatsächlich ausgestorben seien.[396]
- Dinagat-Borkenratte (Crateromys australis): Diese auf den Philippinen endemische Art wurde anhand eines zwischen 1974 und 1975 gesammelten Exemplars beschrieben und 2012 wiederentdeckt.[397]
- Kalimantan-Langur (Presbytis canicrus oder Presbytis hosei canicrus): Diese auch als Unterart des Hose-Langurs geführte Art aus der Gattung der Mützenlanguren wird zu den 25 am stärksten gefährdeten Primatentaxa gezählt. 2004 gab es erste Befürchtungen seitens Wissenschaftlern, dass die Unterart ausgestorben sein könnte. Bei 2011 durchgeführten und 2012 veröffentlichten Freilanduntersuchungen konnte dann das Überleben der Unterart auf Borneo sicher nachgewiesen werden.[398] Die Art in ihrer Gesamtheit wird als „stark gefährdet“ eingestuft (IUCN, 2021).[399]
- Goldkapuziner (Sapajus flavius, Syn. Cebus flavius): Schreber (1774) beschrieb diese Primatenart anhand einer Abbildung (Tafel 31-b), doch gab es von der Art in wissenschaftlichen Sammlungen keine Exemplare, so dass das von Schreber abgebildete Tier nie richtig von anderen Wissenschaftlern zugeordnet wurde. Schließlich betrachteten Oliveira und Langguth (2006) ein im brasilianischen Bundesstaat Pernambuco gesammeltes Exemplar als Neotyp von Simia flavia (Schreber, 1774) und benannten die Art als Cebus flavius (Schreber, 1774).[276] Damit war die Art nach 232 Jahren wiederentdeckt,[235] wurde 2008 und 2015 von der IUCN als „vom Aussterben bedroht“ und seit 2020 als „stark gefährdet“ eingestuft.[276]
- Rotschopf-Baumratte (Santamartamys rufodorsalis): Diese Art aus der Familie der Stachelratten war seit 1898 nur von ihrem Holotyp und einem anderen, vor 1919 gesammelten Exemplar unbekannten Sammlungdatums bekannt, die beide in der Sierra Nevada de Santa Marta gefunden worden waren. 2011 konnte die Art dann erstmals bei einer Begegnung mit einem lebenden Exemplar in der Wildbahn (einem Jungtier im kolumbianischen El Dorado Nature Reserve) beobachtet und fotografiert werden, womit die Art erstmals seit 113 Jahren wieder bestätigt nachgewiesen worden war.[400] Die Art wird als „vom Aussterben bedroht“ eingestuft (IUCN, 2017).[357]
- Neuguinea-Langohr (Pharotis imogene): Diese auf Papua-Neuguinea heimische Fledermausart aus der Familie der Glattnasen wurde seit ihrer ersten Entdeckung im Jahr 1890 nicht mehr nachgewiesen, bis ihr Überleben im Jahr 2012 nachgewiesen wurde, indem ein einzelnes Exemplar gesammelt wurde. Die Art wird als „vom Aussterben bedroht“ eingestuft (IUCN, 2021).[401]
- Machu-Picchu-Inkaratte (Cuscomys oblativa): Diese Art aus der Familie der Chinchillaratten wurde 1912 von Hiram Bingham in Machu Picchu (Peru) entdeckt,[402] 1916 auf Grundlage von zwei in einer Inka-Grabstätte entdeckten und auf ein Alter von 400 Jahren geschätzten Schädeln beschrieben,[403][402] war nur von diesem Material bekannt und wurde 2008 von der IUCN als „ausgestorben“ aufgeführt.[403] 2009 soll sie von einem Park-Ranger in der Nähe der archäologischen Fundstätte wiederentdeckt worden sein.[403][404][405][404] Erst Jahre später gelang es schließlich Biologen um Horacio Zeballos (Museum Arequipa), die 2012 mit der Feldforschung begannen, die Art in der Nähe der ebenfalls am Inka-Pfad gelegenen archäologischen Fundstätte Wiñay Wayna aufzuspüren und zu identifizieren.[404][405] 2014 wurde drei Kilometer von Machu Picchu entfernt ein lebendes Exemplar fotografiert.[403] 2016 gab die IUCN für eine Einstufung in eine Gefährdungskategorie „ungenügende Datengrundlage“ an (IUCN, 2016).[403] – Der Fall wurde von Loxdale und anderen (2016) als Säugetier-Beispiel für die Kategorie Unknown Knowns genannt. Bei dieser Kategorie handelt es sich um eine Erweiterung (vierte Kategorie) der ursprünglich dreiteiligen Matrix von Wissensstand und Datenlage (Einteilung in Known Knowns, Known Unknowns und Unknown Unknowns), die Donald Rumsfeld in einer politisch-militärischen Stellungnahme im Jahr 2002[406][407] vorgestellt hat, mit der er sich verdeckt auf den Mangel an Beweisen für den Versuch bezogen hat, die irakische Regierung mit der Lieferung von Massenvernichtungswaffen an terroristische Gruppen in Verbindung zu bringen.[407] Loxdale und andere (2016) sahen diese Matrix als nützliche Einteilung für die biologischen und ökologischen Wissenschaften und für den Naturschutz an und wiesen der Kategorie Unknown Knowns die für Biologie und Ökologie wohl relevanteste Stellung zu. Wie in der Kategorie Unknown Unknowns liegt in dieser vierten Kategorie eine schwache Datengrundlage vor. Doch unterscheidet sich die Kategorie Unknown Knowns von der Kategorie Unknown Unknowns darin, dass die Art nicht schlichtweg unentdeckt und unbekannt ist, sondern unbewiesene Hypothesen vorliegen, die sich auf Daten ähnlicher Systeme oder Arten gründen, der Wissensstand also trotz geringer Datenlage fortgeschrittener ist.[407] Medienberichte stellten die Art im Jahr 2014 zudem mit Berufung auf eine Pressemitteilung des Teams um Zeballos als typisches Beispiel für den Lazarus-Effekt (im Sinne einer vermeintlich ausgestorbenen und dann unerwartet lebend wiederentdeckten Art) vor.[404][405]
- Vietnam-Kantschil (Tragulus versicolor): Die auf Basis von vier, bei Nha Trang (Vietnam) gefundenen Exemplaren erstbeschriebene Art aus der Familie der Hirschferkel wurde zweimal wiederentdeckt: 1990 wurde das erste Mal seit der Erstbeschreibung ein überprüfter Nachweis durch ein von Jägern getötetes Exemplar erbracht. 2019 erfolgte nach fast 30 Jahren der nächste Nachweis durch Kamerafallen.[408] Für eine Einstufung in eine Gefährdungskategorie gibt die IUCN seit 2008 „ungenügende Datengrundlage“ an (IUCN, 2015).[409]
- Zypern-Stachelmaus (Acomys nesiotes): Für eine Einstufung dieser auf Zypern endemischen Art in eine Gefährdungskategorie gibt die IUCN seit 2008 „ungenügende Datengrundlage“ an (IUCN, 2019). 2007 wurden vier Exemplare bei Levkosia entdeckt.[268] Ab 1980 galt die Art zuvor als verschollen.[235]
- Flachkopf-Mausohr (Myotis planiceps): Diese in Mexiko vorkommende Fledermausart aus der Familie Glattnasen wurde 1996 von der IUCN als ausgestorben eingestuft, 2004 aber an drei Standorten wiederentdeckt. Sie wird als „vom Aussterben bedroht“ eingestuft (IUCN, 2016).[319]
- Kubanischer Schlitzrüssler (Solenodon cubanus, Syn.: Atopolage cubana): Diese für Ostkuba endemische Art wird von Einheimischen als Fleischlieferant gejagt.[410] Insbesondere wird sie – wie der nur noch inselartig auf Hispaniola (Dominikanische Republik) lebende Dominikanische Schlitzrüssler als zweite rezente Art der Familie Schlitzrüssler – durch anthropogen auf dem karibischen Archipel eingeschleppte Tiere (wie verwilderte Hunde, Hauskatzen, Bisamratten und Mungos) im Bestand bedroht.[410][411] Zwischen 1890 und 1974 sollen keine Exemplare der 1861 erstentdeckten Art gefunden worden sein.[246] Um 1970 wurde die Art von einigen für ausgestorben erachtet,[360] wurde später aber im schwer zugänglichen Gebirgszug Sierra Maestra wiederentdeckt.[410] 2012 und 2013 wurden sieben Exemplare im Gebiet des El-Toldo-Plateaus im Alexander-von-Humboldt-Nationalpark gefangen.[360] Die Art wird seit 1982 als „stark gefährdet“ eingestuft (IUCN, 2018).[360] – Der Kubanische Schlitzrüssler ist eine evolutionär uralte Species, zugleich aber einer der seltensten Inselendemiten unter den Insektenfressern, einer besonders ursprünglichen Säugetierordnung, aus der sich viele andere Säugetierordnungen (so auch die Primaten) entwickelt haben. Inselbewohnende Vertreter der Insektenfresser, die nie in hoher Abundanz vorkamen, gehören allgemein zu den am stärksten bedrohten Insektenfresser-Taxa.[410]
- De Wintons Goldmull (Cryptochloris wintoni): Das Verbreitungsgebiet dieser bislang kaum erforschten Art aus der Familie der Goldmulle (Chrysochloridae) liegt im westlichen Südafrika (Provinz Nordkap).[412] Die Art wurde nur mit drei Exemplaren – zuletzt 1936 in Südafrika – wissenschaftlich dokumentiert[413] und von der IUCN seit 2006 als „vom Aussterben bedroht“ und seit 2015 zusätzlich mit der Kennzeichnung „möglicherweise ausgestorben“ eingestuft.[412][414] Ende 2023 wurde die Art jedoch nach über 80 Jahren wiederentdeckt.[414][413] – Die Wiederentdeckung der Art wurde als Marker für einen bedeutenden Erfolg in der weltweiten Suche nach verloren geglaubten Arten gewertet, die seit 2017 von der Naturschutzorganisation Re:wild in Zusammenarbeit mit verschiedenen Partnern durchgeführt wird und auch zur Wiederentdeckung anderer Arten wie dem Attenborough-Langschnabeligel, der Pernambuco-Stechpalme und der Wallace-Riesenbiene geführt hatte[413][82] und bei der der De Wintons Goldmull die elfte wiedergefundene Art auf der Liste der „25 meistgesuchte verlorenen Arten“ von re:wild darstellte.[415] Die Wiederentdeckung des De-Wintons-Goldmulls gelang aufgrund gemeinsamer Anstrengungen von Naturschützern und Genetikern des Endangered Wildlife Trust (EWT) und der Universität Pretoria.[413] Die Wiederentdeckung der aufgrund ihres weitgehend unzugänglichen Lebensraums und ihrer im Sand verdeckten Lebensweise schwer nachzuweisenden Art stand vor der besonderen Schwierigkeit, ohne historische Proben, Diffentialdiagnosen zu den anderen naheverwandten Arten und DNA-Nachweise auskommen zu müssen.[416][417] Für die Wiederentdeckung kamen unter anderem Umwelt-DNA (eDNA) und auf die Erkennung der Gerüche anderer, häufiger vorkommender Arten von Goldmullen trainierte Spürhunde zum Einsatz.[416][418][419][415]
- Omilteme-Baumwollschwanzkaninchen (Sylvilagus insonus): die 1904 erstmals dokumentierte,[420] überwiegend nachtaktiv lebende,[420] auf die im Süden Mexikos gelegene Sierra Madre del Sur als Lebensraum begrenzte[420] und dort vor allem die dichten Nadelwälder und Kiefern-Eichen-Wäldern in Höhenlagen zwischen etwa 2.100 und 3.050 Metern bewohnende Art[420] gehört zu den vermutlich gefährdetsten Arten aus der Ordnung der Hasenartigen.[421] Die Art war in der Wissenschaft mit Stand von 2018 nur mit fünf Exemplaren dokumentiert[421] und seit den frühen 1900er-Jahren in der Wildbahn nicht mehr dokumentiert worden[420][422] wurde von der IUCN bereits 1990 als „ausgestorben“ (Ex), dann aber 1994 als „stark gefährdet“ (E), 1996 als „vom Aussterben bedroht“ (CR), 2008 als „stark gefährdet“ (EN) und 2018 als „unzureichende Datenlage“ (DD) kategorisiert, von einigen Quellen aber als „möglicherweise ausgestorben“ erachtet.[421] Im Zuge einer 2019 begonnenen, fünfjährigen gezielten Suche wurde die Art jedoch nach etwa 120 Jahren erstmals wieder dokumentiert[420] und Kameraaufnahmen der Tiersichtung im Wald der Sierra Madre del Sur wurden veröffentlicht.[423] – Die Wiederentdeckung erfolgte als dreizehnte Art, die im Rahmen der Liste der „25 meistgesuchte verlorenen Arten“ von re:wild wiederentdeckt werden konnte.[424] Bei der Wiederentdeckung spielten Gespräche mit Dorfbewohnern und berichtete Sichtungen von örtlichen Jägern eine bedeutende Rolle.[420] Ein 1998 von lokalen Jägern erhaltenes Fell[420][421] sowie einige gefangene Tiere dienten als konkrete Belege dafür, dass die Art überlebt hatte.[420]
- Waldbison (Bison bison athabascae): Diese 1897 erstmals als eigenständige Subspecies beschriebene,[427] einst besonders im Norden Albertas und im südlichen Mackenzie-Distrikt der Nordwest-Territorien mit (für Anfang des 19. Jahrhunderts) geschätzt rund 170.000 Tieren (für das ursprüngliche Verbreitungsgebiet nördlich des Athabasca River)[428][429][430][431][432] oder mehr[433] zahlreich vertretene[434] Unterart des Amerikanischen Bisons wurde – wie die bekanntere Unterart Präriebison – durch übermäßige Jagd durch weiße Siedler[A 1] im Bestand gefährdet.[435] Ende des 19. Jahrhunderts erließen die kanadische Behörden ein Jagdverbot[436][437] und schließlich schützten sie die einzige bekannte verbliebene Wildpopulation im und um den Wood-Buffalo-Nationalpark (WBNP; im Norden der Provinz Alberta und in den Nordwest-Territorien gelegen[435] und von der Fläche größer als die Schweiz[437]) geschützt[435] (dieses Gebiet, in dem die meisten Waldbisons lebten, erhielt 1922 den Status eines Nationalparks,[427][428][430] um das Habitat und die letzten verbliebenen Waldbisonbestände zu schützen und so das Aussterben des Waldbisons zu verhindern[435][428][430][436][437]). Die genetische Integrität und Gesundheit dieses Bestandes, der im späten 19. Jahrhundert fast ausgerottet worden war,[438][439][436] zu diesem Zeitpunkt einen „Flaschenhals“ (Populationsengpass) von möglicherweise rund 300 bis 500 Individuen durchlaufen hatte[426][428][431][440] und in den frühen 1920er Jahren auf rund 1500 Tiere angestiegen war,[426][435][432] wurde jedoch durch Kreuzung mit der Unterart Präriebison (Bison bison bison) beeinträchtigt,[435] der zwischen 1925 und 1928 mit fast 7000 Tieren von Wildtiermanagern aus amerikanischen Reservaten in den WBNP eingeführt worden war.[435][426][427][429][432][437] Diese Präriebisons waren Träger von zwei Hausrindkrankheiten, der Rindertuberkulose (Erreger: Mycobacterium bovis) und der Rinderbrucellose (Erreger: Brucella abortus),[426][429] sie vermischten und kreuzten sich mit den orstänsässigen Waldbisons (1934: zusammen geschätzt mindestens 12.000 Bisons im WBNP[429][428]) und übertrugen diese Krankheiten offenbar auf die Waldbisons des WBNP,[426][429] so dass viele der wild lebenden Waldbisons diesen ursprünglich über die Hausrinder eingeschleppten Krankheiten ausgesetzt waren.[435] Schließlich war der Waldbison in der Natur in der zweiten Hälfte des 20. Jahrhunderts durch die Hybridisierung mit dem eingekreuzten Präriebison,[434][441] durch Krankheiten (vor allem Rindertuberkulose)[441] und durch verschiedene Klimafaktoren[434] fast ausgestorben[441] und diese größte Säugetierart Nordamerikas wurde auch für bereits ausgestorben gehalten.[434][442][443][437] Angaben zufolge soll der Waldbison um 1940 für ausgestorben erklärt worden sein,[444][445] aufgrund der Vermischung und weitgehenden Hybridisierung mit dem Präriebison.[445][432] Der Waldbison wurde für ausgerottet gehalten,[436][437] bis im Jahr 1957[426][427][443][446][432][436][437] 1959[429] oder 1960[441][435][447] wurde dann aber in Kanada in einem unzugänglichen und abgelegenen Bereich (am Nyarling River[426][447]) des WBNP eine kleine, bis dahin unbekannte, offenbar der Hybridisierung entgangene und somit letzte offenbar weitgehend sortenreine Herde entdeckt.[441][435][426][427] die durch Sümpfe von den anderen Tieren abgetrennt war.[437] Tiere diese Herde wurden isoliert und in ihr historisches Verbreitungsgebiet überführt, wo sie unter Schutz gestellt wurden (Bestand 1970: rund 75 Tiere[434]) und als Grundlage für eine Rettungszucht dienten.[427] Einige dieser sortenreinen Waldbisons wurden zur Gründung eines weiteren isolierten Bestandes nordwestlich des Großen Sklavensees (in den Nordwest-Territorien) verwendet[435] (nach Krankheitstests waren 1963 16 Waldbisons in das neu errichtete Mackenzie Bison Sanctuary in den Nordwest-Territorien und 1965 etwa 22 weitere Waldbisons in den Elk-Island-Nationalpark in Alberta überführt,[447][429] wobei die Gründertiere im Elk-Island-Nationalpark allerdings unentdeckt Träger von Tuberkulose waren, also bereits zuvor in dichten Kontakt mit Präriebisons gekommen sein mussten, so dass die adulten Tiere gekeult wurden[429] und nur 11 unerkrankte Kälber verblieben und nach Handaufzucht die Gründerherde bildeten[429][447]). Zur Jahrtausendwende lebte ein Bestand von 1800 Tieren in diesem zweiten Schutzgebiet am Großen Sklavensee.[441] Waldbisons aus dem Elk-Island-Nationalpark wurden für die Etablierung neuer Wildbestände in ihrem historischen Verbreitungsgebiet in Kanada, Alaska und bis nach Sibirien verwendet.[432] 2012 wurde der Gefährdungsstatus des Waldbison von „endangered“ auf „threatened“ herabgestuft.[443] – Die langfristige Überlebensfähigkeit der Population der Waldbisons kann weiterhin als ungesichert gelten.[435] 1989 machten kanadische Behörden den hochumstrittenen Vorschlag, fast alle Bisons in der Umgebung des WBNP – mit Ausnahme der sortenreinen Waldbisons – auszumerzen und diese als „wertlose Hybride“ (Bison bison bison x athabascae) und als Träger von Rindertuberkulose und Brucellose mit von diesen Krankheiten nicht befallenen, sortenreinen Waldbisons zu ersetzen,[426] um so erstens die Ausbreitung von Brucellose und Tuberkulose von Bisons auf die sich in Alberta nach Norden ausbreitenden Hausrindherden zu verhindern und zweitens die genetische Integrität der Waldbison-Unterart zu bewahren.[435]
Reptilien
Schildkröten
- Yunnan-Scharnierschildkröte (Cuora yunnanensis): diese Art galt seit mehr als 100 Jahren als ausgestorben, als sie 2004 lebend auf einem Markt in Kunming für die Wissenschaft unter großer medialer Resonanz wiederentdeckt.[45] Seit dem Jahr 1946 konnten trotz anderthalb Jahrzehnte langer Nachsuche lediglich 3 Individuen (sämtlich seit 2004 gefunden) der Art bestätigt werden (Stand: 1007). Es wird daher davon ausgegangen, dass nur extrem wenig Individuen überlebt haben können und alle verbliebenen Populationen äußerst klein und örtlich begrenzt sind.[448] Aufgrund der sehr hohen Preisgebote von Sammlern im illegalen Heimtierhandel sowie im Konsum sind möglicherweise überlebende Tiere in besonderem Maße vom Sammlern bedroht.[448][45] Die Art ist daher als „vom Aussterben bedroht“ (IUCN, 2010) eingestuft.[448] Die Validität der drei entdeckten Tiere 2007 wurde durch DNA-Analyse bestätigt.
- Fernandina-Riesenschildkröte (Chelonoidis phantasticus). Nach dem Fund des einzelnen männlichen Exemplars dieser auf Fernandina endemischen Art im Jahr 1906, das als Holotyp für die Erstbeschreibung im Jahr 1907 diente, erfolgte zunächst kein Fund mehr auf der schwer zugänglichen Galapagosinsel. Nach Anzeichen für die Existenz von Schildkröten auf der Insel im Jahr 1964 (wie Kot- und Fraßspuren) sowie nach späteren Indizien ihrer Existenz konnte die Art indirekt als seit 1964 „zuletzt gesehen“ betrachtet werden.[451] In verschiedenen, zwischen 1996 und 2015 veröffentlichten wissenschaftlichen Publikationen wurde die Art als „ausgestorben“ oder „möglicherweise ausgestorben“ aufgeführt,[451] doch konnte das Überleben der Art, für die keine umfassenden Untersuchungen auf dem außerordentlich schwierigen und weitläufigen Gelände der Insel durchgeführt worden waren und deren Vertreter wie für Galapagos-Riesenschildkröten üblich eine individuelle Lebenserwartung von mindestens 100 Jahren besitzen, nicht ausgeschlossen werden, und die Art wurde 2017 offiziell als „vom Aussterben bedroht (möglicherweise ausgestorben)“ eingestuft (IUCN, 2017).[451] Offenbar litten ihre Bestände unter den häufigen vulkanischen Lavaströmen auf der Insel,[451] bei der es sich um einen aktiven Schildvulkan handelt.[452] Im Februar 2019 wurde dann ein einzelnes Weibchen auf Fernandina aufgefunden,[452] dessen Genanalysen der Yale-Universität ergaben, dass es sich um eine Fernandina-Riesenschildkröte handelt, und die Art wurde somit wiederentdeckt.[449][58]
Schuppenechsen
- La-Palma-Rieseneidechse (Gallotia auaritae): Die La-Palma-Rieseneidechse, ein Endemit auf La Palma,[383] war bereits seit Jahrhunderten nicht mehr auf der Inselgruppe gesichtet worden und wurde daher für seit dieser Zeit ausgestorben erachtet, als sie schließlich doch 2007 fotografiert werden konnte.[34][383] – Die Art ist ein Beispiel für das im Vergleich zu anderen landbewohnenden Taxa oftmals eher verbogene und schwer nachzuweisende Vorkommen von Lazarus-Arten unter den Reptilien und Amphibien.[34] Da ihre Bestände sehr geringe Individuenzahlen aufweisen, wurde sie jedoch nach ihrer Wiederentdeckung als „vom Aussterben bedroht (möglicherweise ausgestorben)“ eingestuft (IUCN, 2009).[453]
- El-Hierro-Rieseneidechse (Gallotia simonyi): Nachdem die Art zuerst auf der Insel El Hierro und um 1950 auch in ihrem kleinen Refugialraum, auf dem El Hierro im Westen vorgelagerten Salmor-Felsen (Roque Chico de Salmor), nicht mehr nachgewiesen wurde, wurde sie 1971 und 1976 für ausgestorben erklärt, wurde dann aber zeitnah in privatem Betreiben durch den Fund eines Kadavers aus Skelettresten und Hautfetzen wiederentdeckt und dann durch einen Lebendfang eines Pärchens auf El Hierro bestätigt. Der Lebendfang wurde zwar konfisziert, war aber fotografisch belegt, und die Art fand Aufnahme in die Naturschutzgesetzgebung Spaniens. Außer auf El Hierro existieren von dieser Art auch auf La Gomera, Teneriffa und La Palma subfossile und teilweise auch historische Knochenbelege. Für subfossile Skelettreste von La Gomera wurde 1985 die Unterart G. simonyi gomerana aufgestellt.[45] Die Art wird seit 1996 als „vom Aussterben bedroht“ eingestuft (IUCN, 2009).[454]
- Jamaika-Leguan (Cyclura collei): die über einen Meter lange Wirtelschwanzleguanart ist endemisch auf der Insel Jamaika[45] und kam einst an der südöstlichen Küste Jamaikas verbreitet in ihrem Habitat vor.[455] Ihre Bestände gingen seit Ende des 19. Jahrhunderts deutlich zurück.[455] Sie wurden durch verschiedene Neozoen dezimiert, bei denen es sich um anthropogen eingeführte Fressfeinde aus der Säugetierordnung der Raubtiere wie Mangusten, Hauskatzen und Haushund handelt, aber auch um eigelegeplündernde Ratten.[45][456] Seit Mitte der 1940er Jahre galten auch die letzten bekannten Jamaika-Leguan-Bestände (auf der Großen Ziegeninsel befindlich, einer kleinen Nebeninsel Jamaikas) als ausgestorben.[45][455] In den 1970er Jahren konnte jedoch ein lebendes Exemplar in den Hellshire Hills auf der Hauptinsel, an der Südküste Jamaikas, bestätigt werden[45][455] und 1990 eine Restpopulation von weniger als 50, hauptsächlich älteren adulten Individuen, entdeckt werden,[455] nachdem der Hund eines örtlichen Jägers ein lebendes Exemplar der Art in einer Gegend bei Kingston erbeutet hatte, wo seit 1940 keine Leguane mehr gesichtet worden waren.[456] 1994 konnten die ersten Exemplare der Art in US-amerikanische Zoos überführt und bis 1997 von Experten über 100 Tiere nachgezüchtet werden, die teilweise in einem speziellen Schutzgebiet ausgesetzt wurden.[456] Die Art bleibt dennoch seit 1996 als „vom Aussterben bedroht“ (IUCN, 2021) eingestuft.[455] – Dieser Fall eines von Neozoen bis an den Rand des Aussterbens dezimierten Inselendemiten gilt als ein Paradebeispiel für ein erfolgreich durchgeführtes Erhaltungszuchtprogramm.[45] 2021 gab die IUCN den Bestand wieder mit dank intensiver Schutzbemühungen auf 500 bis 600 geschätzte adulte Individuen angewachsen an.[455]
- Contomastix vittata (Departamento Chuquisaca, Cochabamba, Santa Cruz, Potosí (Bolivien); wurde vor über einem Jahrhundert zuletzt gesichtet, bis es in den frühen 2010er-Jahren wenige Exemplare in Gegenden wiederentdeckt wurde, die auf eine abnehmende Population schließen lassen)[457]
- Pinocchioechse (Anolis proboscis): Die Art galt 50 Jahre lang als ausgestorben, bis sie 2005 wiederentdeckt wurde. Sie wird als „stark gefährdet“ eingestuft (IUCN, 2019).[458]
Amphibien
| Wissenschaftlicher Name | Trivialname des Taxons | Jahr der letzten Sichtung | Jahr der Wiederentdeckung | Jahre verschollen | IUCN-Status | Typ der Wiederentdeckung *) |
|---|---|---|---|---|---|---|
| Adenomus kandianus | 1872 | 2009 | 137 | EN[459] | „Holotyp“ | |
| Allobates humilis | Sapito Niñera Humilde[460] | 1980 | 2002 | 22 | EN[460] | „Holotyp“ |
| Alsodes montanus | Mountain Spiny-chest Frog[461] | 1902 | 1964 | 62 | VU[461] | „Holotyp“ |
| Ameerega boliviana | Bolivian Poison-Arrow Frog[462] | 1902 | 1998 | 96 | NT[462] | „Holotyp“ |
| Ameerega planipaleae | 1996 | 2007 | 11 | CR[463] | „Holotyp“ | |
| Anaxyrus baxteri | Wyoming Toad[464] | 1980 | 1987 | 7 | EW[464] | „ausgestorben“ |
| Ghatophryne ornata (Syn. Ansonia ornata)[465] | Malabar Torrent Toad[465] | 1890 | 1990 | 100 | VU[465] | „Holotyp“ |
| Atelopus bomolochos | 1991 | 2002 | 11 | CR[466] | „ausgestorben“ | |
| Atelopus carrikeri | Guajira Stubfoot Toad[467] | 1994 | 2008 | 14 | EN[467] | „ausgestorben“ |
| Atelopus cruciger | Veragua Stubfoot Toad[468] | 1982 | 2003 | 21 | CR[468] | „ausgestorben“ |
| Atelopus ebenoides | Huila Stubfoot Toad[469] | 1995 | 2006 | 11 | CR(PE)[469] | „ausgestorben“ |
| Atelopus eusebianus | Malvasa Stubfoot Toad[470] | 1991 | 2004 | 13 | CR(PE)[470] | „ausgestorben“ |
| Atelopus laetissimus | 1992 | 2006 | 14 | EN[471] | „ausgestorben“ | |
| Atelopus mucubajiensis | 1994 | 2004 | 10 | CR[472] | „ausgestorben“ | |
| Atelopus nahumae | 1992 | 2006 | 14 | EN[473] | „ausgestorben“ | |
| Atelopus palmatus | Anderssons Stummelfußkröte[474] | 1937 | 2008 | 71 | CR[475] | „ausgestorben“ |
| Atelopus seminiferus | Upper Amazon Stubfoot Toad[476] | 1874 | 2001 | 127 | EN[476] | „Holotyp“ |
| Atelopus varius | Variable Harlequin Frog[477] | 1996 | 2003 | 7 | CR[477] | „Holotyp“ |
| Austrochaperina brevipes | Victoria Land Frog[478] | 1896 | 1986 | 90 | DD[478] | „Holotyp“ |
| Austrochaperina yelaensis | 1960 | 2004 | 44 | LC[479] | „Holotyp“ | |
| Barbourula busuangensis | Busuanga Jungle Toad[480] | 1923 | 1940 | 17 | NT[480] | „Zeit“ |
| Barbourula kalimantanensis | 1995 | 2007 | 12 | EN[481] | „Zeit“ | |
| Bolitoglossa capitana | Orphan Salamander[482] | 1971 | 2005 | 34 | CR[482] | „Holotyp“ |
| Boophis williamsi | Williams’ Bright-eyed Frog[483] | 1979 | 2001 | 22 | CR[483] | „ausgestorben“ |
| Bradytriton silus | Finca Chiblac Salamander[484] | 1976 | 2009 | 33 | EN[484] | „ausgestorben“ |
| Duttaphrynus sumatranus (Syn. Bufo sumatranus)[485] | Kodok-buduk sumatra[485] | 1860 | 2001 | 141 | DD[485] | „Holotyp“ |
| Glyphoglossus volzi (Syn. Calluella volzi)[486] | 1905 | 1999 | 94 | LC[486] | „ausgestorben“ | |
| Arthroleptis aureoli (Syn. Cardioglossa aureoli)[487] | Freetown Long-fingered Frog[487] | 1963 | 2003 | 40 | NT[487] | „Holotyp“ |
| Chirixalus simus (Syn. Chiromantis simus)[488] | Assam Asian Treefrog[488] | 1911 | 1999 | 88 | LC[488] | „ausgestorben“ |
| Chiropterotriton magnipes | Bigfoot Splayfoot Salamander[489] | N/A | 2005 | N/A | EN[489] | „ausgestorben“ |
| Conraua derooi | Togo Slippery Frog[490] | 1980 | 2005 | 25 | CR[490] | „Holotyp“ |
| Craugastor gulosus | 1875 | 1976 | 101 | CR[491] | „ausgestorben“ | |
| Craugastor milesi | Miles’ Robber Frog[492] | 1992 | 2009 | 17 | CR[492] | „Holotyp“ |
| Dendropsophus ruschii | Rusch's Treefrog[493] | 1987 | 2005 | 18 | LC[493] | „Holotyp“ |
| Dendrotriton cuchumatanus | Forest Bromeliad Salamander[494] | 1975 | 2005 | 30 | CR[494] | „Holotyp“ |
| Eleutherodactylus cubanus | Turquino Red-armed Frog[495] | 1936 | 1994 | 58 | EN[495] | „Holotyp“ |
| Eleutherodactylus turquinensis | Turquino Streamfrog[496] | 1936 | 1994 | 58 | CR[496] | „Holotyp“ |
| Excidobates captivus | Rio Santiago Poison Frog[497] | 1929 | 2006 | 77 | VU[497] | „Holotyp“ |
| Excidobates mysteriosus | 1929 | 1982 | 53 | EN[498] | „Holotyp“ | |
| Gastrotheca splendens | Schmidt’s Marsupial Frog[499] | 1857 | 1997 | 140 | DD[499] | „Holotyp“ |
| Gegeneophis seshachari | Seshachari's Caecilian[500] | 1967 | 2003 | 36 | LC[500] | „Zeit“ |
| Holoaden luederwaldti | Luderwaldt's Highland Frog[501] | 1967 | 2005 | 38 | NT[501] | „Holotyp“ |
| Hyalinobatrachium talamancae | Talamanca Glass Frog[502] | 1952 | 2001 | 49 | LC[502] | „Holotyp“ |
| Sanguirana igorota (Syn. Hylarana igorota)[503] | 1920 | 2001 | 81 | VU[503] | „Holotyp“ | |
| Hyloscirtus charazani | 1970 | 1997 | 27 | CR[504] | „Holotyp“ | |
| Stereocyclops histrio (Syn. Hyophryne histrio)[505] | Bahia Yellow Frog[505] | 1954 | 2000 | 46 | LC[505] | „Holotyp“ |
| Boana melanopleura (Syn. Hypsiboas melanopleura)[506] | 1912 | 2004 | 92 | LC[506] | „Holotyp“ | |
| Ichthyophis hypocyaneus | Javan Caecilian[507] | 1827 | 2000 | 173 | LC[507] | „ausgestorben“ |
| Incilius cristatus | Large-crested Toad[508] | N/A | 1998 | N/A | EN[508] | „ausgestorben“ |
| Isthmohyla rivularis | American Cinchona Plantation Treefrog[509] | 1988 | 2007 | 19 | EN[509] | „Holotyp“ |
| Leptobrachella lateralis (Syn. Ixalus lateralis)[510] | Nagaland Asian Toad[510] | 1871 | 2008 | 137 | CR[510] | „ausgestorben“ |
| Kurixalus naso | Uphill Tree Frog[511] | 1912 | 2000 | 88 | LC[511] | „ausgestorben“ |
| Lechriodus papuanus | 1927 | 1956 | 29 | N/A | „ausgestorben“ | |
| Lithobates onca | Relict Leopard Frog[512] | 1950 | 1995 | 45 | EN[512] | „ausgestorben“ |
| Lithobates sevosus | Dusky Gopher Frog[513] | N/A | 1987 | N/A | CR[513] | „ausgestorben“ |
| Lithobates vibicarius | Rancho Redondo Frog[514] | 1990 | 2002 | 12 | EN[514] | „Holotyp“ |
| Litoria aurea | Gold-Laubfrosch | 1981 | 1999 | 18 | NT[515] | „Zeit“ |
| Litoria castanea | Yellow-spotted Tree Frog[516] | 1975 | 2010 | 35 | CR(PE)[516] | „ausgestorben“ |
| Litoria dorsalis | Dwarf Rocket Frog[517] | 1877 | 1956 | 79 | LC[517] | „ausgestorben“ |
| Litoria leucova | West Sepik Treefrog[518] | N/A | 1993 | N/A | LC[518] | „Holotyp“ |
| Litoria lorica | Armoured Frog[519] | 1991 | 2008 | 17 | CR[519] | „Holotyp“ |
| Liuixalus romeri | Romer’s Treefrog[520] | 1953 | 1984 | 31 | EN[520] | „Holotyp“ |
| Mantella manery | 1999 | 2004 | 5 | VU[521] | „Holotyp“ | |
| Mantidactylus pauliani | Madagascar Frog[522] | 1979 | 2001 | 22 | CR[522] | „Holotyp“ |
| Melanobatrachus indicus | Orange Black Tubercled Indian Microhylid[523] | 1878 | 1997 | 119 | VU[523] | nicht eingestuft |
| Melanophryniscus macrogranulosus | Torres Redbelly Toad[524] | 1973 | 2004 | 31 | EN[524] | „ausgestorben“ |
| Melanophryniscus pachyrhynus | Orejas-Miranda Redbelly Toad[525] | 1905 | 2005 | 100 | LC[525] | „Holotyp“ |
| Micrixalus kottigeharensis | Kottigehar Bubble-nest Frog[526] | 1937 | 2001 | 64 | VU[526] | „Holotyp“ |
| Nanorana aenea (Syn. Nanorana fansipani)[527] | Doi Chang Asian Frog[527] | 1938 | 2000 | 62 | LC[527] | „Holotyp“ |
| Nimbaphrynoides occidentalis (Syn. Nimbaphrynoides liberiensis)[528] | Mount Nimba Viviparous Toad[528] | 1978 | 2010 | 32 | CR[528] | „Holotyp“ |
| Nyctixalus margaritifer | Java Indonesian Treefrog[529] | N/A | 1997 | N/A | LC[529] | „Holotyp“ |
| Oreobates granulosus | 1903 | 2008 | 105 | LC[530] | „Holotyp“ | |
| Oreobates heterodactylus | Caceres Robber Frog[531] | 1937 | 2005 | 68 | LC[531] | „Holotyp“ |
| Oreophryne insulana | Goodenough Cross Frog[532] | N/A | 1998 | N/A | LC[532] | „Zeit“ |
| Oscaecilia osae | Airstrip Caecilia[533] | 1990 | 2004 | 14 | LC[533] | „Holotyp“ |
| Paratelmatobius gaigeae | Gaige's Rapids Frog[534] | 1931 | 2003 | 72 | EN[534] | „Zeit“ |
| Paratelmatobius mantiqueira | 1953 | 2005 | 52 | CR[535] | „Holotyp“ | |
| Peltophryne lemur | Puerto Rican Crested Toad[536] | 1930 | 1966 | 36 | EN[536] | „Holotyp“ |
| Raorchestes chalazodes (Syn. Philautus chalazodes)[537] | Günther’s Bush Frog[537] | 1878 | 2003 | 125 | VU[537] | „Holotyp“ |
| Pseudophilautus stellatus (Syn. Philautus stellatus)[538] | 1853 | 2009 | 156 | CR[538] | „ausgestorben“ | |
| Raorchestes travancoricus (Syn. Philautus travancoricus)[539] | Travancore Bush Frog[539] | 1910 | 2010 | 100 | EN[539] | „Holotyp“ |
| Phrynopus peruanus | Peters’ Andes Frog[540] | 1874 | 2005 | 131 | CR[540] | „Holotyp“ |
| Phyllodytes wuchereri | 1873 | 2004 | 131 | LC[541] | „Holotyp“ | |
| Pingia granulosus | 1933 | 2009 | 76 | N/A | „Holotyp“ | |
| Platymantis cornutus | 1922 | 1998 | 76 | LC[542] | „Holotyp“ | |
| Platymantis hazelae | Hazel's Wrinkled Ground Frog[543] | 1922 | 1998 | 76 | VU[543] | „Holotyp“ |
| Plethodon neomexicanus | Jemez Mountains Salamander[544] | 1913 | 1950 | 37 | EN[544] | „Holotyp“ |
| Protohynobius puxiongensis | Puxiong Salamander[545] | 1965 | 2009 | 44 | CR[545] | „Holotyp“ |
| Ixalotriton niger (Syn. Pseudoeurycea nigra)[546] | Jumping Salamander[546] | N/A | 2000 | N/A | EN[546] | „Holotyp“ |
| Pseudoeurycea nigromaculata | Black-spotted False Brook Salamander[547] | 1985 | 2006 | 21 | EN[547] | „ausgestorben“ |
| Ixalotriton parvus (Syn. Pseudoeurycea parva)[548] | Dwarf False Brook Salamander[548] | 1985 | 2007 | 22 | CR[548] | „Zeit“ |
| Rhacophorus bifasciatus | Katak-parasut Kerinci[549] | 1926 | 2006 | 80 | LC[549] | „ausgestorben“ |
| Rhacophorus lateralis | Small Tree Frog[550] | 1883 | 2000 | 117 | VU[550] | „Holotyp“ |
| Rhacophorus poecilonotus | Sumatra Flying Frog[551] | 1920 | 2000 | 80 | LC[551] | „Holotyp“ |
| Dendrophryniscus proboscideus (Syn. Rhinella boulengeri)[552] | 1936 | 2000 | 64 | LC[552] | „Holotyp“ | |
| Rhinella leptoscelis | 1912 | 2006 | 94 | NT[553] | „Holotyp“ | |
| Sphaenorhynchus pauloalvini | Paulo's Lime Treefrog[554] | 1973 | 2007 | 34 | LC[554] | „Holotyp“ |
| Taudactylus acutirostris | Sharp Snouted Day Frog[555] | 1857 | 1996 | 139 | EX[555] | „ausgestorben“ |
| Taudactylus eungellensis | Eungella Torrent Frog[556] | 1987 | 1992 | 5 | EN[556] | „Zeit“ |
| Taudactylus rheophilus | Northern Tinker Frog[557] | 1991 | 1996 | 5 | CR(PE)[557] | „ausgestorben“ |
| Telmatobius gigas | 1966 | 1998 | 32 | EN[558] | „Holotyp“ | |
| Telmatobufo venustus | Chile mountain false toad[559] | 1899 | 1999 | 100 | EN[559] | „ausgestorben“ |
| Thorius magnipes | Big-footed Thorius[560] | 1983 | 2003 | 20 | CR[560] | „Zeit“ |
| Thorius minutissimus | Oaxacan Pigmy Salamander[561] | 1949 | 2001 | 52 | CR[561] | „ausgestorben“ |
| Quelle für Einträge in der Tabelle, sofern nicht anders angegeben: Brett R. Scheffers, Ding Li Yong, J. Berton C. Harris, Xingli Giam, Navjot S. Sodhi: The World’s Rediscovered Species: Back from the Brink? In: PLoS ONE. Band 6, Nr. 7, 2011, S. e22531, hier 5. Seite, Table 1., doi:10.1371/journal.pone.0022531 (Erste Online-Veröffentlichung am 27. Juli 2011).[235] | ||||||
1. Solche, die für ausgestorben erklärt wurden (von der Quelle der Wiederentdeckung informell für ausgestorben erklärt), aber wiederentdeckt wurden. Dieser Typ der Wiederentdeckung wird in der Tabelle als „ausgestorben“ bezeichnet.
2. Solche, die über längere Zeiträume hinweg unentdeckt geblieben sind (das heißt, eine Art bleibt unentdeckt und es liegen für eine ungewöhnliche Zeitspanne keine bestätigten Sichtungen vor). Dieser Typ der Wiederentdeckung wird in der Tabelle als „Zeit“ bezeichnet. Dabei haben sich die Autoren dafür entschieden, keinen Mindestzeitraum zu definieren, für den eine Art verschollen sein muss, um als wiederentdeckt zu gelten, sondern sie verließen sich stattdessen auf eine Expertenmeinung (das Urteil des Autors oder Wissenschaftlers), um eine Art für wiederentdeckt zu erklären. Die Autoren verwiesen in diesem Zusammenhang auf das Fehlern anerkannter Richtlinien für die Definition einer Wiederentdeckung einer Art.
3. Solche, die erste Sichtungen seit der Erfassung der Typenreihe darstellen. Dieser Typ der Wiederentdeckung wird in der Tabelle als „Holotyp“ bezeichnet und bedeutet, dass die Art vor ihrer Wiederentdeckung nur aus Typusexemplaren bekannt war (dies trifft auf 59 % der Amphibien zu).
Alle Arten von Wiederentdeckungen wurden von der Quelle der Wiederentdeckung informell gemeldet und/oder quantifiziert. Wiederentdeckungen von Typusexemplaren aus Museumssammlungen und genetische Wiederentdeckungen (manchmal auch als Neubeschreibungen) wurden nicht berücksichtigt. (Quelle: Brett R. Scheffers, Ding Li Yong, J. Berton C. Harris, Xingli Giam, Navjot S. Sodhi: The World’s Rediscovered Species: Back from the Brink? In: PLoS ONE. Band 6, Nr. 7, 2011, S. e22531, doi:10.1371/journal.pone.0022531 (Erste Online-Veröffentlichung am 27. Juli 2011).) .
Froschlurche
- Adenomus kandianus: diese auf Zentralprovinz (Sri Lanka) endemische Art war ursprünglich nur von zwei Exemplaren der Erstbeschreibung aus dem Jahr 1872 bekannt, wurde bereits 1998 für ausgestorben gehalten und wurde 2004 auch offiziell von der IUCN als „ausgestorben“ eingestuft,[562] bis im Juni 2012 publiziert wurde, dass die Art im Oktober 2009 in der Zentralprovinz von Sri Lanka nach über 130 Jahren wiederentdeckt worden war.[563][564][562] Die Art wurde daraufhin seit 2012 als „vom Aussterben bedroht“[562] und 2020 als „stark gefährdet“ eingestuft.[459]
- Craugastor escoces (auf den Vulkanen Barva, Irazú und Turrialba (Provinz Alajuela, Costa Rica)): die Art wurde zuletzt um das Jahr 1986 gesichtet und im Jahr 2004 für ausgestorben erklärt; umfangreiche Suchaktionen blieben erfolglos, bis ein Weibchen am 19. September 2016 wiederentdeckt wurde.[565][566][567] Die Art wurde daraufhin seit 2020 als „vom Aussterben bedroht“ eingestuft.[567]
- Atelopus balios (Provinz Azuay, Cañar, Guayas (Ecuador); wurde zwischen April 1995 und Oktober 2010 nicht mehr gesichtet; im Oktober 2010 fand man ein Exemplar, im März 2011 fünf Männchen und im Juni 2012 ein weiteres Männchen)[568]
- Atelopus coynei (Provinz Pichincha, Imbabura, Carchi (Ecuador); wurde im September 1984 zuletzt gesichtet und galt als ausgestorben, bis die Art am 7. Februar 2012 fotografiert werden konnte)[569][570]
- Atelopus ignescens (Provinz Imbabura, Chimborazo, Bolívar (Ecuador)): die Art wurde seit 1988 nicht mehr gesehen und 2004 von der IUCN offiziell für ausgestorben erklärt.[571] 2016 konnte jedoch eine Subpopulation innerhalb der ursprünglichen geografischen Verbreitung entdeckt werden[571][572] und die Art wurde von der IUCN als „vom Aussterben bedroht“. eingestuft (2018).[571]
- Nimba-Berg-Riedfrosch (Hyperolius nimbae) (Mount Nimba, Elfenbeinküste); diese Art aus der Familie der Riedfrösche (Hyperoliidae) galt von 1967 bis zu seiner Wiederentdeckung im Jahr 2010 als ausgestorben.[573][574][575] 2017 stufte die IUCN die Art als „stark gefährdet“ ein.[573] – Der Fall wird in der Literatur zudem als Beispiel für Arten angeführt, bei denen es durch die vorzeitige Einschätzung als ausgestorben zu verpassten Möglichkeiten bei ihrer Arterhaltung kam (vergleiche: „Romeo-Irrtum“).[575]
- Incilius holdridgei (Provinz Alajuela (Costa Rica); konnte zwischen 1987 und 2009 nicht gesichtet werden, galt seit 2004 als ausgestorben; es wird von weniger als 50 lebenden Exemplaren ausgegangen)[576][577]
- Israelischer Scheibenzüngler (Latonia nigriventer, Syn.: Discoglossus nigriventer; alternative Trivialnamen auch: Palästinensischer Scheibenzüngler, Hulesee-Scheibenzüngler, Schwarzbäuchiger Scheibenzüngler): Diese für die in Israel gelegene Chulaebene endemische Art aus der Familie der Alytidae galt seit den 1950er Jahren als durch Lebensraumzerstörung ausgestorben, bis sie Anfang 2011 in der Chulaebene wiederentdeckt wurde.[34][383][578] Allerdings wird die Art als „vom Aussterben bedroht“ eingestuft (IUCN, 2021).[579] – Die Art ist ein Beispiel für das im Vergleich zu anderen landbewohnenden Taxa oftmals eher verbogene und schwer nachzuweisende Vorkommen von Lazarus-Arten unter den Reptilien und Amphibien.[34]
- Pseudophilautus hypomelas (Syn.: Ixalus hypomelas und Philautus hypomelas): Die auf Sri Lanka lebende Art aus der Familie der Ruderfrösche wurde nach dem Jahr ihrer Erstbeschreibung, 1876, nicht mehr gesichtet, 2004 von der IUCN als „ausgestorben“ eingestuft,[580] im Jahr 2010 aber im zentralen Hochland von Sri Lanka nach über 130 Jahren wiederentdeckt[580][581][582] und 2020 von der IUCN als „stark gefährdet“ eingestuft.[580]
- Pseudophilautus stellatus (Syn.: Philautus stellatus und Polypedates stellata): Die auf Sri Lanka lebende Art aus der Familie der Ruderfrösche wurde nach dem Jahr ihrer Erstbeschreibung, 1853, nicht mehr gesichtet, 2004 von der IUCN als „ausgestorben“ eingestuft,[538] im Jahr 2013 aber nach 160 Jahren im Peak Wilderness Nature Reserve wiederentdeckt[583][584][538] und 2020 von der IUCN als „vom Aussterben bedroht“ eingestuft.[538]
Schwanzlurche

- Ambystoma leorae (México (Bundesstaat), Mexiko); dieser Breitkopfsalamander wurde im Jahr 1983 zuletzt beobachtet; seit 2017 gibt es aber wieder vermehrt Sichtungen[585][586]
- Bolitoglossa jacksoni (Departamento Huehuetenango, Guatemala); dieser Salamander aus der Familie der Lungenlosen Salamander (Plethodontidae) und Gattung der Pilzzungensalamander wurde bisher nur in einem Umkreis von einem Kilometer vom Gebiet, aus dem der Typus der Art stammt (rund 12 km nord-nordöstlich von Santa Cruz Barillas, auf dem karibischen Steilhang der Sierra de los Cuchumatanes), entdeckt.[587] Seit bei der Entdeckung der Art im Jahr 1975 zwei Exemplare erfasst wurden, wurde lange Zeit kein weiteres Exemplar entdeckt, obwohl zwischen 1984 und 2017 über 30 Exkursionen mit 3.000 Stunden Suchaufwand für die Suche nach Individuen der Art investiert wurden.[587] Erst im Oktober 2017 wurde die Art wiederentdeckt, als ein Wachmann des Amphibienreservats Finca San Isidro ein junges Exemplar, als drittes jemals dokumentierte Individuum der Art, am Rande des Reservats entdeckte.[587][588] Zu diesem Zeitpunkt war schon befürchtet worden, die Art könne seit über 40 Jahren ausgestorben sein.[589] Die IUCN stufte die Art (2020) als „vom Aussterben bedroht“ ein.[587] – Es handelt sich bei diesem Fall um die erste Art auf der Liste der „25 Most Wanted Lost Species“ der Organisation Global Wildlife Conservation (oder: re:wild), die wiederentdeckt wurde.[590][588][591] Das Amphibienreservat San Isidro Amphibian Reserve (auch: Yal Unin Yul Witz Reserve[588]), in dem die Wiederentdeckung 2017 erfolgte, war erst zwei Jahre zuvor von einem Konsortium internationaler Gruppen gegründet worden, teilweise um zum Schutz der beiden 2014 dort wiederentdeckten Salamanderarten Bradytriton silus und Nyctanolis pernix beizutragen.[590][592] Vor der Wiederentdeckung von Bolitoglossa jacksoni im Jahr 2017 waren die Parkwächter zur Identifizierung der gesuchten Art ausgebildet worden.[590][589][591] Nach der Wiederentdeckung der Art nahe der Reservatsgrenze wurden Pläne unterstützt, das Reservat zu erweitern.[590]
- Chiropterotriton mosaueri (Hidalgo, Mexiko); diese Art aus der Familie der Lungenlosen Salamander (Plethodontidae), Unterfamilie Hemidactyliinae, Gattung Schwielensalamander (Chiropterotriton) galt 69 Jahre lang als verschollen, bis sie im Jahr 2010 wiederentdeckt wurde.[574][593][575] Die IUCN stufte die Art 2016 als „vom Aussterben bedroht“ ein.[593] – Der Fall wird in der Literatur zudem als Beispiel für Arten angeführt, bei denen es durch die vorzeitige Einschätzung als ausgestorben zu verpassten Möglichkeiten bei ihrer Arterhaltung kam (vergleiche: „Romeo-Irrtum“).[575]
Schleichenlurche
- Ichthyophis hypocyaneus: Diese Art aus der Ordnung der Schleichenlurche gehört zur Familie der Fischwühlen und war lange Zeit nur vom Typusexemplar aus Banten (Provinz West-Java) bekannt, bis sie im Jahr 2000 in der Provinz Zentral-Java wiederentdeckt und in der Folge auch an wenigen anderen Standorten auf Java gefunden wurde.[507] Scheffers und Andere (2011) gaben in ihrer Literaturauswertung an, dass die Art 173 Jahre lang verschollen gewesen sei und stuften sie als für „ausgestorben“ gehalten ein.[235] Die IUCN wiesen der Art 2004 die Kategorie „unzureichende Datengrundlage“ zu und stuften die Art 2018 als „nicht gefährdet“ ein.[507]
Rundmäuler
- Eine nur in Oregon heimische Neunaugen-Art (Entosphenus minimus, Syn.: Lampetra minima), (Miller Lake, Oregon, USA), wurde seit 1958 für ausgestorben gehalten, jedoch in den späten 1990er Jahren wiederentdeckt.[594][595]
„Fische“
Eine andere, zwischenzeitlich für ausgestorben gehaltene, Unterart (C. n. shoshone) hat einen genetischen Flaschenhals überlebt und wurde wiederentdeckt (Lazarus-Effekt[596]), ist aber genetisch verarmt.[597]
- Owens Wüstenkärpfling (Cyprinodon radiosus): die Art wurde 1961 von verschiedenen Wissenschaftlern als ausgestorben betrachtet, 1964 jedoch an einer abgelegenen Stelle von Fish Slough (Kalifornien) wiederentdeckt.[597] 2013 wurde die Art von der IUCN als „stark gefährdet“ aufgeführt.[598]
- C. nevadensis shoshone: für diese Unterart des Nevada-Wüstenkärpflings hatten zahlreiche Untersuchungen keine Population mehr auffinden können, sie wurde jedoch 1986 wiederentdeckt. Der Bestand war allerdings zwischenzeitlich so stark reduziert worden, dass die überlebenden Individuen Nachfahren einer Population sind, die einen genetischen Flaschenhals durchlebt hat. Diese Unterart ist somit ein Beispiel von gefährdeten Taxa, bei denen zwar eine Restpopulation überlebt hat, die aber bereits einen Großteil ihrer ursprünglichen genetischen Variation eingebüßt hat.[597]
Beide genannten Wüstenkärpfling-Taxa sind Beispiele für zwischenzeitlich für ausgestorben gehaltene Fisch-Taxa, die jahrelang in prekär geringer Individuenanzahl überlebt haben, dann aber zur Überraschung der Wissenschaft entweder durch Fund an abgelegenen Stellen ihres Lebensraums oder durch Erfassung nach Bestandserholung wieder vorgefunden wurden.[597][596] Die mit rund 40 Arten vertretene Gattung der Wüstenkärpflinge (oder: Wüstenfische) (Cyprinodon) weist durch eine enge evolutive Verbindung zu den erdgeschichtlichen Entwicklungsphasen biologisch ungewöhnlich bemerkenswerte Adaptionen auf und enthält Reliktarten, deren Populationen in isolierten Teilarealen verbreitet und stark gefährdet sind.[599]
- Pondicherryhai (Carcharhinus hemiodon) (Küsten Indiens und Oman bis in die Inselgebiete Südostasiens um Vietnam, Indonesien und Neuguinea; im Jahr 1979 gelang das letzte Mal ein wissenschaftlicher Nachweis, bis im Januar 2016 ein Exemplar bei Sri Lanka wiederentdeckt wurde)[600][601]
- Notropis amecae (Río Ameca (Jalisco, Mexiko); galt seit 1969 als ausgestorben, eine kleine Population wurde aber im Jahr 2001 wiederentdeckt; sie werden gezüchtet und seit 2015 wiederangesiedelt)[602][603][604]
- Pseudogobiopsis tigrellus, Syn.: Gobius tigrellus (Mamberamo (Westneuguinea, Indonesien); diese Zwerggrundel wurde zwischen 1939 und 2000 nicht gesichtet)[605][606]
- Ptychochromoides itasy (Tsiribihina (Madagaskar); zwischen den späten 1970er-Jahren und 2010 nicht gesichtet)[607][608]
- Mangarahara-Buntbarsch (Ptychochromis insolitus): Das Vorkommen in der Natur dieser Art aus der Familie der Buntbarsche wurde im Jahr 2013 wiederentdeckt. Die Wiederentdeckung war nur durch ein gezieltes Programm mit internationaler Beteiligung und Freilandarbeit möglich und ist ein Beispiel für die zahlreichen Fälle, in denen die Wiederentdeckung der Lazarus-Arten einen erheblichen Suchaufwand erfordert.[609] Die Art wird als „vom Aussterben bedroht“ eingestuft (IUCN, 2016).[610]
- Rheocles pellegrini (westlich der Stadt Andapa (Madagaskar); zwischen den 1930er-Jahren und den 2000er-Jahren nicht gesichtet)[611]
- Tiefseesaibling, Bodensee-Tiefensaibling (Salvelinus profundus) (Bodensee (Österreich, Deutschland, Schweiz); wurde im Jahr 2008 für ausgestorben erklärt, weil er in den 1970er-Jahren zuletzt gesichtet wurde; zwischen 2010 und 2015 wurde die Art wiederentdeckt)[612][613]
- Siphateles bicolor isolata, Syn.: Gila bicolor isolata (Independence Valley fault system (Elko County, Nevada, USA); diese Unterart von Siphateles bicolor war im Jahr 1965 noch häufig, verschwand aber innerhalb eines Jahrzehnts; im Jahr 2000 wurde die Art wiederentdeckt, ist aber noch immer bedroht)[614][615][595]

- Stygichthys typhlops, brasilianischer Blindsalmler, lange nur vom Holotypus aus dem Jahre 1962 bekannt, 2004 wiederentdeckt.
- Ukliva-Strömer (Telestes ukliva) (im Abfluss des Cetina (Kroatien); wurde zwischen 1988 und 1997 für ausgestorben gehalten)[616][617]
- Hippocampus tristis (Trivialname auch: „Lazarus Seahorse“[618] oder „Lazarus-Seepferdchen“[619]): diese australische Art aus der Familie der Seenadeln gehört zur Gattung der Seepferdchen, wurde 1872 erstbeschrieben und nach einer Revision der australischen Seepferdchen (Kuiter 2001) im Jahr 2009 vom Autor der Revision für „ausgestorben“ erachtet. Kuiter fand dann später zwei weitere Exemplare aus Südaustralien in Museumsmaterial, das im Jahr 1920 gefangen worden war. Schließlich konnte er auf einem im Dezember 2018 an der südaustralischen Küste aufgenommenen Unterwasserfoto ein Exemplar von Hippocampus tristis identifizieren, womit die verloren geglaubte, fast 100 Jahre lang nicht mehr gemeldete Art wiederentdeckt wurde und als „Lazarus“-Seepferdchenart erachtet werden kann.[618]
Insekten
- Xylotoles costatus: Diese Bockkäfer-Art wurde 1996 für ausgestorben erklärt und von der IUCN auch bereits seit 1986 als „ausgestorben“ aufgeführt. Die Art wurde seitdem jedoch seitdem auf South East Island, einer Insel des zu Neuseeland gehörenden Archipel der Chatham Islands, wiederentdeckt. Es existiert allerdings lediglich eine einzelne Population auf einer Fläche von rund 200 Hektar mit geschätzt weniger als 200 adulten Individuen und die Art wurde als „stark gefährdet“ eingestuft (IUCN, 2004). Auf der zum gleichen Archipel gehörenden Insel Pitt Island ist die Art vermutlich bereits ausgerottet worden.[620]
- Baumhummer (Dryococelus australis): Diese Gespenstschrecken-Art von der Lord-Howe-Insel in Australien galt aufgrund von Prädation durch eingeschleppte Ratten seit etwa 1920 oder 1930 als ausgestorben[50][621][622] und wurde auch von der IUCN (seit 1986) offiziell als ausgestorben gelistet.[621] 2001 wurde sie dann jedoch auf der kleinen, nahe der Hauptinsel gelegenen Felsinsel Ball’s Pyramid wiederentdeckt.[50][621][622] Allerdings wurde die Art nach ihrer Wiederentdeckung seit 2002 als „vom Aussterben bedroht“ eingestuft (IUCN, 2017),[621][622] da ihr verbliebener Lebensraum auf Ball’s Pyramid auf weniger als einen Quadratkilometer beschränkt (bei einem beobachteten Bestand von höchstens 35 Individuen) und zufällige, auf ihn einwirkende Ereignisse zu einem Aussterben der Art führen können.[621] – Der Fall ist ein Beispiel dafür, dass die Wissenschaft bewerten muss, wie aussichtsreich die Wiederansiedlung einer Art ist, oder ob deren Aussterben als unabwendbar hinzunehmen ist.[50]
- Linsenfliege (Thyreophora cynophila): Die Fliegen-Art aus der Familie Piophilidae wurde als seit den 1840er Jahren ausgestorben betrachtet und 2007 als einzige Dipteren-Art auf einer Liste rezenter europäischer Arten, die weltweit als ausgestorben gelten, aufgeführt.[623][624] Sie wurde vermutlich durch im Jahr 2007 durchgeführte Fallenfänge in nahe von Madrid gelegenen Wäldern wiederentdeckt.[623] – Die Wiederentdeckung der Linsenfliege warf Bedenken hinsichtlich der künftigen Erhaltung ihrer Bestände auf. Anhand dieses Falles wurde exemplarisch auf die Problematik hingewiesen, dass zu den Hauptbedrohungen von wiederentdeckten Insektenarten der wahllose Fang durch Insektensammler zählt und daher Schutzmaßnahmen wie Beschränkungen oder Verbote ihres Fangs Vorrang haben sollten.[623]
- Megachile pluto: Diese Bienen-Art nistet offenbar nur in bewohnten Nestern der baumbewohnenden Termite Microcerotermes amboinensi.[625] Die Art besitzt von allen lebenden Bienenarten die größte Körpergröße und weist eine längere Nachweisgeschichte von „Wiederentdeckungen“ auf.[626] Nachdem sie 1981 zufällig nachgewiesen wurde, gab es keine sicheren, der Wissenschaft bekannten Sichtungen mehr und daher Befürchtungen, dass die Art ausgestorben sei, bis eine Expedition im Januar 2019 die Art auf den nördlichen Molukken nachweisen konnte.[627][626][628] Die Art wird als „gefährdet“ eingestuft (IUCN, 2014).[625]
- Pharohylaeus lactiferus, die australische Bienenart galt fast 100 Jahre lang als verschollen.[629]
Weichtiere
- Aldabra-Schnecke (Rhachistia aldabrae): Diese landlebende Landlungenschnecken-Art aus der Familie Cerastidae lebt nur auf dem Aldabra-Atoll (Seychellen). Nachdem von ihr in den 1980er Jahren noch vereinzelt frische Schneckengehäuse gefunden sowie ein einzelnes im Jahr 1997, wurden trotz intensiver Suche zunächst keine Spuren ihres fortgesetzten Überlebens mehr entdeckt und sie galt als ausgestorben, bis sie 2014 wiederentdeckt wurde. Die Art wird als „vom Aussterben bedroht“ eingestuft (IUCN, 2018).[630] – Die einst häufig vorkommende Art kann als Beispiel für die bereits erkennbaren Auswirkungen des Klimawandels auf die Biodiversität Afrikas genannt werden. Sie ist heute so selten geworden, dass man zwischenzeitlich davon ausging, dass sie aufgrund des Klimawandels ausgestorben sei.[632]
- Leptoxis compacta: Süßwasserbewohnende Schnecken-Art aus der Familie Pleuroceridae mit Verbreitungsgebiet in Alabama (USA). Von der IUCN wird die Art – mit Hinweis auf Aktualisierungsbedarf – als „ausgestorben“ geführt (IUCN, 2000).[633] Die Art wurde Untersuchungen von Museumssammlungen zufolge wohl 1933 zum letzten Mal gesammelt. Im Jahr 2000 wurde sie formell für ausgestorben erklärt, 2011 aber im Cahaba River wiederentdeckt.[634]
- Littoraria flammea: Bei dieser Meeresschnecke aus der Familie der Strandschnecken war davon ausgegangen worden, dass sie letztmalig 1855 oder früher in China gesammelt wurde.[636][637] Von der IUCN wird sie seit 1996 als „ausgestorben“ gelistet, mit der Anmerkung, dass eine aktualisierte Einschätzung notwendig sei.[635] 2014 wurde die Art in Salzwiesen nahe Shanghai gefunden. Sie könnte zudem mit der im Westpazifik weit verbreiteten und häufig vorkommenden Art Littoraria melanostoma identisch sein. Littoraria flammea gehört somit zu den Arten, die erst nach über 100 Jahren wiedergefunden wurden. Sie wurde als Beispiel für die Fälle genannt, die die Angst verstärken können, durch voreilige Erklärung einer Art für „ausgestorben“ einen „Romeo-Irrtum“ zu begehen.[636]
- Lottia edmitchelli (Synonym: Collisella edmitchelli): Bei dieser Meeresschnecke aus der Familie der Lottiidae war davon ausgegangen worden, dass sie letztmalig 1861 lebend gesammelt wurde.[636][637] Seit 1996 wurde sie von der IUCN als „ausgestorben“ eingestuft, mit der Anmerkung, dass eine aktualisierte Einschätzung benötigt wird.[638] Inzwischen wird das 1861 gesammelte, vormals als Lottia edmitchelli identifizierte Exemplar, zur heute noch existierenden Art Lottia scabra gestellt, während Lottia edmitchelli als bereits im Mittelpleistozän ausgestorben erachtet wird.[636] Die Art ist damit kein Beispiel für ein weltweites Aussterben einer (rezenten) Art in historischer[A 2] Zeit (Konzept der neoextinction im Sinne von Carlton, 1993[639]),[636] sondern für ein weltweites Aussterben einer (prähistorischen) Art im Rahmen geologischer Zeiträume (Konzept der paleoextinction).[636][637]

- Omphalotropis plicosa: Diese kleingewachsene, endemisch auf Mauritius lebende Schneckenart[642] aus der Familie der Assimineidae wird seit 1994 und 1996 von der IUCN als „ausgestorben“,[636][640] und als 1878 „zuletzt gesehen“ aufgeführt, mit dem Hinweis, dass eine Aktualisierung der Einschätzung nötig ist.[640] Sie wurde 2012 (Kemp und Andere[642]) auf Grundlage der IUCN-Einstufung als ausgestorbene Meeresschnecke und als Salzwiesenbewohner eingestuft.[636][642] Tatsächlich handelt es sich jedoch nicht um eine meeresbewohnende (marine), sondern um eine landlebende (terrestrische) Schnecke, die auch – abweichend von den Angaben in Kemp und Andere und in der englischsprachigen Wikipedia – keine Salzwiesenart ist.[636] Sie ist zudem nicht ausgestorben,[636] sondern es wurden seit 2002 wiederholt lebende Exemplare gefunden und es wurde 2007 der Wechsel der IUCN-Einordnung von „ausgestorben“ auf „vom Aussterben bedroht“ vorgeschlagen.[641]
Nesseltiere
- Crambione cookii: Diese endemisch an den Küsten von Queensland lebende Schirmquallen-Art aus der Ordnung der Wurzelmundquallen, Unterordnung Daktyliophorae, Familie Catostylidae, wurde seit ihrer Erstbeschreibung im Jahr 1910 nicht mehr neu nachgewiesen, bis die wissenschaftliche Untersuchung einer Fotografie von im Sommer 1999 bis 2000 an die Küste – in der Nähe von Mooloolaba (Sunshine Coast) – angespültem Material sowie die Auswertung von Zeugenaussagen ergab, dass es sich dabei vermutlich um diese Art gehandelt hat.[643]
Beispiele für Pflanzen
Auch am Beispiel der Pflanzenwelt lässt sich belegen, dass für ausgestorbene Arten gehaltene Arten häufig wiederentdeckt werden. So wurden beispielsweise zwischen 1981 und 2001 allein 89 australische Gefäßpflanzen wiederentdeckt.[644][645]
Bedecktsamer

- Quallenbaum (Medusagyne oppositifolia): Diese immergrüne Baum- oder Strauchart der Hauptinselgruppe der Seychellen galt bereits als ausgestorben, bis sie 1970 auf Mahé (Seychellen) wiederentdeckt wurde. Seit 1998 wird sie als „vom Aussterben bedroht“ eingeordnet (IUCN, 2011).[646][647]
- Bulbostylis neglecta: Diese Grasart von der Insel St. Helena gehört zur Familie der Sauergrasgewächse und war über ein Jahrhundert lang nicht mehr erfasst worden, so dass im 2000 die Vermutung publiziert wurde, dass sie ausgestorben sein könnte. 2008 wurde sie dann aber wiederentdeckt und ist heute als „vom Aussterben bedroht“ eingestuft (IUCN, 2016).[648]
- Euphrasia arguta, (Augentrostart aus dem australischen Bundesstaat New South Wales, keine Funde zwischen 1904 und 2008)
- Haloragodendron lucassii: die zur Familie der Tausendblattgewächse gehörende Art wurde nach 1926 nicht mehr nachgewiesen und daher in die Liste ausgestorbener Arten aufgenommen, dann aber 1986 in einem Vorort Sydneys wiederentdeckt.[649] – Der Fall gilt als ein Beispiel dafür, dass sich die Aufführung in der Liste ausgestorbener Arten (Gefährdungskategorie: EX) in einigen Fällen positiv in Form gesteigerter Suchbemühungen auswirkt,[650] denn die Art wurde wiederentdeckt, weil ein Amateur-Botaniker durch Erscheinen eines Buchs über ausgestorbene und gefährdete Pflanzen, in dem sich detailliertere Angaben zur Art befanden, zur Suche nach der Art angeregt worden war.[649]
- Phebalium daviesii: Die auf Tasmanien endemische, zu den Rautengewächsen gehörende Art wächst als Strauch oder kleiner Baum,[651] wurde um 1855 in der Nähe des heutigen St Helens entdeckt und 1859 erstbeschrieben.[65] Nach 1892 wurde sie trotz intensiver Suche durch Feldbotaniker fast 100 Jahre lang nicht mehr gefunden und galt als ausgestorben, bis 1990 ein Bestand – vermutlich der rund 130 Jahre zuvor erstentdeckte der Art – am George River bei St Helens wiedergefunden wurde,[65] doch blieb das Vorkommen der nach Tasmaniens Threatened Species Protection Act 1995 „stark gefährdeten“ und nach dem Environment Protection and Biodiversity Conservation Act 1999 des Commonwealth „vom Aussterben bedrohten“ Art bis 2001 auf drei natürlich vorkommende Stellen entlang einer 4,5 km langen Uferstrecke am George River beschränkt.[651] – Als Australien dann im Jahr 2001 das 100-jährige Bestehen seiner Föderation feierte und jeder Bundesstaat eine als Zierpflanze geeignete „Föderationsblume“ nominierte, entschied sich Tasmanien für Phebalium daviesii. Der als attraktiv geltende Strauch wurde daraufhin aus der kleinen Wildpopulation vermehrt und von der Bevölkerung in St. Helen und vielen anderen Orten gezielt in den Privatgärten gepflanzt, so dass das Überleben der stark gefährdeten Art in kultivierter Form für die Zukunft gesichert sein dürfte.[65]
- Erythrina schliebenii: Diese zur Unterfamilie der Schmetterlingsblütler gehörende, in Tansania endemische[652] Korallenbäumeart war ursprünglich nur von 1934 bis 1935 in der Lake Lutamba-Region gesammelten Exemplaren bekannt[653][654] und wurde 1998 offiziell von der IUCN als „ausgestorben“ eingestuft.[653][655] Sie behielt diesen Status auch noch 2011 auf der Rote Liste gefährdeter Arten der IUCN,[655][652] war jedoch bereits 2001 in einem begrenzten Areal im Distrikt Kilwa wiederentdeckt worden.[653][654][652] Nachdem ein Teil dieses nicht naturgeschützten Waldes 2008 für eine Biokraftstoffplantage abgeholzt wurde, war erneut befürchtet worden, die Art könne nun ausgestorben sein.[656] Seit 2012 wird die in ihrer Existenz durch den Verlust von Lebensräumen aufgrund der Landrodung für landwirtschaftliche Zwecke bedrohten Art[652] von der IUCN offiziell als „vom Aussterben bedroht“ eingestuft.[653][654] – Erythrina schliebenii wird oder wurde von der rund um den Lake Lutamba wohnenden indigenen Bevölkerung in der traditionellen Medizin zur Behandlung von Magenschmerzen und Durchfall, zur Vorbeugung von Gelbsucht bei Neugeborenen und als Abtreibungsmittel eingesetzt.[652][657] Innerhalb der Gattung Erythrina ist die Anreicherung von Flavonoiden in den Pflanzen bekannt. Nach ihrer Wiederentdeckung wurde 2017 erstmals auch eine phytochemische Untersuchung von Erythrina schliebenii veröffentlicht.[652]
- Karomia gigas: Diese zur Familie der Lippenblütler gehörende Baumart war zunächst nur von einem einzigen Exemplar bekannt, das 1977 an der kenianischen Küste entdeckt,[656][655] aber einige Jahre später gefällt wurde.[656] 1994 wurde die Art von Beentje als Feared Extinct gelistet, kurz bevor ein weiteres Exemplar, das 1993 in rund 600 km Entfernung vom ersten Fundort in einer kleinen bewaldeten Parzelle in Tansania in Form eines einzelnen Samens gefunden worden war, 1995 identifiziert wurde.[656][658][655] Das Exemplar konnte jedoch nicht genau kartiert werden und trotz intensiver Suche in den späten 1980er und frühen 1990er Jahren am selben Standort wurde die Art nicht mehr wiedergefunden.[656][658][655] Nach der Entdeckung des einzelnen Baumes in Tanzania wurde die Art seit 1998 offiziell von der IUCN als „vom Aussterben bedroht“ eingestuft,[655][658] 2011 konnte schließlich ein kleiner Bestand in abgelegenem Küstengehölz in der Nähe von Kilwa im Südosten Tansanias gefunden werden,[656][655] rund 30 Kilometer vom Standort aus dem Jahr 1993 entfernt,[655] nachdem bereits von der East African Plant Red List Authority davon ausgegangen worden war, die Art sei möglicherweise ausgestorben (possibly extinct).[655][656] Die Art wird weiterhin als „vom Aussterben bedroht“ eingestuft (IUCN, 2022).[658]
Erythrina schliebenii und Karomia gigas, beides Endemiten des Biodiversitäts-Hotspots Küstenwälder Ostafrikas (und des Swahilian Regional Centre of Endemism),[655] sind Fälle von bereits möglicherweise ausgestorben geglaubten Arten, die im Zuge einer gezielten Suche von Botanikern der University of Dar es Salaam in der Nähe ihrer früheren Fundorte wiederentdeckt wurden.[656] Laut Neil Burgess, leitender Berater des Naturschutz- und Afrikaprogramms des WWF, verdeutlicht die Wiederentdeckung dieser beiden Baumarten den Mangel an Wissen über eine Waldregion, in der wir möglicherweise Arten aussterben, ohne dass sie jemals für die Wissenschaft entdeckt werden.[656]
- Polhillia ignota: Diese zur Unterfamilie der Schmetterlingsblütler gehörende südafrikanische, als Strauch wachsende Art[660] wurde 2010 anhand zweier, mit nur ungenauen Fundortangaben versehenen Herbariumsammlungen aus den Jahren 1904 und 1928 beschrieben,[661][662] zuletzt 1928 gesehen und[663] nach vergeblicher Suche in den Jahren 2005 bis 2014 schließlich 2014 auf der nationalen Roten Liste (Red List of South African Plants) als ausgestorben (Extinct) eingestuft.[661] Da die Art in Südafrika endemisch ist, handelt es sich bei ihrem Aussterben um ein globales Aussterben.[664] 2016 wurde die Art aber dann während einer Exkursion von Bürgerwissenschaftlern wiederentdeckt, die Teil des Projekts „Custodians of Rare and Endangered Wildflowers“ (CREW) war.[661][663] Die ausgiebige Suche nach dieser Art stützte sich auf den nur sehr ungenau überlieferten letzten Standort. Die Wiederentdeckung erfolgte in einem unerwarteten Lebensraum, der ebenfalls starkem Druck ausgesetzt ist. Mithilfe einer besseren Kenntnis der Lebensraumanforderungen wurden weitere neue Bestände entdeckt.[663] 2017 wurde die Art auf der Red List of South African Plants als vom Aussterben bedroht eingestuft (Gefährdungskategorie „CR“). – Der Fall von Polhillia ignota veranschaulicht exemplarisch, wie die Genauigkeit der Fundortdaten und der Suchaufwand die Erkennung von Taxa beeinflussen.[663] Die Wiederentdeckung von vom Aussterben bedrohten Taxa wie Polhillia ignota unterstreicht auch die Bedeutung einer kontinuierlichen Untersuchung verbleibender natürlicher Gebiete sowie der Wiederherstellung von Standorten, an denen noch Samenbanken einheimischer Pflanzen im Boden vorhanden sind.[665]
- Isotoma sessiliflora (Syn.: Hypsela sessiliflora), aber seit 2015 als Synonym von Isotoma fluviatilis subsp. fluviatilis erachtet: diese im Erscheinungsbild unauffällige ephemere Krautart aus der Familie der Glockenblumengewächse wurde vor 1940 lediglich dreimal in Western Sydney gesammelt, konnte bei der Suche an den beiden dokumentierten Fundorten, von denen einer durch die urbane Entwicklung verloren gegangen war, nicht mehr gefunden werden und wurde daraufhin in der nationalen Roten Liste ROTAP (Abkürzung für Rare or Threatened Australian Plants) des Jahres 1988 für ausgestorben gehalten („Presumed Extinct“). Im Jahr 2001 wurde die Art aber dann doch während eines Feldbesuchs in der Nähe ihres ursprünglichen Fundortes wiederentdeckt.[4] Im Threatened Species Conservation Act 1995 von New South Wales (kurz: NWS), wo die Art unter dem Namen Hypsela sessiliflora als „Presumed Extinct“ aufgeführt worden war, wurde ihr Status im Jahr 2003 auf „Endangered“ geändert. Noch 2015 wurde davon ausgegangen, dass die Verbreitung der Art auf die Cumberland Plain (West-Sydney) begrenzt ist. Auf Basis morphologischer und molekularer Eigenschaften wurde der taxonomische Status von Hypsela sessiliflora aber 2015 als Synonym von Isotoma fluviatilis subsp. fluviatilis aufgefasst, einem Taxon mit weiter Verbreitung, das nicht im Threatened Species Conservation Act 1995 aufgeführt ist.[666] – Dieser Fall wurde vor der taxonomischen Synonymisierung von Hypsela sessiliflora (später: Isotoma sessiliflora) Art mit Isotoma fluviatilis zur Veranschaulichung der Schwierigkeiten herangezogen, die einer Diagnose entgegenstehen, ob eine Art ausgestorben ist. Obwohl das Habitat dieser Art, die Reste der Auwälder, in den 1990er Jahren im Rahmen systematischer Vegetationsuntersuchungen der Region umfassend beprobt wurde und diese Wälder aufgrund quantitativer Erhebungen sowie umfangreicher botanische Erkundungen seit 1970 zu den am gründlichsten erforschten Pflanzenhabitaten Australiens zählen, war die Art 2001 eher zufällig wiederentdeckt worden. Die Schwierigkeit, das Aussterben in diesem Fall zu falsifizieren, hängt möglicherweise mit der unauffälligen Wachstumsform der Gattung, mit den als Reaktion auf Überschwemmungen wahrscheinlichen Bestandsschwankungen und mit dem Umstand zusammen, dass auch ein relativ intensiver Probenahmeaufwand lediglich 0,04 Prozent des potenziellen Lebensraums der Art abdeckte.[4]
- Solanum humboldtianum: Dies zur Familie der Nachtschattengewächse (Solanaceae) gehörende Art wurde in Kolumbien 200 Jahren nach ihrer letzten Erfassung wiederentdeckt.[667]
- Begonia tessaricarpa: Diese zur Familie der Schiefblattgewächse (Begoniaceae) gehörende Art wurde in Indien ein Jahrhundert nach ihrer letzten Erfassung wiederentdeckt.[667]
Zahlreiche Fälle wiederentdeckter Pflanzenarten in verschiedensten Regionen der Welt, wie etwa Solanum humboldtianum, Begonia tessaricarpa und Thuja sutchuenensis, weisen darauf hin, dass ausschließlich zeitliche, willkürlich festgelegte quantitative Grenzwerte kein hinreichendes Kriterium zur Bestimmung des Aussterbens eines Taxons darstellen, sondern als subjektiv zu betrachten sind.[667]

- Homalolepis floribunda (Syn.: Simaba floribunda): Diese zur Familie der Bittereschengewächse gehörende Art wurde in der zweiten Aktualisierung der nationalen Roten Liste Brasiliens (IBAMA, 1992) als ausgestorben eingestuft, basierend auf den CITES-Krfiterien, nach denen Arten, die in den vorangegangenen 50 Jahren nicht in der Natur gefunden wurden, als ausgestorben galten. Taxonomische und biogeografische Studien ergaben dann, dass Simaba floribunda ein weites geografische Vorkommen innerhalb des Bioms Atlantischer Regenwald (Mata Atlântica) aufweist, wonach die Art 2013 als Least Concern kategorisiert wurde.[667] 2020 stufte die IUCN Homalolepis floribunda als „vom Aussterben bedroht“ ein.[668]
- Paepalanthus cipoensis (Syn. Actinocephalus cipoensis): Diese Art aus der Familie der Eriocaulaceae wurde 2008 auf der nationalen Roten Liste Brasiliens als ausgestorben (EX) eingestuft, dann aber 99 Jahre nach ihrem letzten aufgezeichneten Vorkommen wiederentdeckt (2010 publiziert) und 2013 als vom Aussterben bedroht (CR) eingestuft.[667]
Coniferopsida
- Sichuan-Lebensbaum (Thuja sutchuenensis, Trivialname auch: „Ya Bai Shu“): die zur Familie der Zypressengewächse und zur Gattung der Lebensbäume gehörende Art wurde 1899 anhand von 1892 gesammeltem Material erstbeschrieben, danach aber nicht mehr gefunden und schließlich von der IUCN 1998 als „ausgestorben“[669] und 1998/1999 als „in der Natur ausgestorben“ (EW) eingestuft,[670][669] als einzige Koniferenart.[670] Sie war also die einzige Nadelbaumart weltweit, von der man annahm, dass sie in der historischen Zeit in der Natur ausstarb. Im Oktober 1999 wurde sie jedoch nach über 100 Jahren im zentralchinesischen Daba-Gebirge wiederentdeckt.[670] Es handelt sich um eine „Lazarus“-Art, die in den Kalkstein-Karstwäldern im Daba-Gebirge endemisch ist.[671] Aufgrund von Fortpflanzungsproblemen wurde sie nach ihrer Wiederentdeckung von der IUCN als „vom Aussterben bedroht“ eingestuft (2003)[671][669] und seit 2013 als „stark gefährdet“.[669]
Echte Farne

- Anogramma ascensionis: Diese nur von der Südatlantik-Insel Ascension (St. Helena, Ascension und Tristan da Cunha) bekannte Farnart aus der Familie der Saumfarngewächse (Pteridaceae) wurde im 20. Jahrhundert zuletzt 1958 gesichert nachgewiesen, galt danach als ausgestorben, wurde 2003 auch offiziell von der IUCN als „ausgestorben“ eingestuft, schließlich aber 2009 wiederentdeckt und ist heute als „vom Aussterben bedroht“ eingestuft (IUCN, 2010).[672]
- Asplenium dielmannii: Diese vermutlich schon seit jeher seltene Streifenfarnart von der Hawaii-Insel Kauaʻi wurde nach 1900 nicht gesehen und ihr Gefährdungsstatus schließlich als wahrscheinlich ausgestorben und besorgniserregend angesehen, da vermutet wurde, dass weitere Feldforschungen das Fortbestehen der Art im Westen von Kauaʻi belegen könnten. 2002 wurde sie schließlich wiederentdeckt.[673] Sie wird von der IUCN als „vom Aussterben bedroht“ eingestuft (2015).[674]
Siehe auch
Weblinks
- Daniel Lingenhöhl: Biodiversität - Manchmal kommen sie wieder. Spektrum.de, 22. Oktober 2010, abgerufen am 15. November 2018.
Einzelnachweise
- ↑ a b Simon A. Black: Chapter 11: Assessing Presence, Decline, and Extinction for the Conservation of Difficult-to-Observe Species. In: Francesco Maria Angelici, Lorenzo Rossi (Hrsg.): Problematic Wildlife II: New Conservation and Management Challenges in the Human-Wildlife Interactions. 1. Auflage. Springer, Cham 2020, ISBN 978-3-03042334-6, S. 359–392, hier S. 367, doi:10.1007/978-3-030-42335-3.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w Emmanuel Fara: What are Lazarus taxa? In: Geological Journal. Band 36, 3–4 (Special Issue: History of Biodiversity; Juli–Dezember 2001), 2001, S. 291–303, doi:10.1002/gj.879 (Erste Online-Veröffentlichung am 28. September 2001).
- ↑ a b P. B. Wignall, M. J. Benton: Lazarus taxa and fossil abundance at times of biotic crisis. In: Journal of the Geological Society. Band 156, Nr. 3, 1999, S. 453–456, doi:10.1144/gsjgs.156.3.0453 (Online-Veröffentlichung am 1. Juni 1999).
- ↑ a b c d e f David A. Keith, Mark A. Burgman: The Lazarus effect: can the dynamics of extinct species lists tell us anything about the status of biodiversity? In: Biological Conservation. Band 117, Nr. 1, Mai 2004, S. 41–48, doi:10.1016/S0006-3207(03)00261-1.
- ↑ John W. Wilson, Richard B. Primack: Conservation Biology in Sub-Saharan Africa. Open Book Publishers, Cambridge, UK 2019, ISBN 978-1-78374-751-1, 8. Extinction Is Forever, S. 257–296, hier S. 258, Figure 8.1, doi:10.11647/OBP.0177.08 (Lizenz: Creative Commons Attribution 4.0 International license (CC BY 4.0)).
- ↑ Vgl. P. B. Wignall, M. J. Benton: Lazarus taxa and fossil abundance at times of biotic crisis. In: Journal of the Geological Society. Band 156, Nr. 3, 1999, S. 453–456, hier S. 454, Fig. 2, doi:10.1144/gsjgs.156.3.0453 (Online-Veröffentlichung am 1. Juni 1999).
- ↑ Vgl. Douglas H. Erwin: Understanding biotic recoveries: extinction, survival and preservation during the end-Permian mass extinction. In: D. Jablonski, D. H. Erwin, J. Lipps (Hrsg.): Evolutionary Paleobiology. University of Chicago Press, Chicago 1996, ISBN 0-226-38911-1, S. 398–418, hier S. 405, Fig. 15.3, Table 15.1.
- ↑ Robert L. Carlton: A Concise Dictionary of Paleontology. Second Edition. 2. Auflage. Springer, Cham 2019, ISBN 978-3-03025585-5, hier S. 231, doi:10.1007/978-3-030-25586-2 (XII + 469 Seiten).
- ↑ Matt Wedel: Ghost lineages. In: ucmp.berkeley.edu. Mai 2007, abgerufen am 3. Januar 2024 (Aktualisierte Version von Mai 2010).
- ↑ a b c Phil Stokes: Ghosts Unearthed: Rare ‘Lazarus Taxon’ Uncovered at Penn Dixie. In: penndixie.org. 27. Juni 2023, abgerufen am 3. November 2023.
- ↑ a b Max K. Hecht: A new Choristodere (Reptilia, Diapsida) from the Oligocene of France: An example of the Lazarus effect. In: Geobios. Band 25, Nr. 1, 1992, S. 115–131, doi:10.1016/S0016-6995(09)90041-9.
- ↑ Keqin Gao, Richard C. Fox: New choristoderes (Reptilia: Diapsida) from the Upper Cretaceous and Palaeocene, Alberta and Saskatchewan, Canada, and phylogenetic relationships of Choristodera. In: Zoological Journal of the Linnean Society. Band 124, Nr. 4, Dezember 1998, S. 303–353, doi:10.1111/j.1096-3642.1998.tb00580.x.
- ↑ a b Karl W. Flessa, David Jablonski: Extinction is Here to Stay. In: Paleobiology. Band 9, Nr. 4, 1983, S. 315–321, JSTOR:2400573.
- ↑ Douglas H. Erwin, Mary L. Droser: Elvis taxa. In: PALAIOS. Band 8, Nr. 6, 1. Dezember 1993, S. 623–624, doi:10.2307/3515039. Dort mit Verweis auf: D. Jablonski: Causes and consequences of mass extinctions: a comparative approach. In: E. K. Elliott (Hrsg.): Dynamics of extinction. Wiley, New York 1986, S. 183–229. Und auf: R. L. Batten: The vicissitudes of the gastropods during the interval of Guadalupian-Ladinian time. In: A. Logan, L. V. Hills (Hrsg.): The Permian and Triassic Systems and Their Mutual Boundary (= Memoir. Band 2). Canadian Society of Petroleum Geologists, 1973, S. 596–607.
- ↑ Emmanuel Fara: What are Lazarus taxa? In: Geological Journal. Band 36, 3–4 (Special Issue: History of Biodiversity; Juli–Dezember 2001), 2001, S. 291–303, doi:10.1002/gj.879 (Erste Online-Veröffentlichung am 28. September 2001). Dort mit Verweis auf: D. Jablonski: Causes and consequences of mass extinctions: a comparative approach. In: E. K. Elliott (Hrsg.): Dynamics of extinction. Wiley, New York 1986, S. 183–229.
- ↑ a b c d Douglas H. Erwin, Mary L. Droser: Elvis taxa. In: PALAIOS. Band 8, Nr. 6, 1. Dezember 1993, S. 623–624, doi:10.2307/3515039.
- ↑ Douglas H. Erwin: Lessons from the past: Biotic recoveries from mass extinctions. In: PNAS. Band 98, Nr. 10, 8. Mai 2001, S. 5399–5403, doi:10.1073/pnas.091092698.
- ↑ a b c d e Kathleen Rust, Xijun Ni, Kristen Tietjen, K. Christopher Beard: Phylogeny and paleobiogeography of the enigmatic North American primate Ekgmowechashala illuminated by new fossils from Nebraska (USA) and Guangxi Zhuang Autonomous Region (China). In: Journal of Human Evolution. Band 185, Dezember 2023, 103452, doi:10.1016/j.jhevol.2023.103452 (Lizenz: Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International (CC BY-NC-ND 4.0 Deed)).
- ↑ a b c Isaac Schultz: Ancient 'Lazarus' Primate Was North America's Last—Until Humans Arrived, Researchers Say. Primate fossils dating back 30 million years reveal the emergence of a North American mammal lineage that originated in Asia. In: gizmodo.com. 6. November 2023, abgerufen am 25. Dezember 2023. Dort mit Verweis auf: Kathleen Rust, Xijun Ni, Kristen Tietjen, K. Christopher Beard: Phylogeny and paleobiogeography of the enigmatic North American primate Ekgmowechashala illuminated by new fossils from Nebraska (USA) and Guangxi Zhuang Autonomous Region (China). In: Journal of Human Evolution. Band 185, Dezember 2023, 103452, doi:10.1016/j.jhevol.2023.103452.
- ↑ a b c Mary R. Dawson, Laurent Marivaux, Chuan-kui Li, K. Christopher Beardand, Grégoire Métais: Laonastes and the "Lazarus Effect" in Recent Mammals. In: Science. Band 311, Nr. 5766, 10. März 2006, S. 1456–1458, doi:10.1126/science.1124187: „The Lazarus effect refers to the reappearance of taxa after a lengthy hiatus in the fossil record […] The discovery of living examples of taxa that were previously thought to be extinct is a very special case of the Lazarus effect, one that has only rarely been documented among mammals and other vertebrates.“
- ↑ Francis Lethiers, Jean-Georges Casier: Taxons “Lazares” et taxons “Elvis”:A utiliser avec circonspectionLazarus and Elvis taxa: to use cautiously. In: Geobios. Band 32, Nr. 5, 1999, S. 727–731, doi:10.1016/S0016-6995(99)80059-X.
- ↑ Simon A. Black: Chapter 11: Assessing Presence, Decline, and Extinction for the Conservation of Difficult-to-Observe Species. In: Francesco Maria Angelici, Lorenzo Rossi (Hrsg.): Problematic Wildlife II: New Conservation and Management Challenges in the Human-Wildlife Interactions. 1. Auflage. Springer, Cham 2020, ISBN 978-3-03042334-6, S. 359–392, hier S. 367, doi:10.1007/978-3-030-42335-3. Dort mit Verweis auf: Douglas H. Erwin, Mary L. Droser: Elvis taxa. In: PALAIOS. Band 8, Nr. 6, 1. Dezember 1993, S. 623–624, doi:10.2307/3515039 (Online-Veröffentlichung am).
- ↑ a b Douglas H. Erwin, Mary L. Droser: Elvis taxa. In: PALAIOS. Band 8, Nr. 6, 1. Dezember 1993, S. 623–624, doi:10.2307/3515039. Mit Verweis auf: D. H. Erwin: The great Paleozoic Crisis. Columbia University Press, New York 1993 (327 S.).
- ↑ Mark Carnall: Finding zombies, ghosts and Elvis in the fossil record. When there’s no more room in fossil hell, do the dead walk the earth again? In: theguardian.com. 3. Mai 2017, abgerufen am 18. Dezember 2023. Dort mit Verweis auf: Douglas H. Erwin, Mary L. Droser: Elvis taxa. In: PALAIOS. Band 8, Nr. 6, 1. Dezember 1993, S. 623–624, doi:10.2307/3515039.
- ↑ Mark Carnall: Finding zombies, ghosts and Elvis in the fossil record. When there’s no more room in fossil hell, do the dead walk the earth again? In: theguardian.com. 3. Mai 2017, abgerufen am 18. Dezember 2023. Dort mit Verweis auf: Allison C. Daley: Anomalocaridids. In: Current Biology. Band 23, Nr. 19, 7. Oktober 2013, S. R860–R861, doi:10.1016/j.cub.2013.07.008.
- ↑ a b Mark Carnall: Finding zombies, ghosts and Elvis in the fossil record. When there’s no more room in fossil hell, do the dead walk the earth again? In: theguardian.com. 3. Mai 2017, abgerufen am 18. Dezember 2023.
- ↑ Douglas H. Erwin: The Mother of Mass Extinctions. In: Scientific American. Band 275, Nr. 1, Juli 1996, S. 72–78, JSTOR:24993272.
- ↑ a b c d e Xijun Ni, Qiang Li, Thomas A. Stidham, Lüzhou Li, Xiaoyu Lu, Jin Meng: A late Paleocene probable metatherian (?deltatheroidan) survivor of the Cretaceous mass extinction. In: Scientific Reports. Band 6, 2016, ISSN 2045-2322, 38547, doi:10.1038/srep38547 (Lizenz: CC BY 4.0 Deed Attribution 4.0 International).
- ↑ a b Robert L. Carlton: A Concise Dictionary of Paleontology. Second Edition. 2. Auflage. Springer, Cham 2019, ISBN 978-3-03025585-5, hier S. 181, doi:10.1007/978-3-030-25586-2 (XII + 469 Seiten).
- ↑ a b c d e f g h i j Lorenzo Rossi, Veronica Padovani: The Science of Monster Hunting. In: Modena Atti della Società dei Naturalisti e Matematici di Modena. Band 152, 2021, ISSN 0365-7027, S. 141–153 (socnatmatmo.unimore.it [PDF]).
- ↑ a b c d e f g h i Evžen Kůs, Václav Pfleger: Seltene und bedrohte Tiere: Die große farbige Enzyklopädie. Gondrom, Bindlach 2001, ISBN 3-8112-1830-1, S. 137.
- ↑ a b c d e f g h i E. Thenius: „Lebende Fossilien“ im Organismenreich: Paläontologie und Molekularbiologie als wichtigste Grundlagen. In: Denisia. Nr. 20, 2007, ISSN 1608-8700, S. 75–96 (zobodat.at [PDF] Zugleich: Kataloge der oberösterreichischen Landesmuseen, Neue Serie, 66).
- ↑ a b W. E. Engelmann: Klasse Knochenfische (Osteichthyes). In: Wolf-Eberhard Engelmann (Hrsg.): Zootierhaltung: Tiere in menschlicher Obhut: Fische. 1. Auflage. Harri Deutsch, Frankfurt am Main 2005, ISBN 3-8171-1352-8, S. 219–224, hier S. 224.
- ↑ a b c d e f g h Simon A. Black: Chapter 11: Assessing Presence, Decline, and Extinction for the Conservation of Difficult-to-Observe Species. In: Francesco Maria Angelici, Lorenzo Rossi (Hrsg.): Problematic Wildlife II: New Conservation and Management Challenges in the Human-Wildlife Interactions. 1. Auflage. Springer, Cham 2020, ISBN 978-3-03042334-6, S. 359–392, hier S. 368, doi:10.1007/978-3-030-42335-3.
- ↑ a b c W. E. Engelmann, J. Kormann: 17: Ordnung Hohlstachlerartige (Coelacanthiformes). In: Wolf-Eberhard Engelmann (Hrsg.): Zootierhaltung: Tiere in menschlicher Obhut: Fische. 1. Auflage. Harri Deutsch, Frankfurt am Main 2005, ISBN 3-8171-1352-8, S. 225.
- ↑ E. Thenius: „Lebende Fossilien“ im Organismenreich: Paläontologie und Molekularbiologie als wichtigste Grundlagen. In: Denisia. Nr. 20, 2007, ISSN 1608-8700, S. 75–96 (zobodat.at [PDF] Zugleich: Kataloge der oberösterreichischen Landesmuseen, Neue Serie, 66). Dort mit Verweis auf: H. Fricke: Coelacanths: The fish that time forgot. In: National Geographic. Band 173, Nr. 6, Juni 1988, ISSN 0027-9358, S. 824–838.
- ↑ Latimeria chalumnae in der Roten Liste gefährdeter Arten der IUCN 2000. Eingestellt von: Musick, J.A., 2000. Abgerufen am 17. Mai 2022.
- ↑ Latimeria menadoensis in der Roten Liste gefährdeter Arten der IUCN 2008. Eingestellt von: Erdmann, M., 2008. Abgerufen am 17. Mai 2022.
- ↑ Vgl. auch Fig. 2 in: Lorenzo Rossi, Veronica Padovani: The Science of Monster Hunting. In: Modena Atti della Società dei Naturalisti e Matematici di Modena. Band 152, 2021, ISSN 0365-7027, S. 141–153 (socnatmatmo.unimore.it [PDF]).
- ↑ a b c Mary R. Dawson, Laurent Marivaux, Chuan-kui Li, K. Christopher Beard, Grégoire Métais: Laonastes and the "Lazarus Effect" in Recent Mammals. In: Science. Band 311, Nr. 5766, 10. März 2006, S. 1456–1458, doi:10.1126/science.1124187.
- ↑ a b c d Dorothée Huchon, Pascale Chevret, Ursula Jordan, C. William Kilpatrick, Vincent Ranwez, Paulina D. Jenkins, Jürgen Brosius, Jürgen Schmitz: Multiple molecular evidences for a living mammalian fossil. In: Proceedings of the National Academy of Sciences of the USA (PNAS). Band 104, Nr. 18, 1. Mai 2007, S. 7495–7499, doi:10.1073/pnas.0701289104.
- ↑ a b c Ein lebendes Fossil. Norbert Frie Presse- und Informationsstelle: Westfaelische Wilhelms-Universität Münster. In: idw-online.de (Informationsdienst Wissenschaft (idw)). 10. Mai 2007, abgerufen am 6. Mai 2022. Dort mit Verweis auf: Dorothée Huchon, Pascale Chevret, Ursula Jordan, C. William Kilpatrick, Vincent Ranwez, Paulina D. Jenkins, Jürgen Brosius, Jürgen Schmitz: Multiple molecular evidences for a living mammalian fossil. In: Proceedings of the National Academy of Sciences of the USA (PNAS). Band 104, Nr. 18, 1. Mai 2007, S. 7495–7499, doi:10.1073/pnas.0701289104.
- ↑ a b Paulina D. Jenkins, C. William Kilpatrick, Mark F. Robinson, Robert J. Timmins: Morphological and molecular investigations of a new family, genus and species of rodent (Mammalia: Rodentia: Hystricognatha) from Lao PDR. In: Systematics and Biodiversity. Band 2, Nr. 4, 2005, S. 419–454, doi:10.1017/S1477200004001549.
- ↑ Laonastes aenigmamus in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Duckworth, J.W., 2016. Abgerufen am 24. Mai 2022.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai Wolfgang Böhme, Darius Stiels: Totgesagte leben länger: Wiederentdeckungen ausgestorben geglaubter Landwirbeltiere. In: Koenigiana. Band 1, Nr. 1, 2007, ISSN 2627-0005, S. 21–39.
- ↑ a b Ralph M. Wetzel, Robert E. Dubos, Robert L. Martin, Philip Myers: Catagonus, an "Extinct" Peccary, Alive in Paraguay. In: Science. Band 189, Nr. 4200, 1. August 1975, S. 379–381, doi:10.1126/science.189.4200.379, JSTOR:1740567.
- ↑ a b Ralph M. Wetzel: The Chacoan peccary, Catagonus wagneri (Rusconi). In: Bull. Cernegie Mus. Nat. Hist. (Bulletin of Carnegie Museum Of Natural History). Band 3, 1977, ISSN 0145-9058, S. 1–36 (biodiversitylibrary.org).
- ↑ a b c M. Eisentraut: Über das Vorkommen des Chaco-Pekari, Catagonus wagneri, in Bolivien. In: Bonn. zool. Beitr. Band 37, Nr. 1, S. 43–47 (biodiversitylibrary.org).
- ↑ Diether Zscheile, Karin Zscheile: Zootierhaltung: Säugetiere. Begründet von W. Puschmann, fortgeführt und neu bearbeitet von D. Zscheile und K. Zscheile. 6. Auflage. Verlag Europa-Lehrmittel (Edition Harri Deutsch), Haan-Gruiten 2018, ISBN 978-3-8085-5745-7, S. 707.
- ↑ a b c d e f g Alberto Castaño Camacho: Lazarus Species: hope for conservation? Sometimes, species that were decleared extint are rediscovered, as if they came back to life. In: latinamericanpost.com. 26. Dezember 2017, abgerufen am 21. Mai 2022.
- ↑ Catagonus wagneri in der Roten Liste gefährdeter Arten der IUCN 2015. Eingestellt von: Altrichter, M., Taber, A., Noss, A., Maffei, L. & Campos, J., 2011. Abgerufen am 14. Mai 2022.
- ↑ Christian Matschei: Seltene Tiere im Zoo - Säugetiere. Schüling Verlag, Münster 2017, ISBN 978-3-86523-288-5, S. 16.
- ↑ Burramys parvus in der Roten Liste gefährdeter Arten der IUCN 2008. Eingestellt von: Menkhorst, P., Broome, L. & Driessen, M., 2008. Abgerufen am 14. Mai 2022.
- ↑ Michael Archer, Hayley Bates, Suzanne J. Hand, Trevor Evans, Linda Broome, Bronwyn McAllan, Fritz Geiser, Stephen Jackson, Troy Myers, Anna Gillespie, Chris Palmer, Tahneal Hawke, Alexis M. Horn: The Burramys Project: a conservationist's reach should exceed history’s grasp, or what is the fossil record for? In: Phil. Trans. R. Soc. B. Band 374, Nr. 1788, 4. November 2019, 20190221, doi:10.1098/rstb.2019.0221.
- ↑ B. Sanchíz, R. Adrover: Anfibios fósiles del Pleistoceno de Mallorca. In: Doñana, Acta vertebrata. Band 4, 1/2 (Dezember 1977), 1979, ISSN 0210-5985, S. 5–25 (csic.es – Veröffentlichungsjahr: 1979 (sic!)).
- ↑ Alytes muletensis in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2020. Abgerufen am 14. Mai 2022.
- ↑ a b c d e Gallotia bravoana in der Roten Liste gefährdeter Arten der IUCN 2009. Eingestellt von: Jose Antonio Mateo Miras, Valentin Pérez-Mellado, Iñigo Martínez-Solano, 2008. Abgerufen am 23. Dezember 2023.
- ↑ a b c Arnulf Köhncke: Lazarus-Effekt: Ausgestorbene Tiere, die wieder auftauchten. In: blog.wwf.de. 27. Mai 2021, abgerufen am 23. Dezember 2023.
- ↑ a b c d e Riley Black: Sciencespeak: Lazarus taxon. In: nationalgeographic.com. 2. Februar 2015, abgerufen am 4. November 2023.
- ↑ Jinshuang Ma: The chronology of the “living fossil” Metasequoia glyptostroboides (Taxodiaceae): A review (1943–2003). In: Harvard Papers in Botany. Band 8, Nr. 1, 2003, ISSN 1043-4534, S. 9–18 (ddg-web.de [PDF]). Eine deutschsprachige Version ist verfügbar als: Jinshuang Ma: Die Chronologie des "lebenden Fossils" Metasequoia glyptostroboides (Taxodiaceae): Ein Rückblick (1943–2003). 2005, ISBN 3-9801412-1-7 (amerikanisches Englisch: The chronology of the “living fossil” Metasequoia glyptostroboides (Taxodiaceae): A review (1943–2003). Übersetzt von H. Krüger, L. Krüger, Projekt Mammutbaum - http://mammutbaum.liluz.de/ - Ref.: Metasequoia-Ma-20050807-1.01-DE).
- ↑ a b c Walter Jung: Die Metasequoia, ein zum Leben erwecktes Fossil. In: palaeo.de. Abgerufen am 4. November 2023 (Online-Begleitartikel zur Sonderausstellung "Von der Evolution vergessen? - Lebende Fossilien).
- ↑ Wyn G. Jones, Kenneth D. Hill, J. M. Allen: Wollemia nobilis, a new living Australian genus and species in the Araucariaceae. In: Telopea: Journal of plant systematics. Band 6, Nr. 2–3, 1995, S. 173–176, doi:10.7751/telopea19953014.
- ↑ a b c Wollemia nobilis: Wollemi pine. In: kew.org. Abgerufen am 4. November 2023.
- ↑ a b Richard Pallardy: Mystery of 'living fossil' tree frozen in time for 66 million years finally solved. In: livescience.com. 15. September 2023, abgerufen am 4. November 2023.
- ↑ a b c d e f Mark Wapstra, Fred Duncan, Alex Buchanan, Richard Schahinger: Finding a botanical Lazarus: tales of Tasmanian plant species 'risen from the dead'. In: The Tasmanian Naturalist. Band 128, 2006, ISSN 0819-6826, S. 61–85.
- ↑ a b c Wollemia nobilis in der Roten Liste gefährdeter Arten der IUCN 2011. Eingestellt von: Thomas, P., 2010. Abgerufen am 4. November 2023.
- ↑ Robert L. Carlton: A Concise Dictionary of Paleontology. Second Edition. 2. Auflage. Springer, Cham 2019, ISBN 978-3-03025585-5, hier S. 252, doi:10.1007/978-3-030-25586-2 (XII + 469 Seiten).
- ↑ a b John W. Wilson, Richard B. Primack: Conservation Biology in Sub-Saharan Africa. Open Book Publishers, Cambridge, UK 2019, ISBN 978-1-78374-751-1, 8. Extinction Is Forever, S. 257–296, hier S. 272, Figure 8.7, doi:10.11647/OBP.0177.08 (Lizenz: Creative Commons Attribution 4.0 International license (CC BY 4.0)). Dort mit Verweis auf: Guidelines for Using the IUCN Red List Categories and Criteria. Version 13. (PDF) In: nc.iucnredlist.org. IUCN, 2017, abgerufen am 27. Dezember 2023 (Die URL führt inzwischen auf eine aktuellere Version der Publikation.).
- ↑ a b c d e N. J. Collar: Extinction by assumption; or, the Romeo Error on Cebu. In: Oryx. Band 32, Nr. 4, Oktober 1998, S. 239–244, doi:10.1046/j.1365-3008.1998.d01-51.x (Erste Online-Veröffentlichung am 28. Juni 2008).
- ↑ J. Michael Scott, Fred L. Ramsey, Martjan Lammertink, Kenneth V. Rosenberg, Ron Rohrbaugh, John A. Wiens, J. Michael Reed: When is an “Extinct” Species Really Extinct? Gauging the Search Efforts for Hawaiian Forest Birds and the Ivory-Billed Woodpecker. In: Avian Conservation and Ecology - Écologie et conservation des oiseaux. Band 3, Nr. 2, 2008, S. Art. 3, doi:10.5751/ACE-00254-030203 (Erste Online-Veröffentlichung: 28. November 2008).
- ↑ a b c d e f Fernanda Schmidt Silveira, Angelo Alberto Schneider, Luis Rios de Moura Baptista: The role of a local rediscovery in the evaluation of the conservation status of a plant species: Testing the hypothesis of the biodiversity knowledge gap. In: Journal for Nature Conservation. Band 48, April 2019, S. 91–98, doi:10.1016/j.jnc.2018.10.004.
- ↑ a b c d Ben Collen, Samuel T. Turvey: Chapter 9: Probabilistic methods for determining extinction chronologies. In: Samuel T. Turvey (Hrsg.): Holocene Extinctions. Oxford University Press, Oxford & New York 2009, ISBN 978-0-19-953509-5, S. 181–191, hier S. 189, doi:10.1093/acprof:oso/9780199535095.001.0001 (Erste Online-Veröffentlichung im September 2009, DOI des Kapitels: 10.1093/acprof:oso/9780199535095.003.0009): „Scientists are sensibly reluctant to state with certainty if a species is extinct, so as not to facilitate the Romeo effect (giving up on a species too early; Collar 1998) or the Lazarus effect (bringing species back from the dead; Wignall and Benton 1999; Keith and Burgman 2004)“
- ↑ a b c Ben Collen, Andy Purvis, Georgina M. Mace: BIODIVERSITY RESEARCH: When is a species really extinct? Testing extinction inference from a sighting record to inform conservation assessment. In: Diversity Distrib. (Diversity and Distributions). Band 16, Nr. 5, September 2010, S. 755–764, doi:10.1111/j.1472-4642.2010.00689.x (Erste Online-Veröffentlichung am 12. Juli 2010): „Scientists are reluctant to state with certainty if a species is extinct, so as not to facilitate the Romeo effect (giving up on a species too early; Collar, 1998) or the Lazarus effect (bringing species back from being named extinct; Keith & Burgman, 2004).“
- ↑ a b c Jonathon C. Dunn, Graeme M. Buchanan, Richard J. Cuthbert, Mark J. Whittingham, Philip J.K. McGowan: Mapping the potential distribution of the Critically Endangered Himalayan Quail Ophrysia superciliosa using proxy species and species distribution modelling. In: Bird Conservation International. Band 25, Nr. 4, Dezember 2015, S. 466–478, doi:10.1017/S095927091400046X (Erste Online-Veröffentlichung am 5. Februar 2015; Lizenz: Creative Commons Attribution 3.0 Unported (CC BY 3.0)): „For example, giving up prematurely may doom the species to extinction (the ‘Romeo error’; Collar 1998) and re-appearances (the ‘Lazarus effect’; Keith and Burgman 2004 ) may waste conservation resources if costly and extensive surveys are undertaken.“
- ↑ a b c d e f g Brett R. Scheffers, Ding Li Yong, J. Berton C. Harris, Xingli Giam, Navjot S. Sodhi: The World's Rediscovered Species: Back from the Brink? In: PLoS ONE. Band 6, Nr. 7, 2011, S. e22531, doi:10.1371/journal.pone.0022531 (8 Seiten (als PDF), Erste Online-Veröffentlichung am 27. Juli 2011).
- ↑ a b c d e f g h i Stéphane Caut, Magaly Holden, Michael J. Jowers, Renaud Boistel, Ivan Ineich: Is Bocourt’s Terrific Skink Really So Terrific? Trophic Myth and Reality. In: PLoS ONE. Band 8, Nr. 10, 2013, 78638, doi:10.1371/journal.pone.0078638.
- ↑ Brett R. Scheffers, Ding Li Yong, J. Berton C. Harris, Xingli Giam, Navjot S. Sodhi: The World's Rediscovered Species: Back from the Brink? In: PLoS ONE. Band 6, Nr. 7, 2011, S. e22531, hier 4. Seite, Fig. 1, doi:10.1371/journal.pone.0022531 (Erste Online-Veröffentlichung am 27. Juli 2011).
- ↑ Vgl. Paul S. Martin: Chapter 17: Prehistoric Overkill: The Global Model. In: Paul S. Martin, Richard G. Klein (Hrsg.): Quaternary Extinctions: A prehistoric revolution. The University of Arizona Press, Tucson, Arizona 1984, ISBN 0-8165-0812-7, S. 354–403, hier S. 367, Fig. 17.8.: „Percent survival of large animals on three continents and two large islands; time in common logarithms. The intensity and sequence of extinctions follow cultural development: extinction was less severe in Africa compared with America, Australia, New Zealand, and Madagascar which suffered heavy losses.“.
- ↑ John W. Wilson, Richard B. Primack: Conservation Biology in Sub-Saharan Africa. Open Book Publishers, Cambridge, UK 2019, ISBN 978-1-78374-751-1, 8. Extinction Is Forever, S. 257–296, hier S. 259f, Figure 8.2, doi:10.11647/OBP.0177.08 (Lizenz: Creative Commons Attribution 4.0 International license (CC BY 4.0)).
- ↑ a b c d e f Frank Glaw, David Prötzel, Falk Eckhardt, Njaratiana A. Raharinoro, Rojo N. Ravelojaona, Timon Glaw, Kathrin Glaw, Julia Forster, Miguel Vences: Rediscovery, conservation status and genetic relationships of the Malagasy chameleon Furcifer voeltzkowi. In: Salamandra. Band 56, Nr. 4, 30. Oktober 2020, ISSN 0036-3375, S. 342–354 (salamandra-journal.com).
- ↑ a b John W. Wilson, Richard B. Primack: Conservation Biology in Sub-Saharan Africa. Open Book Publishers, Cambridge, UK 2019, ISBN 978-1-78374-751-1, 10. Conserving Ecosystems, S. 327–374, hier S. 328, Figure 10.1, doi:10.11647/OBP.0177.08 (Lizenz: Creative Commons Attribution 4.0 International license (CC BY 4.0)).
- ↑ a b c d Top Most Wanted Lost Species. In: rewild.org. Abgerufen am 2. Januar 2024.
- ↑ Ilex sapiiformis in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: Fernandez, E., Arguello, L., Martinelli, G. & Gomes, M., 2020. Abgerufen am 2. Januar 2023.
- ↑ a b Devin Murphy, Lindsay Renick Mayer: Lost tap-dancing spider rediscovered barricaded in a burrow in a small Portuguese town after 92 years. DNA analysis confirms that Fagilde’s trapdoor spider is still surviving in the village it is named after. In: rewild.org. 15. Dezember 2023, abgerufen am 2. Januar 2024.
- ↑ The Search for Lost Species. In: globalwildlife.org. Abgerufen am 2. Januar 2024. Von dort erfolgt Weiterleitung auf re:wild: Lost Species. In: rewild.org. 2023, abgerufen am 2. Januar 2024.
- ↑ Brigitte Osterath: Natur und Umwelt: Verzweifelt gesucht: 25 Tier- und Pflanzenarten. Seit Jahrzehnten wurden sie nicht mehr gesehen. Gibt es sie überhaupt noch? Oder sind sie ausgestorben? Eine Suchaktion soll die Antwort liefern. Hier sind ein paar Arten, die Naturschützer hoffen, bald wiederzusehen. In: dw.com. 24. April 2017, abgerufen am 2. Januar 2024. Dort mit Verweis auf: The Search for Lost Species. In: globalwildlife.org. Abgerufen am 2. Januar 2024.
- ↑ Stéphane Caut, Magaly Holden, Michael J. Jowers, Renaud Boistel, Ivan Ineich: Is Bocourt’s Terrific Skink Really So Terrific? Trophic Myth and Reality. In: PLoS ONE. Band 8, Nr. 10, 2013, 78638, doi:10.1371/journal.pone.0078638. Dort mit Verweis auf: Stephen Gidiere, Jeff Wood: The dilemma of rediscovered 'extinct' species. In: Trends: ABA Section of Environment, Energy, and Resources Newsletter. Band 37, 1 (September/October), 2005, ISSN 1533-9556, S. 13–14 (heinonline.org).
- ↑ Stephen Gidiere, Jeff Wood: The dilemma of rediscovered 'extinct' species. In: Trends: ABA Section of Environment, Energy, and Resources Newsletter. Band 37, 1 (September/October), 2005, ISSN 1533-9556, S. 13–14 (heinonline.org).
- ↑ a b c d e f g h i j H. R. Akçakaya, David A. Keith, Mark Burgman, Stuart H.M. Butchart, Michael Hoffmann, Helen M.Regan, Ian Harrison, Elizabeth Boakes: Inferring extinctions III: A cost-benefit framework for listing extinct species. In: Biological Conservation. Band 214, Oktober 2017, S. 336–342, doi:10.1016/j.biocon.2017.07.027.
- ↑ a b c S. H. M. Butchart, A. J. Stattersfield, T. M. Brooks: Going or gone: Defining 'Possibly Extinct' species to give a truer picture of recent extinctions. In: Bull. B. O. C. (Bulletin of the British Ornithologists’ Club). 126A, 2006, ISSN 0007-1595, S. 7–24 (academia.edu).
- ↑ John W. Wilson, Richard B. Primack: Conservation Biology in Sub-Saharan Africa. Open Book Publishers, Cambridge, UK 2019, ISBN 978-1-78374-751-1, 8. Extinction Is Forever, S. 257–296, hier S. 268, Figure 8.5, doi:10.11647/OBP.0177.08 (Lizenz: Creative Commons Attribution 4.0 International license (CC BY 4.0)).
- ↑ J. C. Z. Woinarski, M. F. Braby, A. A. Burbidge, D.Coates, S. T. Garnett, R. J. Fensham, S. M. Legge, N. L. McKenzie, J. L. Silcock, B. P. Murphy: Reading the black book: The number, timing, distribution and causes of listed extinctions in Australia. In: Biological Conservation. Band 239, Nr. 108261, November 2019, doi:10.1016/j.biocon.2019.108261.
- ↑ Wolfgang Böhme, Darius Stiels: Totgesagte leben länger: Wiederentdeckungen ausgestorben geglaubter Landwirbeltiere. In: Koenigiana. Band 1, Nr. 1, 2007, ISSN 2627-0005, S. 21–39. Dort mit Verweis auf: S. H. M. Butchart, A. J. Stattersfield, T. M. Brooks: Going or gone: Defining 'Possibly Extinct' species to give a truer picture of recent extinctions. In: Bull. B. O. C. (Bulletin of the British Ornithologists' Club). 126A, 2006, ISSN 0007-1595, S. 7–24 (academia.edu). Sowie auf: S. H. M. Butchart, N. J. Collar, M. J. Crosby, J. A. Tobias: "Lost" and poorly known birds: targets for birders in Asia. In: BirdingASIA. Band 3, Juni 2005, S. 41–49 (academia.edu orientalbirdclub.org). Und auf: Joseph A. Tobias, Stuart H. M. Butchart, Nigel J. Collar: Lost and found: a gap analysis for the Neotropical avifauna. In: Neotropical Birding. 2006, S. 3–22.
- ↑ Acrocephalus orinus in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: BirdLife International, 2021. Abgerufen am 9. Januar 2024.
- ↑ a b Actenoides bougainvillei in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: BirdLife International, 2022. Abgerufen am 9. Januar 2024.
- ↑ Aegotheles savesi in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ Aegotheles tatei in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: BirdLife International, 2023. Abgerufen am 9. Januar 2024.
- ↑ Aepypodius bruijnii in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ a b Amaurocichla bocagii in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ a b Saucerottia castaneiventris in der Roten Liste gefährdeter Arten der IUCN 2019. Eingestellt von: BirdLife International, 2019. Abgerufen am 9. Januar 2024.
- ↑ Amazilia luciae in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ Amblyornis flavifrons in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ Anas nesiotis in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ Anodorhynchus leari in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: BirdLife International, 2019. Abgerufen am 9. Januar 2024.
- ↑ Aplonis pelzelni in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ a b Arborophila davidi in der Roten Liste gefährdeter Arten der IUCN 2019. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ a b Atlapetes pallidiceps in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ Atrichornis clamosus in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: BirdLife International, 2022. Abgerufen am 9. Januar 2024.
- ↑ Aythya innotata in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: BirdLife International, 2022. Abgerufen am 9. Januar 2024.
- ↑ a b Bangsia melanochlamys in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ a b Bostrychia bocagei in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ a b Bradypterus seebohmi in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ Cacicus koepckeae in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ Calyptura cristata in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ a b c d Campephilus principalis in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ a b c Antrostomus noctitherus in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: BirdLife International, 2023. Abgerufen am 9. Januar 2024.
- ↑ Carpococcyx viridis in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ Celeus obrieni in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ a b c Bangsia flavovirens in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ Chondrohierax wilsonii in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ a b Cisticola melanurus in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ a b Clytoctantes alixii in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ Clytoctantes atrogularis in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: BirdLife International, 2023. Abgerufen am 9. Januar 2024.
- ↑ a b Clytorhynchus sanctaecrucis in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: BirdLife International, 2022. Abgerufen am 9. Januar 2024.
- ↑ Coeligena orina in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ a b Coracornis sanghirensis in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ Columba argentina in der Roten Liste gefährdeter Arten der IUCN 2019. Eingestellt von: BirdLife International, 2019. Abgerufen am 9. Januar 2024.
- ↑ Conothraupis mesoleuca in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: BirdLife International, 2017. Abgerufen am 9. Januar 2024.
- ↑ Copsychus cebuensis in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: BirdLife International, 2023. Abgerufen am 9. Januar 2024.
- ↑ a b Corvus unicolor in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ a b Cossypha heinrichi in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2021. Abgerufen am 9. Januar 2024.
- ↑ a b c Laniellus langbianis in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ a b Dicaeum quadricolor in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ Diglossa gloriosissima in der Roten Liste gefährdeter Arten der IUCN 2019. Eingestellt von: BirdLife International, 2019. Abgerufen am 9. Januar 2024.
- ↑ a b Dysithamnus occidentalis in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: BirdLife International, 2022. Abgerufen am 9. Januar 2024.
- ↑ Eleoscytalopus psychopompus in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: BirdLife International, 2021. Abgerufen am 9. Januar 2024.
- ↑ a b Embernagra longicauda in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ Eriocnemis mirabilis in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: BirdLife International, 2017. Abgerufen am 9. Januar 2024.
- ↑ Estrilda poliopareia in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ Eurostopodus diabolicus in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: BirdLife International, 2023. Abgerufen am 9. Januar 2024.
- ↑ Eutrichomyias rowleyi in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ a b Eutriorchis astur in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ a b Ficedula bonthaina in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: BirdLife International, 2023. Abgerufen am 9. Januar 2024.
- ↑ a b Ficedula disposita in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ a b Ficedula henrici in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: BirdLife International, 2021. Abgerufen am 9. Januar 2024.
- ↑ a b Formicarius rufifrons in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: BirdLife International, 2023. Abgerufen am 9. Januar 2024.
- ↑ a b Formicivora erythronotos in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ a b Pampusana hoedtii in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ a b Ianthocincla bieti in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ a b c Pterorhinus courtoisi in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ a b Grallaria alleni in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ a b Grallaria milleri in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: BirdLife International, 2022. Abgerufen am 9. Januar 2024.
- ↑ a b Hapalopsittaca fuertesi in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2021. Abgerufen am 9. Januar 2024.
- ↑ a b Akialoa ellisiana in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ a b Hemitriccus inornatus in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ Hemitriccus kaempferi in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: BirdLife International, 2017. Abgerufen am 9. Januar 2024.
- ↑ a b Athene blewitti in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ a b Hylopezus auricularis in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ Laniarius brauni in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ a b c Lanius newtoni in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ a b Lepidothrix vilasboasi in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2021. Abgerufen am 9. Januar 2024.
- ↑ Leptodon forbesi in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ Loddigesia mirabilis in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: BirdLife International, 2023. Abgerufen am 9. Januar 2024.
- ↑ Lophura edwardsi in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ Lophura inornata in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: BirdLife International, 2022. Abgerufen am 9. Januar 2024.
- ↑ Larvivora ruficeps in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ Macroagelaius subalaris in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: BirdLife International, 2017. Abgerufen am 9. Januar 2024.
- ↑ Madanga ruficollis in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ a b c Chlorophoneus kupeensis in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ Melanocharis arfakiana in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: BirdLife International, 2017. Abgerufen am 9. Januar 2024.
- ↑ a b Melanospiza richardsoni in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ Merulaxis stresemanni in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ Moho bishopi in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: BirdLife International, 2023. Abgerufen am 9. Januar 2024.
- ↑ Moho braccatus in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: BirdLife International, 2023. Abgerufen am 9. Januar 2024.
- ↑ a b Symposiachrus boanensis in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ a b c Symposiachrus julianae in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: BirdLife International, 2021. Abgerufen am 9. Januar 2024.
- ↑ a b Myrmotherula luctuosa in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ Nemosia rourei in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ a b c d e Crithagra concolor in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ Newtonia fanovanae in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: BirdLife International, 2021. Abgerufen am 9. Januar 2024.
- ↑ Nipponia nippon in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ Nyctibius leucopterus in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ a b c d e Fregetta maoriana in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ Ognorhynchus icterotis in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ a b Otus alfredi in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ Otus capnodes in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: BirdLife International, 2017. Abgerufen am 9. Januar 2024.
- ↑ Otus insularis in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ Otus pauliani in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ Parotia berlepschi in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ a b Penelope albipennis in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ Perdicula manipurensis in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ Pezoporus occidentalis in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: BirdLife International, 2021. Abgerufen am 9. Januar 2024.
- ↑ Phodilus prigoginei in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ a b Pithys castaneus in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ a b Hydrornis gurneyi in der Roten Liste gefährdeter Arten der IUCN 2019. Eingestellt von: BirdLife International, 2019. Abgerufen am 9. Januar 2024.
- ↑ a b c Hydrornis schneideri in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: BirdLife International, 2023. Abgerufen am 9. Januar 2024.
- ↑ a b c Erythropitta venusta in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: BirdLife International, 2023. Abgerufen am 9. Januar 2024.
- ↑ Ploceus aureonucha in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2021. Abgerufen am 9. Januar 2024.
- ↑ Ploceus megarhynchus in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2021. Abgerufen am 9. Januar 2024.
- ↑ Ploceus ruweti in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ a b Poecilotriccus senex in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ a b c d Porphyrio hochstetteri in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ a b c d e f g h Pseudobulweria becki in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ Pseudobulweria macgillivrayi in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ a b Pseudocalyptomena graueri in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2021. Abgerufen am 9. Januar 2024.
- ↑ a b Pseudonestor xanthophrys in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: BirdLife International, 2022. Abgerufen am 9. Januar 2024.
- ↑ a b c Pterodroma cahow in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ Pterodroma madeira in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ Pterodroma magentae in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ a b Pycnonotus nieuwenhuisii in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: BirdLife International, 2023. Abgerufen am 9. Januar 2024.
- ↑ Pyrrhula murina in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2021. Abgerufen am 9. Januar 2024.
- ↑ a b Rallus antarcticus in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2021. Abgerufen am 9. Januar 2024.
- ↑ a b c Eumyias additus in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: BirdLife International, 2022. Abgerufen am 9. Januar 2024.
- ↑ a b Rhinoptilus bitorquatus in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ a b Rhipidura malaitae in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: BirdLife International, 2023. Abgerufen am 9. Januar 2024.
- ↑ a b Sarothrura watersi in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: BirdLife International, 2021. Abgerufen am 9. Januar 2024.
- ↑ a b c Crithagra flavigula in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ a b c Syndactyla striata in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ a b Siphonorhis brewsteri in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2021. Abgerufen am 9. Januar 2024.
- ↑ a b Spelaeornis badeigularis in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: BirdLife International, 2023. Abgerufen am 9. Januar 2024.
- ↑ a b Stachyris herberti in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ a b Thalasseus bernsteini in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ a b Synallaxis kollari in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ a b Tanygnathus gramineus in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: BirdLife International, 2016. Abgerufen am 9. Januar 2024.
- ↑ Thamnophilus praecox in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: BirdLife International, 2022. Abgerufen am 9. Januar 2024.
- ↑ Thaumatibis gigantea in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: BirdLife International, 2018. Abgerufen am 9. Januar 2024.
- ↑ a b c Lipaugus conditus in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: BirdLife International, 2022. Abgerufen am 9. Januar 2024.
- ↑ Toxostoma guttatum in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ a b c Cincloramphus rufus in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ Turnix worcesteri in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: BirdLife International, 2021. Abgerufen am 9. Januar 2024.
- ↑ Tyto soumagnei in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: BirdLife International, 2023. Abgerufen am 9. Januar 2024.
- ↑ Vermivora bachmanii in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ Xenoglaux loweryi in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ Zosterops meeki in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: BirdLife International, 2020. Abgerufen am 9. Januar 2024.
- ↑ a b c d e f g h i j k l m n o p Brett R. Scheffers, Ding Li Yong, J. Berton C. Harris, Xingli Giam, Navjot S. Sodhi: The World’s Rediscovered Species: Back from the Brink? In: PLoS ONE. Band 6, Nr. 7, 2011, S. e22531, hier 7. Seite, Table S1. (.doc-Datei, https://doi.org/10.1371/journal.pone.0022531.s006), doi:10.1371/journal.pone.0022531 (Erste Online-Veröffentlichung am 27. Juli 2011): "List of amphibian, bird, and mammal species rediscovered. Also shown are the year last seen, year rediscovered, number of years gone missing, the 2009 IUCN Red List conservation status and type of rediscovery."
- ↑ Kate Neafsey: Lessons from the ivory-billed woodpecker. In: news.cornell.edu Cornell Chronicle (hauseigene Wochenzeitung der Cornell University). 22. Dezember 2009, abgerufen am 17. April 2022.
- ↑ a b David L. Roberts, Chris S. Elphick, J. Michael Reed: Identifying Anomalous Reports of Putatively Extinct Species and Why It Matters. In: Conservation Biology. Band 24, Nr. 1, Februar 2010, S. 189–196, JSTOR:40419644.
- ↑ David S. Wilcove: Rediscovery of the Ivory-billed Woodpecker. In: Science. Band 308, Nr. 5727, 3. Mai 2005, S. 1422–1423, doi:10.1126/science.1114507.
- ↑ David L. Roberts: Extinct or Possibly Extinct? In: Science. Band 312, Nr. 5776, 19. Mai 2006, S. 997–998, doi:10.1126/science.312.5776.997c.
- ↑ a b David S. Wilcove: Rediscovery of the Ivory-billed Woodpecker. In: Science. Band 308, Nr. 5727, 3. Mai 2005, S. 1422–1423, doi:10.1126/science.1114507. Dort mit Verweis auf: Henry Fountain: The Basics; Extinct? Prove It. In: nytimes.com. 1. Mai 2005, abgerufen am 17. April 2022.
- ↑ Peter Cashwell: Along Those Lines: The Boundaries that Create Our World. Paul Dry Book, Philadelphia, Pennsylvania 2014, ISBN 978-1-58988-092-4, We’re Not Lost, S. 213–225, hier S. 221.
- ↑ Ploceus megarhynchus in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2021. Abgerufen am 21. Mai 2022.
- ↑ Fae Sapsford: 2022 Cahow Season Sees Record Number of Cahow Fledglings, 21. Mai 2022 bei nonsuchisland.com.
- ↑ a b c d Daniel Lingenhöhl: Lazarus-Spezies: 10 Arten, die von den Toten zurückkehrten. In: spektrum.de. 21. Mai 2017, abgerufen am 19. August 2025.
- ↑ a b c d Michael Schroepel, Wolfgang Grummt: 17 Ordnung Kranichvögel (Gruiformes). In: W. Grummt, H. Strehlow (Hrsg.): Zootierhaltung: Vögel. 2. Auflage. Verlag Europa-Lehrmittel (Edition Harri Deutsch), Haan-Gruiten 2014, ISBN 978-3-8085-5747-1, S. 277.
- ↑ a b c Bryan Nelson: Lazarus Species: 12 'Extinct' Animals Found Alive. Sometimes species that have disappeared are found again. In: treehugger.com. 9. Mai 2022, abgerufen am 3. Juni 2022.
- ↑ Porphyrio mantelli in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: BirdLife International, 2016. Abgerufen am 8. Juni 2022.
- ↑ a b c d e John R. Platt: Why Don’t We Hear About More Species Going Extinct? The extinction crisis threatens life all over the planet, but scientists are cautious about declaring a species extinct too quickly. In: therevelator.org. 28. Mai 2019, abgerufen am 10. April 2022. Dort mit Verweis auf: N. J. Collar: Extinction by assumption; or, the Romeo Error on Cebu. In: Oryx. Band 32, Nr. 4, Oktober 1998, S. 239–244, doi:10.1046/j.1365-3008.1998.d01-51.x (Erstmals online veröffentlicht am 28. Juni 2008).
- ↑ a b c S. H. M. Butchart, A. J. Stattersfield, T. M. Brooks: Going or gone: Defining 'Possibly Extinct' species to give a truer picture of recent extinctions. In: Bull. B. O. C. (Bulletin of the British Ornithologists' Club). 126A, 2006, ISSN 0007-1595, S. 7–24 (academia.edu): „However, extinction — the disappearance of the last individual of a species — is very difficult to detect (Diamond 1987).“ Dort mit Verweis auf: N. J. Collar: Extinction by assumption; or, the Romeo Error on Cebu. In: Oryx. Band 32, Nr. 4, Oktober 1998, S. 239–244, doi:10.1046/j.1365-3008.1998.d01-51.x (Erste Online-Veröffentlichung am 28. Juni 2008). Und auf: Guy C. L. Dutson, Perla M. Magsalay, Rob J. Timmins: The rediscovery of the Cebu Flowerpecker Dicaeum Quadricolor, with notes on other forest birds on Cebu, Philippines. In: Bird Conservation International. Band 3, Nr. 3, September 1993, S. 235–243, doi:10.1017/S0959270900000927 (Erste Online-Veröffentlichung am 11. Mai 2010).
- ↑ a b Guy C. L. Dutson, Perla M. Magsalay, Rob J. Timmins: The rediscovery of the Cebu Flowerpecker Dicaeum Quadricolor, with notes on other forest birds on Cebu, Philippines. In: Bird Conservation International. Band 3, Nr. 3, September 1993, S. 235–243, doi:10.1017/S0959270900000927 (Erste Online-Veröffentlichung am 11. Mai 2010).
- ↑ a b Perla Magsalay, Thomas Brooks, Guy Dutson, Rob Timmins: Extinction and conservation on Cebu. In: Nature. Band 373, 1995, ISSN 1476-4687, S. 294, doi:10.1038/373294a0 (Veröffentlichung am 26. Januar 1995).
- ↑ S. H. M. Butchart, A. J. Stattersfield, T. M. Brooks: Going or gone: Defining 'Possibly Extinct' species to give a truer picture of recent extinctions. In: Bull. B. O. C. (Bulletin of the British Ornithologists' Club). 126A, 2006, ISSN 0007-1595, S. 7–24 (academia.edu): „However, extinction — the disappearance of the last individual of a species — is very difficult to detect (Diamond 1987).“ Dort mit Verweis auf: Perla Magsalay, Thomas Brooks, Guy Dutson, Rob Timmins: Extinction and conservation on Cebu. In: Nature. Band 373, 1995, ISSN 1476-4687, S. 294, doi:10.1038/373294a0 (Veröffentlichung am 26. Januar 1995).
- ↑ D. S. Rabor: The Impact of Deforestation on Birds of Cebu, Philippines, with New Records for That Island. In: The Auk. Band 76, Nr. 1, 1959, S. 37–43, doi:10.2307/4081841, JSTOR:4081841: „Ten endemic forms (see list below) have been recognized for Cebu. All presumably were forest birds. We were able to find only one of these, the Black Shama, Copsychus cebuensis. [...] Copsychus cebuensis Steere. Black Shama.-Collected by: Steere Expedition, Bourns and Worcester, McGregor, and Empeso. Lives in original forests, dense thickets, and dense second growth mixed with thickets. Its adaptation to second growth and thickets will help much in its survival on the island. F. Empeso collected a single specimen, a male with the testes enlarged, on July 16, 1956, in dense second growth mixed with thickets.“
- ↑ N. J. Collar: Extinction by assumption; or, the Romeo Error on Cebu. In: Oryx. Band 32, Nr. 4, Oktober 1998, S. 239–244, doi:10.1046/j.1365-3008.1998.d01-51.x (Erste Online-Veröffentlichung am 28. Juni 2008): „In retrospect it is apparent that after c. 1960 Cebu was effectively written off the biological map, with no ornithological interest other than shorebird counts and P.M. Magsalay's work on Rabor's one known forest survivor, the black shama Copsychus cebuensis.“
- ↑ Paul F. Donald: Facing Extinction: The World’s Rarest Birds and the Race to Save Them. T & AD Poyser, London 2010, ISBN 978-0-7136-7021-9, hier S. 221. Dort mit Verweis auf: Warren B. King: Red data book: Volume 2: Aves. IUCN, Morges 1978 ("1978-1979").
- ↑ Perla Magsalay, Thomas Brooks, Guy Dutson, Rob Timmins: Extinction and conservation on Cebu. In: Nature. Band 373, 1995, ISSN 1476-4687, S. 294, doi:10.1038/373294a0 (Veröffentlichung am 26. Januar 1995): „The latest Red Data Book lists the island's two endemic species, the Cebu flowerpeeker and the black shama (Copsychus cebuensis), as 'threatened'.“
- ↑ Turdus xanthorhynchus in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2020. Abgerufen am 21. Mai 2022.
- ↑ a b c d e John W. Wilson, Richard B. Primack: Conservation Biology in Sub-Saharan Africa. Open Book Publishers, Cambridge, UK 2019, ISBN 978-1-78374-751-1, 8. Extinction Is Forever, S. 257–296, hier S. 261, doi:10.11647/OBP.0177.08 (Lizenz: Creative Commons Attribution 4.0 International license (CC BY 4.0)).
- ↑ Atlapetes blancae in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: BirdLife International, 2021. Abgerufen am 21. Mai 2022.
- ↑ a b Panji Gusti Akbar, Teguh Willy Nugroho, Muhammad Suranto, Muhammad Rizky Fauzan, Oddy Ferdiansyah, Joko Said Trisiyanto, Ding Li Yong: Missing for 170 years-the rediscovery of Black-browed Babbler Malacocincla perspicillata on Borneo. In: BirdingASIA. Band 34, 31. Dezember 2021, S. 13–14, doi:10.5281/zenodo.4562229.
- ↑ Malacocincla perspicillata in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: BirdLife International, 2016. Abgerufen am 21. Mai 2022.
- ↑ a b c d e Diana O. Fisher, Simon P. Blomberg: Correlates of rediscovery and the detectability of extinction in mammals. Rediscovery bias in mammals. In: Proceedings of the Royal Society B: Biological Sciences. Band 278, Nr. 1708, April 2011, S. 1090–1097, doi:10.1098/rspb.2010.1579 (Online publiziert am 29. September 2010).
- ↑ Diana O. Fisher, Simon P. Blomberg: Inferring Extinction of Mammals from Sighting Records, Threats, and Biological Traits. In: Conservation Biology. Band 26, Nr. 1, Februar 2012, S. 57–67, JSTOR:41416130.
- ↑ a b Brian Switek: A Third of 'Extinct' Mammals May Still Be Alive. There may be many more “extinct” mammals waiting to be rediscovered than conservation biologists previously thought. Categorizing a mammal species as extinct has rested upon two criteria: It has not been seen for more than 50 years, or an exhaustive search has come up empty. But “extinct” species occasionally turn up again, and some species […] In: wired.com. 29. September 2010, abgerufen am 20. Januar 2024. Dort mit Verweis auf: Diana O. Fisher, Simon P. Blomberg: Correlates of rediscovery and the detectability of extinction in mammals. Rediscovery bias in mammals. In: Proceedings of the Royal Society B: Biological Sciences. Band 278, Nr. 1708, April 2011, S. 1090–1097, doi:10.1098/rspb.2010.1579 (Online publiziert am 29. September 2010).
- ↑ Katrin Blawat: Artenvielfalt: Wiederauferstanden von den Ausgestorbenen. In der Wildnis, tief im Dschungel, in einer Skihütte oder im Mülleimer: Überraschend häufig werden Tierarten wiederentdeckt, die längst als ausgestorben galten. Sind Meldungen über das Artensterben etwa übertrieben? In: sueddeutsche.de. 9. Februar 2012, abgerufen am 20. Januar 2024. Dort mit Verweis auf: Diana O. Fisher, Simon P. Blomberg: Correlates of rediscovery and the detectability of extinction in mammals. Rediscovery bias in mammals. In: Proceedings of the Royal Society B: Biological Sciences. Band 278, Nr. 1708, April 2011, S. 1090–1097, doi:10.1098/rspb.2010.1579 (Online publiziert am 29. September 2010).
- ↑ a b Tamsin E. Lee, Diana O. Fisher, Simon P. Blomberg, Brendan A. Wintle: Extinct or still out there? Disentangling influences on extinction and rediscovery helps to clarify the fate of species on the edge. In: Global Change Biology. Band 23, Nr. 2, Februar 2017, S. 465–976, e1-e4, doi:10.1111/gcb.13421.
- ↑ Acerodon humilis in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Mildenstein, T., 2015. Abgerufen am 7. Januar 2024.
- ↑ a b Acomys nesiotes in der Roten Liste gefährdeter Arten der IUCN 2019. Eingestellt von: Gerrie, R. & Kennerley, R., 2017. Abgerufen am 7. Januar 2024.
- ↑ Allocebus trichotis in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: Louis, E.E., Frasier, C.L., Bezandry, N., Sefczek, T.M., Bailey, C.A., Mittermeier, R.A., Mittermeier, J. & Réné De Roland, L.A., 2018. Abgerufen am 7. Januar 2024.
- ↑ a b Arctocephalus philippii in der Roten Liste gefährdeter Arten der IUCN 2015. Eingestellt von: Aurioles-Gamboa, D., 2014. Abgerufen am 7. Januar 2024.
- ↑ a b Arctocephalus townsendi in der Roten Liste gefährdeter Arten der IUCN 2015. Eingestellt von: Aurioles-Gamboa, D., 2014. Abgerufen am 7. Januar 2024.
- ↑ Balantiopteryx infusca in der Roten Liste gefährdeter Arten der IUCN 2015. Eingestellt von: Tirira, D., 2014. Abgerufen am 7. Januar 2024.
- ↑ a b Brachytarsomys villosa in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Kennerley, R. & Goodman, S., 2016. Abgerufen am 7. Januar 2024.
- ↑ Bunolagus monticularis in der Roten Liste gefährdeter Arten der IUCN 2019. Eingestellt von: Collins, K., Bragg, C. & Birss, C., 2016. Abgerufen am 7. Januar 2024.
- ↑ Carpomys melanurus in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Kennerley, R., 2016. Abgerufen am 7. Januar 2024.
- ↑ a b c d e Sapajus flavius in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: Valença-Montenegro, M.M., Bezerra, B.M., Martins, A.B., Jerusalinsky, L., Fialho, M.S. & Lynch Alfaro, J.W., 2020. Abgerufen am 7. Januar 2024.
- ↑ Cercopithecus sclateri in der Roten Liste gefährdeter Arten der IUCN 2019. Eingestellt von: Baker, L., Oates, J.F., Ikemeh, R. & Gadsby, E., 2019. Abgerufen am 7. Januar 2024.
- ↑ Chacodelphys formosa in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Teta, P., de la Sancha, N. & Flores, D., 2016. Abgerufen am 7. Januar 2024.
- ↑ Chaetomys subspinosus in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: Catzeflis, F., Patton, J., Percequillo, A., Bonvicino, C.R. & Weksler, M., 2016. Abgerufen am 7. Januar 2024.
- ↑ Cheirogaleus sibreei in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: Blanco, M., Dolch, R., Ganzhorn, J., Greene, L.K., Le Pors, B., Lewis, R., Louis, E.E., Rafalinirina, H.A., Raharivololona, B., Rakotoarisoa, G., Ralison, J., Randriahaingo, H.N.T., Rasoloarison, R.M., Razafindrasolo, M., Sgarlata, G.M., Wright, P. & Zaonarivelo, J., 2018. Abgerufen am 7. Januar 2024.
- ↑ Chinchilla chinchilla in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Roach, N. & Kennerley, R., 2016. Abgerufen am 7. Januar 2024.
- ↑ Chinchilla lanigera in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Roach, N. & Kennerley, R., 2015. Abgerufen am 7. Januar 2024.
- ↑ Chodsigoa sodalis in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Johnston, C. & Smith, A.T., 2015. Abgerufen am 7. Januar 2024.
- ↑ Crocidura andamanensis in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Molur, S., 2016. Abgerufen am 7. Januar 2024.
- ↑ Crocidura caliginea in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Hutterer, R., 2016. Abgerufen am 7. Januar 2024.
- ↑ a b Crocidura dhofarensis in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Gerrie, R. & Kennerley, R., 2016. Abgerufen am 7. Januar 2024.
- ↑ Crocidura jenkinsi in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Molur, S., 2016. Abgerufen am 7. Januar 2024.
- ↑ a b Crocidura macmillani in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Kennerley, R. & Lavrenchenko, L., 2016. Abgerufen am 7. Januar 2024.
- ↑ a b Crocidura picea 0 in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: Kennerley, R., 2017. Abgerufen am 7. Januar 2024.
- ↑ Crocidura trichura in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Woinarski, J., Burbidge, A.A. & Lumsden, L., 2015. Abgerufen am 7. Januar 2024.
- ↑ Cryptochloris zyli in der Roten Liste gefährdeter Arten der IUCN 2015. Eingestellt von: Bronner, G., 2014. Abgerufen am 7. Januar 2024.
- ↑ a b Cryptotis endersi in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: Naylor, L. & Roach, N., 2016. Abgerufen am 7. Januar 2024.
- ↑ a b Cryptotis nelsoni in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: Matson, J., Cuarón, A.D. & de Grammont, P.C., 2016. Abgerufen am 7. Januar 2024.
- ↑ Dactylopsila tatei in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Leary, T., Wright, D., Hamilton, S., Singadan, R., Menzies, J., Bonaccorso, F., Helgen, K., Seri, L. & Allison, A., 2015. Abgerufen am 7. Januar 2024.
- ↑ Diplogale hosei in der Roten Liste gefährdeter Arten der IUCN 2015. Eingestellt von: Mathai, J., Duckworth, J.W., Wilting, A., Hearn, A. & Brodie, J., 2015. Abgerufen am 7. Januar 2024.
- ↑ a b Dobsonia chapmani in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: Heaney, L., Ong, P., Tabaranza, B., Rosell-Ambal, R.G.B., Balete, D.S., Alcala, E., Paguntalan, L., Pedregosa, M. & Carino, A., 2020. Abgerufen am 7. Januar 2024.
- ↑ Ectophylla alba in der Roten Liste gefährdeter Arten der IUCN 2015. Eingestellt von: Rodriguez, B. and Pineda, W., 2015. Abgerufen am 7. Januar 2024.
- ↑ Eupetaurus cinereus in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: Krishna, M. & Ferguson, A., 2020. Abgerufen am 7. Januar 2024.
- ↑ Funisciurus duchaillui in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Gerrie, R. & Kennerley, R., 2016. Abgerufen am 7. Januar 2024.
- ↑ a b Geocapromys ingrahami in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: Kennerley, R., Turvey, S.T. & Young, R., 2017. Abgerufen am 7. Januar 2024.
- ↑ a b Glischropus javanus in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Görföl, T., Hutson, A.M., Sinaga, U., Suyanto, A., Kingston, T. & Csorba, G., 2015. Abgerufen am 7. Januar 2024.
- ↑ a b c Gymnobelideus leadbeateri in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Woinarski, J. & Burbidge, A.A., 2014. Abgerufen am 7. Januar 2024.
- ↑ a b Harpiola grisea in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Csorba, G., Molur, S., Srinivasulu, C. & Chakravarty, R., 2015. Abgerufen am 7. Januar 2024.
- ↑ a b Hipposideros coronatus in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Phelps, K., Heaney, L. & Sedlock, J., 2015. Abgerufen am 7. Januar 2024.
- ↑ a b Hipposideros marisae in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: Cooper-Bohannon, R., Mickleburgh, S., Hutson, A.M., Bergmans, W. & Fahr, J., 2019. Abgerufen am 7. Januar 2024.
- ↑ Hipposideros ridleyi in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: Khan, F.A.A., Rajasegaran, P. & Rosli, Q., 2018. Abgerufen am 7. Januar 2024.
- ↑ a b Kerivoula africana in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: Cooper-Bohannon, R., Fahr, J. & Jacobs, D., 2019. Abgerufen am 7. Januar 2024.
- ↑ Latidens salimalii in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: Srinivasulu, C. & Srinivasulu, B., 2020. Abgerufen am 7. Januar 2024.
- ↑ a b Leptomys signatus in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Leary, T., 2016. Abgerufen am 7. Januar 2024.
- ↑ a b c d Notamacropus parma in der Roten Liste gefährdeter Arten der IUCN 2019. Eingestellt von: Lunney, D. & McKenzie, N., 2015. Abgerufen am 7. Januar 2024.
- ↑ Marmosa andersoni in der Roten Liste gefährdeter Arten der IUCN 2015. Eingestellt von: Solari, S., 2015. Abgerufen am 7. Januar 2024.
- ↑ Mesocapromys angelcabrerai in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: Kennerley, R., Turvey, S.T., Young, R. & Borotto-Páez, R., 2017. Abgerufen am 7. Januar 2024.
- ↑ Microakodontomys transitorius in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: Vieira, E., Marinho Filho, J. & McCay, S., 2016. Abgerufen am 7. Januar 2024.
- ↑ Microcebus myoxinus in der Roten Liste gefährdeter Arten der IUCN 2014. Eingestellt von: Baden, A., Blanco, M., Chikhi, L., Cooke, A., Davies, N., Dolch, R., Donati, G., Ganzhorn, J., Golden, C., Groeneveld, L.F., Irwin, M., Johnson, S., Kappeler, P., King, T., Lewis, R., Louis, E.E., Markolf, M., Mass, V., Mittermeier, R.A., Nichols, R., Patel, E., Rabarivola, C.J., Raharivololona, B., Rajaobelina, S., Rakotoarisoa, G., Rakotomanga, B., Rakotonanahary, J., Rakotondrainibe, H., Rakotondratsimba, G., Rakotondratsimba, M., Rakotonirina, L., Ralainasolo, F.B., Ralison, J., Ramahaleo, T., Ranaivoarisoa, J.F., Randrianahaleo, S.I., Randrianambinina, B., Randrianarimanana, L., Randrianasolo, H., Randriatahina, G., Rasamimananana, H., Rasolofoharivelo, T., Rasoloharijaona, S., Ratelolahy, F., Ratsimbazafy, J., Ratsimbazafy, N., Razafindraibe, H., Razafindramanana, J., Rowe, N., Salmona, J., Seiler, M., Volampeno, S., Wright, P., Youssouf, J., Zaonarivelo, J. & Zaramody, A., 2012. Abgerufen am 7. Januar 2024.
- ↑ a b c Microtus bavaricus in der Roten Liste gefährdeter Arten der IUCN 2019. Eingestellt von: Meinig, H., 2019. Abgerufen am 7. Januar 2024.
- ↑ a b Muntiacus montanus in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Timmins, R.J., Duckworth, J.W. & Groves, C.P., 2015. Abgerufen am 7. Januar 2024.
- ↑ a b Muntiacus rooseveltorum in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Timmins, R. & Duckworth, J.W., 2015. Abgerufen am 7. Januar 2024.
- ↑ Mustela nigripes in der Roten Liste gefährdeter Arten der IUCN 2015. Eingestellt von: Belant, J., Biggins, D., Garelle, D., Griebel, R.G. & Hughes, J.P., 2015. Abgerufen am 7. Januar 2024.
- ↑ a b c Myotis planiceps in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Arroyo-Cabrales, J. & Ospina-Garces, S., 2015. Abgerufen am 7. Januar 2024.
- ↑ Natalus primus in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Mancina, C., 2014. Abgerufen am 7. Januar 2024.
- ↑ Neopteryx frosti in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Tsang, S.M., 2016. Abgerufen am 7. Januar 2024.
- ↑ Nesolagus netscheri in der Roten Liste gefährdeter Arten der IUCN 2019. Eingestellt von: McCarthy, J., Holden, J., Martyr, D. & McCarthy, K., 2018. Abgerufen am 7. Januar 2024.
- ↑ Nesoromys ceramicus in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Dickman, C. & Wright, D., 2016. Abgerufen am 7. Januar 2024.
- ↑ a b Nesoryzomys fernandinae in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: Dowler, R. & Weksler, M., 2017. Abgerufen am 7. Januar 2024.
- ↑ a b Nesoryzomys swarthi in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: Dowler, R. & Weksler, M., 2017. Abgerufen am 7. Januar 2024.
- ↑ Nomascus nasutus in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: Rawson, B.M., Roos, C., Nguyen, M.H., Bleisch, W., Geissmann, T. & Fan, P.F., 2015. Abgerufen am 7. Januar 2024.
- ↑ a b Nyctimene malaitensis in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: Lavery, T.H., 2016. Abgerufen am 7. Januar 2024.
- ↑ Onychogalea fraenata in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Burbidge, A.A., Johnson, C.N. & Zichy-Woinarski, J., 2016. Abgerufen am 7. Januar 2024.
- ↑ Lagothrix flavicauda in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: Shanee, S., Cornejo, F.M., Aquino, R., Mittermeier, R.A. & Vermeer, J., 2019. Abgerufen am 7. Januar 2024.
- ↑ Oryzomys gorgasi in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: Weksler, M. & Timm, R., 2017. Abgerufen am 7. Januar 2024.
- ↑ a b Otomops formosus in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Hutson, A.M., Schlitter, D., Walston, J., Kingston, T. & Senawi, J., 2015. Abgerufen am 7. Januar 2024.
- ↑ Parantechinus apicalis in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Burbidge, A.A. & Woinarski, J., 2015. Abgerufen am 7. Januar 2024.
- ↑ a b Catopuma badia in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Hearn, A., Brodie, J., Cheyne, S., Loken, B., Ross, J. & Wilting, A., 2014. Abgerufen am 7. Januar 2024.
- ↑ Petaurus gracilis in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Burnett, S., Winter, J. & Martin, R., 2015. Abgerufen am 7. Januar 2024.
- ↑ Petinomys fuscocapillus in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Kennerley, R., 2016. Abgerufen am 7. Januar 2024.
- ↑ Phaenomys ferrugineus in der Roten Liste gefährdeter Arten der IUCN 2019. Eingestellt von: Percequillo, A., 2016. Abgerufen am 7. Januar 2024.
- ↑ a b Phoniscus papuensis in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: Loyd, A.M. & Pennay, M., 2020. Abgerufen am 7. Januar 2024.
- ↑ Phyllomys unicolor in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Loss, C. & Leite, Y., 2016. Abgerufen am 7. Januar 2024.
- ↑ Phyllonycteris aphylla in der Roten Liste gefährdeter Arten der IUCN 2015. Eingestellt von: Koenig, S. & Davalos, L., 2015. Abgerufen am 7. Januar 2024.
- ↑ a b Plagiodontia aedium in der Roten Liste gefährdeter Arten der IUCN 2008. Eingestellt von: Turvey, S. & Incháustegui, S., 2008. Abgerufen am 7. Januar 2024.
- ↑ a b Porcula salvania in der Roten Liste gefährdeter Arten der IUCN 2019. Eingestellt von: Meijaard, E., Narayan, G. & Deka, P., 2016. Abgerufen am 7. Januar 2024.
- ↑ a b c Potorous gilbertii in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Woinarski, J. & Burbidge, A.A., 2016. Abgerufen am 7. Januar 2024.
- ↑ Prionailurus planiceps in der Roten Liste gefährdeter Arten der IUCN 2015. Eingestellt von: Wilting, A., Brodie, J., Cheyne, S., Hearn, A., Lynam, A., Mathai, J., McCarthy, J., Meijaard, E., Mohamed, A., Ross, J., Sunarto, S. & Traeholt, C., 2014. Abgerufen am 7. Januar 2024.
- ↑ Prolemur simus in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: Ravaloharimanitra, M., King, T., Wright, P., Raharivololona, B., Ramaherison, R.P., Louis, E.E., Frasier, C.L., Dolch, R., Roullet, D., Razafindramanana, J., Volampeno, S., Randriahaingo, H.N.T., Randrianarimanana, L., Borgerson, C. & Mittermeier, R.A., 2018. Abgerufen am 7. Januar 2024.
- ↑ Pseudantechinus mimulus in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Woinarski, J. & Burbidge, A.A., 2014. Abgerufen am 7. Januar 2024.
- ↑ a b Pseudomys novaehollandiae in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Woinarski, J. & Burbidge, A.A., 2012. Abgerufen am 7. Januar 2024.
- ↑ Pteralopex anceps in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: Lavery, T.H., 2016. Abgerufen am 7. Januar 2024.
- ↑ a b Pteropus gilliardorum in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: Leary, T. & Helgen, K., 2019. Abgerufen am 7. Januar 2024.
- ↑ a b Pteropus nitendiensis in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: Leary, T., Lavery, T.H. & Pierce, R., 2019. Abgerufen am 7. Januar 2024.
- ↑ a b Rattus giluwensis in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Gerrie, R. & Kennerley, R., 2016. Abgerufen am 7. Januar 2024.
- ↑ a b Rhagomys rufescens in der Roten Liste gefährdeter Arten der IUCN 2019. Eingestellt von: Bergallo, H. & Percequillo, A., 2016. Abgerufen am 7. Januar 2024.
- ↑ a b Rhinolophus maclaudi in der Roten Liste gefährdeter Arten der IUCN 2019. Eingestellt von: Shapiro, J., Cooper-Bohannon, R. & Fahr, J., 2018. Abgerufen am 7. Januar 2024.
- ↑ Rhinolophus osgoodi in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: Sun, K., 2018. Abgerufen am 7. Januar 2024.
- ↑ Rhinopithecus avunculus in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: Quyet, L.K., Rawson, B.M., Duc, H., Nadler, T., Covert, H. & Ang, A., 2015. Abgerufen am 7. Januar 2024.
- ↑ Rhynchomys isarogensis in der Roten Liste gefährdeter Arten der IUCN 2019. Eingestellt von: Kennerley, R., 2018. Abgerufen am 7. Januar 2024.
- ↑ Rucervus eldii in der Roten Liste gefährdeter Arten der IUCN 2015. Eingestellt von: Gray, T.N.E., Brook, S.M., McShea, W.J., Mahood, S., Ranjitsingh, M.K., Miyunt, A., Hussain, S.A. & Timmins, R., 2014. Abgerufen am 7. Januar 2024.
- ↑ a b Santamartamys rufodorsalis in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: Lacher, T. & Roach, N., 2016. Abgerufen am 7. Januar 2024.
- ↑ Sminthopsis longicaudata in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: McKenzie, N., Woinarski, J. & Burbidge, A., 2015. Abgerufen am 7. Januar 2024.
- ↑ Sminthopsis psammophila in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Woinarski, J. & Burbidge, A.A., 2014. Abgerufen am 7. Januar 2024.
- ↑ a b c d e f Atopogale cubana in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: Kennerley, R., Turvey, S.T. & Young, R., 2015. Abgerufen am 7. Januar 2024.
- ↑ Solenodon paradoxus in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: Kennerley, R., Turvey, S.T. & Young, R., 2015. Abgerufen am 7. Januar 2024.
- ↑ Sus bucculentus in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Groves, C. & Meijaard, E., 2016. Abgerufen am 7. Januar 2024.
- ↑ Tarsius pumilus in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: Shekelle, M & Salim, A., 2015. Abgerufen am 7. Januar 2024.
- ↑ a b Tokudaia muenninki in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Ishii, N., 2015. Abgerufen am 7. Januar 2024.
- ↑ Tolypeutes tricinctus in der Roten Liste gefährdeter Arten der IUCN 2014. Eingestellt von: Miranda, F., Moraes-Barros, N., Superina, M. & Abba, A.M., 2013. Abgerufen am 7. Januar 2024.
- ↑ Viverra civettina in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Mudappa, D., Helgen, K. & Nandini, R., 2015. Abgerufen am 7. Januar 2024.
- ↑ a b c d e Zaglossus attenboroughi in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Leary, T., Seri, L., Flannery, T., Wright, D., Hamilton, S., Helgen, K., Singadan, R., Menzies, J., Allison, A., James, R., Aplin, K., Salas, L. & Dickman, C., 2015. Abgerufen am 7. Januar 2024.
- ↑ Zyzomys pedunculatus in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Woinarski, J. & Burbidge, A.A., 2015. Abgerufen am 7. Januar 2024.
- ↑ Vgl. Jonathan E.M. Baillie, Samuel T. Turvey, Carly Waterman: Survival of Attenborough’s long-beaked echidna Zaglossus attenboroughi in New Guinea. In: Oryx. Band 43, Nr. 1, 2009, S. 146–148, hier S. 147, plate 1 (Top), doi:10.1017/S0030605309002269.
- ↑ a b James Kempton: Found at last: critically endangered echidna finally rediscovered after 60 years. In: biology.ox.ac.uk (Department of Biology der University of Oxford). 10. November 2023, abgerufen am 13. Januar 2024.
- ↑ a b c Jonathan E.M. Baillie, Samuel T. Turvey, Carly Waterman: Survival of Attenborough’s long-beaked echidna Zaglossus attenboroughi in New Guinea. In: Oryx. Band 43, Nr. 1, 2009, S. 146–148, doi:10.1017/S0030605309002269.
- ↑ Found at last: bizarre, egg-laying mammal finally rediscovered after 60 years. In: ox.ac.uk (University of Oxford). 10. November 2023, abgerufen am 13. Januar 2024.
- ↑ Andrew Tilker: How the team searching for a lost echidna finally found it. The rugged Cyclops Mountains, covered in tropical forest, didn’t yield any secrets about the strange mammal’s whereabouts easily. In: rewild.org. 10. November 2023, abgerufen am 13. Januar 2024.
- ↑ Collections Online: Collections record: Macropus parma. In: aucklandmuseum.com. 24. Mai 2023, abgerufen am 13. Januar 2024.
- ↑ Ronald M. Nowak: Walker’s mammals of the world : Monotremes, Marsupials, Afrotherians, Xenarthrans, and Sundatherians. Johns Hopkins University Press, Baltimore 2018, ISBN 978-1-4214-2467-5, S. 358.
- ↑ a b Dendrolagus mayri in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Leary, T., Seri, L., Flannery, T., Wright, D., Hamilton, S, Helgen, K., Singadan, R., Menzies, J., Allison, A. & James, R., 2015. Abgerufen am 24. Mai 2022.
- ↑ Jonathan Bucks: Bouncing back! Tree kangaroo thought to have gone extinct is captured on film for the first time in 90 YEARS by an amateur photographer. In: dailymail.co.uk. 19. August 2018, abgerufen am 24. Mai 2022.
- ↑ Rhinoceros sondaicus in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: Ellis, S. & Talukdar, B., 2019. Abgerufen am 12. Mai 2022.
- ↑ a b c Evžen Kůs, Václav Pfleger: Seltene und bedrohte Tiere: Die große farbige Enzyklopädie. Gondrom, Bindlach 2001, ISBN 3-8112-1830-1, S. 56 f.
- ↑ Diether Zscheile, Karin Zscheile: Zootierhaltung: Säugetiere. Begründet von W. Puschmann, fortgeführt und neu bearbeitet von D. Zscheile und K. Zscheile. 6. Auflage. Verlag Europa-Lehrmittel (Edition Harri Deutsch), Haan-Gruiten 2018, ISBN 978-3-8085-5745-7, S. 677 f.
- ↑ a b Andy Carstens: How Do Scientists Decide a Species Has Gone Extinct? Getting it wrong can harm the very creatures that scientists are trying to protect. In: the-scientist.com. 1. März 2023, abgerufen am 13. November 2023. Dort mit Verweis auf: Sarah Maria Brook, Nigel Dudley, Simon Peter Mahood, Gert Polet, A. Christy Williams, J.W. Duckworth, Thinh Van Ngoc, Barney Long: Lessons learned from the loss of a flagship: The extinction of the Javan rhinoceros Rhinoceros sondaicus annamiticus from Vietnam. In: Biological Conservation. Band 174, Juni 2014, S. 21–29, doi:10.1016/j.biocon.2014.03.014.
- ↑ Sarah Maria Brook, Nigel Dudley, Simon Peter Mahood, Gert Polet, A. Christy Williams, J.W. Duckworth, Thinh Van Ngoc, Barney Long: Lessons learned from the loss of a flagship: The extinction of the Javan rhinoceros Rhinoceros sondaicus annamiticus from Vietnam. In: Biological Conservation. Band 174, Juni 2014, S. 21–29, doi:10.1016/j.biocon.2014.03.014.
- ↑ a b c d e f g h i j k E. Meijaard, V. Nijmand: Secrecy considerations for conserving Lazarus species. In: Biological Conservation. Band 175, Juli 2014, S. 21–24, doi:10.1016/j.biocon.2014.03.021.
- ↑ Dicerorhinus sumatrensis in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: Ellis, S. & Talukdar, B., 2019. Abgerufen am 18. Mai 2022.
- ↑ a b Benoît Goossens, Milena Salgado-Lynn, Jeffrine J. Rovie-Ryan, Abdul H. Ahmad, Junaidi Payne, Zainal Z. Zainuddin, Senthilvel K. S. S. Nathan, Laurentius N. Ambu: Genetics and the last stand of the Sumatran rhinoceros Dicerorhinus sumatrensis. In: Oryx. Band 47, Nr. 3, 2013, S. 340–344, doi:10.1017/S0030605313000045.
- ↑ a b c Wolfgang Puschmann (Begründer), Diether Zscheile, Karin Zscheile: Zootierhaltung: Säugetiere. 6. Auflage. Verlag Europa-Lehrmittel (Edition Harri Deutsch), Haan-Gruiten 2018, ISBN 978-3-8085-5745-7, S. 679.
- ↑ a b c Nashorn wiederentdeckt: WWF entdeckt ausgestorben geglaubte Nashorn-Art in Kalimantan/Indonesien. In: wwf.de. 23. März 2016, abgerufen am 19. Mai 2022 (Mit einem Nachtrag vom 6. April 2016).
- ↑ Diether Zscheile, Karin Zscheile: Zootierhaltung: Säugetiere. Begründet von W. Puschmann, fortgeführt und neu bearbeitet von D. Zscheile und K. Zscheile. 6. Auflage. Verlag Europa-Lehrmittel (Edition Harri Deutsch), Haan-Gruiten 2018, ISBN 978-3-8085-5745-7, S. 676.
- ↑ E. Meijaard, V. Nijmand: Secrecy considerations for conserving Lazarus species. In: Biological Conservation. Band 175, Juli 2014, S. 21–24, doi:10.1016/j.biocon.2014.03.021. Dort mit Verweis auf: 'Extinct' Sumatran rhino spotted in Indonesian forest - video. In: theguardian.com. 8. Oktober 2013 (Quelle: Reuters). Und auf: Associated Press, Sumatran rhino footprints believed found on Borneo, URL: http://bigstory.ap.org/article/sumatran-rhino-footprints-believed-foundborneo 28. März 2013.
- ↑ Sumatran rhino footprints believed found on Borneo. In: phys.org. 28. März 2013, abgerufen am 19. Mai 2022 (Quelle: Associated Press).
- ↑ Andy Carstens: How Do Scientists Decide a Species Has Gone Extinct? Getting it wrong can harm the very creatures that scientists are trying to protect. In: the-scientist.com. 1. März 2023, abgerufen am 13. November 2023. Dort mit Verweis auf: E. Meijaard, V. Nijmand: Secrecy considerations for conserving Lazarus species. In: Biological Conservation. Band 175, Juli 2014, S. 21–24, doi:10.1016/j.biocon.2014.03.021.
- ↑ a b c d e Diether Zscheile, Karin Zscheile: Zootierhaltung: Säugetiere. Begründet von W. Puschmann, fortgeführt und neu bearbeitet von D. Zscheile und K. Zscheile. 6. Auflage. Verlag Europa-Lehrmittel (Edition Harri Deutsch), Haan-Gruiten 2018, ISBN 978-3-8085-5745-7, S. 694 f.
- ↑ a b c d Simon A. Black: Chapter 11: Assessing Presence, Decline, and Extinction for the Conservation of Difficult-to-Observe Species. In: Francesco Maria Angelici, Lorenzo Rossi (Hrsg.): Problematic Wildlife II: New Conservation and Management Challenges in the Human-Wildlife Interactions. 1. Auflage. Springer, Cham 2020, ISBN 978-3-03042334-6, S. 367 f., doi:10.1007/978-3-030-42335-3.
- ↑ a b c d Jane Goodall, Thane Maynard, Gail E. Hudson: Hope for animals and their world: how endangered species are being rescued from the brink. Grand Central, New York 2009, ISBN 978-0-446-54338-5, Pygmy Hog.
- ↑ Evžen Kůs, Václav Pfleger: Seltene und bedrohte Tiere: Die große farbige Enzyklopädie. Gondrom, Bindlach 2001, ISBN 3-8112-1830-1, S. 63.
- ↑ Timm Lewerenz: Goldmull und Elefantenspitzmaus: Doch nicht ausgestorben: Wenn Tiere plötzlich wiederentdeckt werden. Wird eine verlorene Tier- oder Pflanzenart wiederentdeckt, spricht man vom Lazarus-Effekt. Aktuelles Beispiel: De Wintons Goldmull. Wie gelingen solche Funde? Ist das wirklich gut für die Tiere? Und was hat Leonardo DiCaprio mit alldem zu tun? In: rnd.de. 19. Dezember 2023, abgerufen am 22. Dezember 2023.
- ↑ Crateromys australis in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: Kennerley, R., 2016. Abgerufen am 23. Mai 2022.
- ↑ Stanislav Lhota, Brent Loken, Stephanie Spehar, Eric Fell, Alexandr Pospech, Nunuk Kasyanto: Discovery of Miller’s Grizzled Langur (Presbytis hosei canicrus) in Wehea Forest confirms the continued existence and extends known geographical range of an endangered primate. In: American Journal of Primatology. Band 74, Nr. 3, März 2012, S. 193–198, doi:10.1002/ajp.21983, PMID 24006537.
- ↑ Presbytis canicrus in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: Cheyne, S., Setiawan, A. & Traeholt, C., 2015. Abgerufen am 23. Mai 2022.
- ↑ Elizabeth Noble, Simon McKeown, Wes Sechrest: Rediscovery of the Santa Marta Toro Santamartamys rufodorsalis (Rodentia: Echimyidae), after 113 years, with notes on all three known records and the species’ conservation needs in the Sierra Nevada de Santa Marta. In: Conservación Colombiana. 15 (Birds of Colombia 2011 - Aves de Colombia 2011), 31. Oktober 2011, ISSN 1900-1592, S. 40–43.
- ↑ Pharotis imogene in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: Armstrong, K.N., Aplin, K. & Broken-brow, J., 2019. Abgerufen am 23. Mai 2022.
- ↑ a b Hugh D. Loxdale, Belinda J. Davis, Robert A. Davis: Known knowns and unknowns in biology. In: Biological Journal of the Linnean Society. Band 117, Nr. 2, Februar 2016, S. 386–398, doi:10.1111/bij.12646.
- ↑ a b c d e Cuscomys oblativa in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Roach, N., 2016. Abgerufen am 23. Mai 2022.
- ↑ a b c d Jeremy Hance: In the shadows of Machu Picchu, scientists find ‘extinct’ cat-sized mammal. Rediscovered mammal had been slaughtered by the Inca hundreds of years ago. In: news.mongabay.com. 25. September 2014, abgerufen am 1. Juni 2022.
- ↑ a b c Daniel Lingenhöhl: Lazarus-Effekt: Mythische Inkanahrung wiederentdeckt. Die alte Inkafestung Machu Picchu ist nicht nur archäologisch eine Reise wert. Die Bergwälder der Region liefern auch biologisch immer neue Überraschungen. In: spektrum.de. 26. September 2014, abgerufen am 1. Juni 2022.
- ↑ Lorenzo Rossi, Veronica Padovani: The Science of Monster Hunting. In: Modena Atti della Società dei Naturalisti e Matematici di Modena. Band 152, 2021, ISSN 0365-7027, S. 141–153 (socnatmatmo.unimore.it [PDF]). Dort mit Verweis auf:News Transcript: Press Operations: DoD News Briefing - Secretary Rumsfeld and Gen. Myers: Presenter: Secretary of Defense Donald H. Rumsfeld: February 12, 2002 11:30 AM EDT ( des vom 20. März 2018 im Webarchiv archive.today)
- ↑ a b c Hugh D. Loxdale, Belinda J. Davis, Robert A. Davis: Known knowns and unknowns in biology. In: Biological Journal of the Linnean Society. Band 117, Nr. 2, Februar 2016, S. 386–398, doi:10.1111/bij.12646: „[...] the unknown knowns, those species which we know did once exist, and assume are now extinct for whatever reason, but because of poor data, including observational and poor sampling, cannot prove one way or the other.“
- ↑ An Nguyen, Van Bang Tran, Duc Minh Hoang, Thi Anh Minh Nguyen, Dinh Thang Nguyen, Van Tiep Tran, Barney Long, Erik Meijaard, Jeff Holland, Andreas Wilting, Andrew Tilker: Camera-trap evidence that the silver-backed chevrotain Tragulus versicolor remains in the wild in Vietnam. In: Nature Ecology & Evolution. Band 3, Nr. 12, 2019, S. 1650–1654, doi:10.1038/s41559-019-1027-7, PMID 31712696.
- ↑ Tragulus versicolor in der Roten Liste gefährdeter Arten der IUCN 2015. Eingestellt von: Timmins, R., Duckworth, J.W. & Meijaard, E., 2014. Abgerufen am 23. Mai 2022.
- ↑ a b c d Evžen Kůs, Václav Pfleger: Seltene und bedrohte Tiere: Die große farbige Enzyklopädie. Gondrom, Bindlach 2001, ISBN 3-8112-1830-1, S. 14.
- ↑ Diether Zscheile, Karin Zscheile: Zootierhaltung: Säugetiere. Begründet von W. Puschmann, fortgeführt und neu bearbeitet von D. Zscheile und K. Zscheile. 6. Auflage. Verlag Europa-Lehrmittel (Edition Harri Deutsch), Haan-Gruiten 2018, ISBN 978-3-8085-5745-7, S. 431.
- ↑ a b Cryptochloris wintoni in der Roten Liste gefährdeter Arten der IUCN 2015. Eingestellt von: Bronner, G., 2014. Abgerufen am 30. Januar 2024.
- ↑ a b c d Doreen Fräßdorf: Verschollener De Wintons Goldmull nach fast 90 Jahren wiederentdeckt. In: artensterben.de. 28. November 2023, abgerufen am 30. Januar 2024.
- ↑ a b Sichtung nach mehr als 80 Jahren: Spürhund erschnuppert für ausgestorben gehaltenen Goldmull. In: Der Spiegel. 1. Dezember 2023, ISSN 2195-1349 (spiegel.de [abgerufen am 1. Dezember 2023]).
- ↑ a b Devin Murphy: FOUND: Iridescent blind mole with super-hearing powers rediscovered ‘swimming’ through sand dunes of South Africa. eDNA helped confirm DeWinton's golden mole still lives on beaches in Port Nolloth. In: rewild.org. 29. November 2023, abgerufen am 30. Januar 2024.
- ↑ a b Doreen Fräßdorf: Verschollener De Wintons Goldmull nach fast 90 Jahren wiederentdeckt. In: artensterben.de. 28. November 2023, abgerufen am 30. Januar 2024. Dort mit Verweis auf: Samantha Mynhardt, Esther Matthew, Jean Pierre le Roux, Ian Little, Paulette Bloomer, Cobus Theron: Environmental DNA from soil reveals the presence of a “lost” Afrotherian species. In: Biodiversity and Conservation. 2023, doi:10.1007/s10531-023-02728-2 (Lizenz: CC BY 4.0 Deed Attribution 4.0 International).
- ↑ Molly Bergen: How dogs and DNA could help unearth De Winton’s Golden Mole. A team of scientists is experimenting with new research techniques in hopes of finding this South African species, lost to science since 1936. 18. August 2020, abgerufen am 30. Januar 2024.
- ↑ Samantha Mynhardt, Esther Matthew, Jean Pierre le Roux, Ian Little, Paulette Bloomer, Cobus Theron: Environmental DNA from soil reveals the presence of a “lost” Afrotherian species. In: Biodiversity and Conservation. 2023, doi:10.1007/s10531-023-02728-2 (Lizenz: CC BY 4.0 Deed Attribution 4.0 International).
- ↑ De Winton's Golden Mole. In: rewild.org. 2023, abgerufen am 30. Januar 2024.
- ↑ a b c d e f g h i Doreen Fräßdorf: Mexiko: Omilteme-Baumwollschwanzkaninchen nach über 120 Jahren wiederentdeckt. In: artensterben.de. 23. Januar 2025, abgerufen am 16. März 2025.
- ↑ a b c d Sylvilagus insonus in der Roten Liste gefährdeter Arten der IUCN 2019. Eingestellt von: Lorenzo, C., Brown, D.E. & Lanier, H.C., 2018. Abgerufen am 16. März 2025.
- ↑ Devin Murphy: FOUND: Small enigmatic rabbit with black tail lost to science for more than 120 years rediscovered hopping around mountain range in Mexico. The Omiltemi cottontail rabbit was lost to science, but communities in the mountains knew where to find the species. In: rewild.org. 23. Januar 2025, abgerufen am 16. März 2025.
- ↑ Alessandro Passalalpi: Experts Rejoice As Rare Mammal Finally Resurfaces In Mexican Forest 120 Years Later. In: thetravel.com. 3. März 2025, abgerufen am 16. März 2025.
- ↑ Alina Lingg: Nach 120 Jahren: Forscher entdecken verschollene Tierart wieder. In Mexiko gelang Forschenden unlängst eine kleine Sensation: In den dichten Wäldern der Sierra Madre del Sur entdeckten sie ein seltenes Kaninchen, das seit 120 Jahren als verschollen galt. Wie es entdeckt wurde und welche Rolle es für das Ökosystem spielt. In: web.de. 14. März 2025, abgerufen am 16. März 2025.
- ↑ a b Vgl.: W. Puschmann: Zootierhaltung - Tiere in menschlicher Obhut: Säugetiere. 4. (Nachdruck) Auflage. Harri Deutsch, Haan-Frankfurt am Main 2004, ISBN 3-8171-1817-1, hier S. 714, Abb. 20.40.
- ↑ a b c d e f g h i j Valerius Geist: Phantom Subspecies: The Wood Bison Bison bison "athabascae" Rhoads 1897 Is Not a Valid Taxon, but an Ecotype. In: Arctic. Band 44, Nr. 4, Dezember 1991, S. 283–300, JSTOR:40511286.
- ↑ a b c d e f Evžen Kůs, Václav Pfleger: Seltene und bedrohte Tiere: Die große farbige Enzyklopädie. Gondrom, Bindlach 2001, ISBN 3-8112-1830-1, hier S. 74.
- ↑ a b c d e J. Dewey Soper: History, Range, and Home Life of the Northern Bison. In: Ecological Monographs. Band 11, Nr. 4, Oktober 1941, S. 347–412, doi:10.2307/1943298, JSTOR:1943298.
- ↑ a b c d e f g h i Recovery Strategy for the Wood Bison (Bison bison athabascae) in Canada (= Species at Risk Act Recovery Strategy Series). Environment and Climate Change Canada, Ottawa 2018, ISBN 978-0-660-27531-4, hier S. 3–6 (englisch, viii + 59 Seiten, publications.gc.ca [PDF; abgerufen am 1. Februar 2024] Catalogue number: En3-4/294-2018E-PDF). Auch verfügbar als: Wood Bison (Bison bison athabascae): recovery strategy in Canada 2018. Official title: Recovery Strategy for the Wood Bison (Bison bison athabascae) in Canada 2018. In: canada.ca. 28. August 2018, abgerufen am 1. Februar 2024 (Species at Risk Act (SARA): Recovery strategy series).
- ↑ a b c Daniel M. Ashe: Endangered and Threatened Wildlife and Plants; Reclassifying the Wood Bison Under the Endangered Species Act as Threatened Throughout Its Range. 50 CFR Part 17; Docket No. FWS–R9–IA–2008–0123; FXES111309F2120D2–123–FF09E22000; RIN 1018–AI83. In: Department of the Interior: Fish and Wildlife Service (Hrsg.): federalregister.gov. Band 77, Nr. 86, 3. Mai 2012, S. 26191–26212 (govinfo.gov [PDF] Dated: April 24, 2012; FR Doc. 2012–10635; Filed 5–2–12; 8:45 am; BILLING CODE 4310–55–P). Auch verfügbar als: Endangered and Threatened Wildlife and Plants; Reclassifying the Wood Bison Under the Endangered Species Act as Threatened Throughout Its Range. A Rule by the Fish and Wildlife Service on 05/03/2012. In: federalregister.gov. 5. März 2012, abgerufen am 1. Februar 2024 (Agencies: Department of the Interior, Fish and Wildlife Service; Effective Date: 06/04/2012; Document Citation: 77 FR 26191; Page: 26191-26212 (22 pages); CFR: 50 CFR 17; Agency/Docket Numbers: Docket No. FWS-R9-IA-2008-0123, FXES111309F2120D2-123-FF09E22000; RIN: 1018-AI83; Document Number: 2012-10635).
- ↑ a b Bison bison athabascae: Wood Bison. In: explorer.natureserve.org. 5. Januar 2024, abgerufen am 1. Februar 2024. Dort mit Verweis auf: J. Dewey Soper: History, Range, and Home Life of the Northern Bison. In: Ecological Monographs. Band 11, Nr. 4, Oktober 1941, S. 347–412, doi:10.2307/1943298, JSTOR:1943298.
- ↑ a b c d e f Wes Olson: Bison. In: thecanadianencyclopedia.ca. 23. April 2013, abgerufen am 2. Februar 2024 (Update vom 20. September 2019).
- ↑ C. Cormack Gates, Curtis H. Freese, Peter J. P. Gogan, Mandy Kotzman (Hrsg.): American bison: status survey and conservation guidelines 2010. IUCN, Gland 2010, ISBN 978-2-8317-1149-2, hier S. 7 f. (englisch, xviii + 134 Seiten, portals.iucn.org [PDF; abgerufen am 2. Februar 2024] IUCN: IUCN Species Survival Commission (SSC), Bison Specialist Group).
- ↑ a b c d e N. S. Novakowski: Endangered Canadian Mammals. In: The Canadian field-naturalist. Band 84, Nr. 1, 1970, S. 17–23 (biodiversitylibrary.org).
- ↑ a b c d e f g h i j k l m Bill Freedman: Environmental Science. a Canadian perspective. Dalhousie University Libraries Digital Editions, 27. August 2018, S. 726–764, hier S. 745 (englisch, digitaleditions.library.dal.ca [PDF; abgerufen am 30. Januar 2024] Copyright: Dalhousie University; Lizenz: Creative Commons Attribution-NonCommercial 4.0 International License). Auch verfügbar als: Bill Freedman: Environmental Science. a Canadian perspective. Nova Scotia Community College, Halifax (Nova Scotia) 2018, ISBN 978-1-998755-78-3, Chapter 27 ~ The Biodiversity Crisis, S. 733–772, hier S. 752 (englisch, 830 S., pressbooks.nscc.ca [PDF; abgerufen am 30. Januar 2024] Copyright: Dalhousie University; Lizenz: Creative Commons Attribution-NonCommercial 4.0 International License).
- ↑ a b c d e Christian Matschei: Seltene Tiere im Zoo - Säugetiere. Schüling Verlag, Münster 2017, ISBN 978-3-86523-288-5, hier S. 52.
- ↑ a b c d e f g h Peter Dollinger: Rinder und Waldböcke: Bison. In: zootier-lexikon.org (Peter Dollingers Zootier-Lexikon: Peter Dollinger, Zoo Office Bern). 26. Februar 2023, abgerufen am 3. Februar 2024.
- ↑ Daniel M. Ashe: Endangered and Threatened Wildlife and Plants; Reclassifying the Wood Bison Under the Endangered Species Act as Threatened Throughout Its Range. 50 CFR Part 17; Docket No. FWS–R9–IA–2008–0123; FXES111309F2120D2–123–FF09E22000; RIN 1018–AI83. In: Department of the Interior: Fish and Wildlife Service (Hrsg.): federalregister.gov. Band 77, Nr. 86, 3. Mai 2012, S. 26191–26212 (govinfo.gov [PDF] Dated: April 24, 2012; FR Doc. 2012–10635; Filed 5–2–12; 8:45 am; BILLING CODE 4310–55–P). Auch verfügbar als: Endangered and Threatened Wildlife and Plants; Reclassifying the Wood Bison Under the Endangered Species Act as Threatened Throughout Its Range. A Rule by the Fish and Wildlife Service on 05/03/2012. In: federalregister.gov. 5. März 2012, abgerufen am 1. Februar 2024 (Agencies: Department of the Interior, Fish and Wildlife Service; Effective Date: 06/04/2012; Document Citation: 77 FR 26191; Page: 26191-26212 (22 pages); CFR: 50 CFR 17; Agency/Docket Numbers: Docket No. FWS-R9-IA-2008-0123, FXES111309F2120D2-123-FF09E22000; RIN: 1018-AI83; Document Number: 2012-10635): „During the early 1800s, wood bison numbers were estimated at 168,000, but by the late 1800s, the subspecies was nearly eliminated, with only a few hundred remaining (Gates al. 2001, p. 11). In the words of Soper (1941, p. 362), wood “bison appear to have been practically exterminated,”“
- ↑ J. Dewey Soper: History, Range, and Home Life of the Northern Bison. In: Ecological Monographs. Band 11, Nr. 4, Oktober 1941, S. 347–412, doi:10.2307/1943298, JSTOR:1943298: „The notable point is that the bison appear to have been practically exterminated south of the Peace by about 1875, with the exception of a number in the Birch Mountain sector, and possibly a few in the foothills of the Rockies. But at this same time, [...] they were still plentiful between Dunvegan and Great Slave Lake. Yet in the brief 16 years which followed, the decline was so rapid that only an estimated 300 is all that remained in the entire region.“
- ↑ Brian Bergman: Macleans: Bison Back from Brink of Extinction. In: thecanadianencyclopedia.ca. 23. März 2004, abgerufen am 2. Februar 2024 (Update vom 15. Dezember 2013; Ursprüngliche Veröffentlichung im Maclean’s am 16. Februar 2004.).
- ↑ a b c d e f Diether Zscheile, Karin Zscheile: Zootierhaltung: Säugetiere. Begründet von W. Puschmann, fortgeführt und neu bearbeitet von D. Zscheile und K. Zscheile. 6. Auflage. Verlag Europa-Lehrmittel (Edition Harri Deutsch), Haan-Gruiten 2018, ISBN 978-3-8085-5745-7, hier S. 817 f..
- ↑ Douglas Main: Wood Bison Will Return to Alaskan Wilds This Week. In: newsweek.com. 31. März 2015, abgerufen am 30. Januar 2024.
- ↑ a b c Wood Bison Restoration. Reintroduction of Wood Bison back to their natural habitat. In: alaskawildlife.org. 2022, abgerufen am 1. Februar 2024.
- ↑ Wood Bison Restoration. Reintroduction of Wood Bison back to their natural habitat. In: alaskawildlife.org. 2022, abgerufen am 1. Februar 2024: „1941: Wood Bison declared extinct.“
- ↑ a b Klaus Böhme: Die sanften Riesen – Ausgerottet und doch gerettet: Geschichte, Gegenwart und Zukunft des Wisents: Teil I (Einleitung, Paläontologie und Taxonomie). In: schweizerjaeger.ch. Band 98, Nr. 98, September 2013, ISSN 0036-8016, S. 24–29 (schweizerjaeger.ch [PDF; abgerufen am 2. Februar 2024]): „Der Bestand dieser Tiere galt trotz – ebenfalls gerade noch rechtzeitiger – Rettung der geringen Restbestände und der bereits im Jahre 1915 erfolgten Ausweisung ihres Rückzugsareals zwischen dem Great Slave Lake und dem Athabasca Lake als Schutzgebiet «Wood Buffalo Park» im Jahre 1940 als erloschen.“
- ↑ Klaus Böhme: Die sanften Riesen – Ausgerottet und doch gerettet: Geschichte, Gegenwart und Zukunft des Wisents: Teil I (Einleitung, Paläontologie und Taxonomie). In: schweizerjaeger.ch. Band 98, Nr. 98, September 2013, ISSN 0036-8016, S. 24–29 (schweizerjaeger.ch [PDF; abgerufen am 2. Februar 2024]).
- ↑ a b c d C. Cormack Gates, Curtis H. Freese, Peter J. P. Gogan, Mandy Kotzman (Hrsg.): American bison: status survey and conservation guidelines 2010. IUCN, Gland 2010, ISBN 978-2-8317-1149-2, hier S. 22 (englisch, xviii + 134 Seiten, portals.iucn.org [PDF; abgerufen am 2. Februar 2024] IUCN: IUCN Species Survival Commission (SSC), Bison Specialist Group).
- ↑ a b c Cuora yunnanensis in der Roten Liste gefährdeter Arten der IUCN 2010. Eingestellt von: van Dijk, P.P., Blanck, T. & Lau, M., 2009. Abgerufen am 13. Mai 2022.
- ↑ a b Evelyn L. Jensen, Stephen J. Gaughran, Nicole A. Fusco, Nikos Poulakakis, Washington Tapia, Christian Sevilla, Jeffreys Málaga, Carol Mariani, James P. Gibbs, Adalgisa Caccone: The Galapagos giant tortoise Chelonoidis phantasticus is not extinct. In: Communications Biology. Band 5, 2022, 546, doi:10.1038/s42003-022-03483-w.
- ↑ Galápagos-Inseln: Vermeintlich ausgestorbene Riesenschildkröte lebt. Chelonoidis phantasticus galt seit mehr als hundert Jahren als ausgestorben. Nun soll ein Weibchen auf der Galápagos-Insel Fernandina gesichtet worden sein. In: zeit.de. 20. Februar 2019, abgerufen am 26. Dezember 2023.
- ↑ a b c d Chelonoidis phantasticus in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: Rhodin, A.G.J., Gibbs, J.P., Cayot, L.J., Kiester, A.R. & Tapia, W., 2015. Abgerufen am 13. Mai 2022.
- ↑ a b Original in englischer Sprache: Jill Langlois: How an ‘extinct’ tortoise was rediscovered after a century. The Fernandina giant tortoise disappeared more than 100 years ago. Now there is hope its population could return. In: nationalgeographic.com. 22. Februar 2019, abgerufen am 24. Dezember 2023. Deutschsprachige Fassung: Jill Langlois: 100 Jahre ausgestorben: Comeback einer Galapagos-Schildkröte. Seit 1906 war kein lebendes Exemplar der Fernandinha-Riesenschildkröte mehr gesehen worden. In: nationalgeographic.de. 26. Februar 2019, abgerufen am 13. Mai 2022 (Ursprünglich in englischer Sprache publiziert auf NationalGeographic.com).
- ↑ Gallotia auaritae in der Roten Liste gefährdeter Arten der IUCN 2009. Eingestellt von: Jose Antonio Mateo Miras, Iñigo Martínez-Solano, 2008. Abgerufen am 16. Mai 2022.
- ↑ Gallotia simonyi in der Roten Liste gefährdeter Arten der IUCN 2009. Eingestellt von: Jose Antonio Mateo Miras, Valentin Pérez-Mellado, Iñigo Martínez-Solano, 2008. Abgerufen am 21. Mai 2022.
- ↑ a b c d e f g Cyclura collei in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: Grant, T.D. & Pasachnik, S.A., 2021. Abgerufen am 14. Mai 2022.
- ↑ a b c Evžen Kůs, Václav Pfleger: Seltene und bedrohte Tiere: Die große farbige Enzyklopädie. Gondrom, Bindlach 2001, ISBN 3-8112-1830-1, S. 117.
- ↑ Contomastix vittata in der Roten Liste gefährdeter Arten der IUCN.
- ↑ Anolis proboscis in der Roten Liste gefährdeter Arten der IUCN 2019. Eingestellt von: Arteaga-Navarro, A., Mayer, G.C., Poe, S. & Cisneros-Heredia, D.F., 2014. Abgerufen am 23. Mai 2022.
- ↑ a b Adenomus kandianus in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2020. Abgerufen am 5. Januar 2024.
- ↑ a b Allobates humilis in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: La Marca, E., 2020. Abgerufen am 5. Januar 2024.
- ↑ a b Alsodes montanus in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2015. Abgerufen am 5. Januar 2024.
- ↑ a b Ameerega boliviana in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 5. Januar 2024.
- ↑ Ameerega planipaleae in der Roten Liste gefährdeter Arten der IUCN 2019. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2017. Abgerufen am 2024-01-0&.
- ↑ a b Anaxyrus baxteri in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2020. Abgerufen am 5. Januar 2024.
- ↑ a b c Ghatophryne ornata in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2020. Abgerufen am 5. Januar 2024.
- ↑ Atelopus bomolochos in der Roten Liste gefährdeter Arten der IUCN 2019. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2016. Abgerufen am 2024-01-0&.
- ↑ a b Atelopus carrikeri in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2016. Abgerufen am 5. Januar 2024.
- ↑ a b Atelopus cruciger in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: Lampo, M., Señaris, J.C. & Ballestas, O., 2019. Abgerufen am 5. Januar 2024.
- ↑ a b Atelopus ebenoides in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2017. Abgerufen am 6. Januar 2024.
- ↑ a b Atelopus eusebianus in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2016. Abgerufen am 6. Januar 2024.
- ↑ Atelopus laetissimus in der Roten Liste gefährdeter Arten der IUCN 2014. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2014. Abgerufen am 6. Januar 2024.
- ↑ Atelopus mucubajiensis in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: La Marca, E., 2020. Abgerufen am 6. Januar 2024.
- ↑ Atelopus nahumae in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2016. Abgerufen am 6. Januar 2024.
- ↑ Anderssons Stummelfußkröte. In: stiftung-artenschutz.de. Abgerufen am 6. Januar 2024.
- ↑ Atelopus palmatus in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2016. Abgerufen am 6. Januar 2024.
- ↑ a b Atelopus seminiferus in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2017. Abgerufen am 6. Januar 2024.
- ↑ a b Atelopus varius in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ a b Austrochaperina brevipes in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ Austrochaperina yelaensis in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ a b Barbourula busuangensis in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2017. Abgerufen am 6. Januar 2024.
- ↑ Barbourula kalimantanensis in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2017. Abgerufen am 6. Januar 2024.
- ↑ a b Bolitoglossa capitana in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2016. Abgerufen am 6. Januar 2024.
- ↑ a b Boophis williamsi in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2015. Abgerufen am 6. Januar 2024.
- ↑ a b Bradytriton silus in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ a b c Duttaphrynus sumatranus in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2017. Abgerufen am 6. Januar 2024.
- ↑ a b Glyphoglossus volzi in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2017. Abgerufen am 6. Januar 2024.
- ↑ a b c Arthroleptis aureoli in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2018. Abgerufen am 6. Januar 2024.
- ↑ a b c Chirixalus simus in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2021. Abgerufen am 6. Januar 2024.
- ↑ a b Chiropterotriton magnipes in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ a b Conraua derooi in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2020. Abgerufen am 6. Januar 2024.
- ↑ Craugastor gulosus in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group & NatureServe, 2019. Abgerufen am 6. Januar 2024.
- ↑ a b Craugastor milesi in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ a b Dendropsophus ruschii in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: IUCN SSC Amphibian Specialist Group & Instituto Boitatá de Etnobiologia e Conservação da Fauna, 2021. Abgerufen am 6. Januar 2024.
- ↑ a b Dendrotriton cuchumatanus in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ a b Eleutherodactylus cubanus in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2020. Abgerufen am 6. Januar 2024.
- ↑ a b Eleutherodactylus turquinensis in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2020. Abgerufen am 6. Januar 2024.
- ↑ a b Excidobates captivus in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2017. Abgerufen am 6. Januar 2024.
- ↑ Excidobates mysteriosus in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2017. Abgerufen am 6. Januar 2024.
- ↑ a b Gastrotheca splendens in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ a b Gegeneophis seshachari in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2020. Abgerufen am 6. Januar 2024.
- ↑ a b Holoaden luederwaldti in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: IUCN SSC Amphibian Specialist Group & Instituto Boitatá de Etnobiologia e Conservação da Fauna, 2021. Abgerufen am 6. Januar 2024.
- ↑ a b Hyalinobatrachium talamancae in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ a b Sanguirana igorota in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2018. Abgerufen am 6. Januar 2024.
- ↑ Hyloscirtus charazani in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ a b c Stereocyclops histrio in der Roten Liste gefährdeter Arten der IUCN 2023. Abgerufen am 6. Januar 2024.
- ↑ a b Boana melanopleura in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2017. Abgerufen am 6. Januar 2024.
- ↑ a b c d Ichthyophis hypocyaneus in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2017. Abgerufen am 6. Januar 2024.
- ↑ a b Incilius cristatus in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ a b Isthmohyla rivularis in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ a b c Leptobrachella lateralis in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2020. Abgerufen am 6. Januar 2024.
- ↑ a b Kurixalus naso in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2020. Abgerufen am 6. Januar 2024.
- ↑ a b Lithobates onca in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2021. Abgerufen am 6. Januar 2024.
- ↑ a b Lithobates sevosus in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2021. Abgerufen am 6. Januar 2024.
- ↑ a b Lithobates vibicarius in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ Litoria aurea in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2021. Abgerufen am 6. Januar 2024.
- ↑ a b Litoria castanea in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2021. Abgerufen am 6. Januar 2024.
- ↑ a b Litoria dorsalis in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ a b Litoria leucova in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ a b Litoria lorica in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2021. Abgerufen am 6. Januar 2024.
- ↑ a b Liuixalus romeri in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ Mantella manery in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2017. Abgerufen am 6. Januar 2024.
- ↑ a b Mantidactylus pauliani in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2016. Abgerufen am 6. Januar 2024.
- ↑ a b Melanobatrachus indicus in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2020. Abgerufen am 6. Januar 2024.
- ↑ a b Melanophryniscus macrogranulosus in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: Instituto Boitatá de Etnobiologia e Conservação da Fauna & IUCN SSC Amphibian Specialist Group, 2021. Abgerufen am 6. Januar 2024.
- ↑ a b Melanophryniscus pachyrhynus in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2020. Abgerufen am 6. Januar 2024.
- ↑ a b Micrixalus kottigeharensis in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2021. Abgerufen am 6. Januar 2024.
- ↑ a b c Nanorana aenea in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2017. Abgerufen am 6. Januar 2024.
- ↑ a b c Nimbaphrynoides occidentalis in der Roten Liste gefährdeter Arten der IUCN 2014. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2012. Abgerufen am 6. Januar 2024.
- ↑ a b Nyctixalus margaritifer in der Roten Liste gefährdeter Arten der IUCN 2018. Abgerufen am 6. Januar 2024.
- ↑ Oreobates granulosus in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2017. Abgerufen am 6. Januar 2024.
- ↑ a b Oreobates heterodactylus in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: IUCN SSC Amphibian Specialist Group & Instituto Boitatá de Etnobiologia e Conservação da Fauna, 2020. Abgerufen am 6. Januar 2024.
- ↑ a b Oreophryne insulana in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ a b Oscaecilia osae in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ a b Paratelmatobius gaigeae in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: IUCN SSC Amphibian Specialist Group & Instituto Boitatá de Etnobiologia e Conservação da Fauna, 2021. Abgerufen am 6. Januar 2024.
- ↑ Paratelmatobius mantiqueira in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: IUCN SSC Amphibian Specialist Group & Instituto Boitatá de Etnobiologia e Conservação da Fauna, 2021. Abgerufen am 6. Januar 2024.
- ↑ a b Peltophryne lemur in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2020. Abgerufen am 6. Januar 2024.
- ↑ a b c Raorchestes chalazodes in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2021. Abgerufen am 6. Januar 2024.
- ↑ a b c d e Pseudophilautus stellatus in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2020. Abgerufen am 6. Januar 2024.
- ↑ a b c Raorchestes travancoricus in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2021. Abgerufen am 6. Januar 2024.
- ↑ a b Phrynopus peruanus in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2017. Abgerufen am 6. Januar 2024.
- ↑ Phyllodytes wuchereri in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: IUCN SSC Amphibian Specialist Group & Instituto Boitatá de Etnobiologia e Conservação da Fauna, 2021. Abgerufen am 6. Januar 2024.
- ↑ Platymantis cornutus in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2017. Abgerufen am 6. Januar 2024.
- ↑ a b Platymantis hazelae in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2017. Abgerufen am 6. Januar 2024.
- ↑ a b Plethodon neomexicanus in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2021. Abgerufen am 6. Januar 2024.
- ↑ a b Pseudohynobius puxiongensis in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ a b c Ixalotriton niger in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2016. Abgerufen am 6. Januar 2024.
- ↑ a b Pseudoeurycea nigromaculata in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ a b c Ixalotriton parvus in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2014. Abgerufen am 6. Januar 2024.
- ↑ a b Rhacophorus bifasciatus in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2017. Abgerufen am 6. Januar 2024.
- ↑ a b Rhacophorus lateralis in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2020. Abgerufen am 6. Januar 2024.
- ↑ a b Rhacophorus poecilonotus in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2017. Abgerufen am 6. Januar 2024.
- ↑ a b Dendrophryniscus proboscideus in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: IUCN SSC Amphibian Specialist Group & Instituto Boitatá de Etnobiologia e Conservação da Fauna, 2021. Abgerufen am 6. Januar 2024.
- ↑ Rhinella leptoscelis in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ a b Sphaenorhynchus pauloalvini in der Roten Liste gefährdeter Arten der IUCN 2023. Eingestellt von: IUCN SSC Amphibian Specialist Group & Instituto Boitatá de Etnobiologia e Conservação da Fauna, 2021. Abgerufen am 6. Januar 2024.
- ↑ a b Taudactylus acutirostris in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2021. Abgerufen am 6. Januar 2024.
- ↑ a b Taudactylus eungellensis in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2021. Abgerufen am 6. Januar 2024.
- ↑ a b Taudactylus rheophilus in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2021. Abgerufen am 6. Januar 2024.
- ↑ Telmatobius gigas in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ a b Telmatobufo venustus in der Roten Liste gefährdeter Arten der IUCN 2015. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2015. Abgerufen am 6. Januar 2024.
- ↑ a b Thorius magnipes in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 6. Januar 2024.
- ↑ a b Thorius minutissimus in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2015. Abgerufen am 6. Januar 2024.
- ↑ a b c Adenomus kandianus in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2012. Abgerufen am 15. Dezember 2023.
- ↑ Adenomus kandianus in der Roten Liste gefährdeter Arten der IUCN.
- ↑ Extinct toad rediscovered after hiding for 133 years in Sri Lanka
- ↑ Craugastor escoces in der Roten Liste gefährdeter Arten der IUCN.
- ↑ Heredia Robber Frog rediscovered – Craugastor escoces
- ↑ a b Craugastor escoces in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 15. Dezember 2023.
- ↑ Atelopus balios in der Roten Liste gefährdeter Arten der IUCN.
- ↑ Atelopus coynei in der Roten Liste gefährdeter Arten der IUCN.
- ↑ My frog is ALIVE! – Atelopus coynei
- ↑ a b c Atelopus ignescens in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2016. Abgerufen am 10. Dezember 2023.
- ↑ Boy finds ‘extinct’ frog in Ecuador and helps revive species
- ↑ a b Hyperolius nimbae in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2016. Abgerufen am 10. Januar 2024.
- ↑ a b Richard Black: 'Lost' frogs found after decades. In: bbc.com. 22. September 2010, abgerufen am 30. Dezember 2023.
- ↑ a b c d Özgün Emre Can, Neil D’Cruze: Cognitive biases can play a role in extinction assessments: The case of the Caspian tiger. In: Frontiers in Ecology and Evolution. Band 10, 2022, 1050191, Table 1. A selection of species from the literature which were prematurely considered extinct resulting in missed conservation opportunities, doi:10.3389/fevo.2022.1050191 (Veröffentlicht am 10. Januar 2023; Lizenz: CC BY 4.0 Deed Attribution 4.0 International).
- ↑ Incilius holdridgei in der Roten Liste gefährdeter Arten der IUCN.
- ↑ Reconsidering Extinction: Rediscovery of Incilius holdridgei (Anura: Bufonidae) in Costa Rica After 25 Years – Incilius holdridgei
- ↑ Zafrir Rinat: Long Thought Extinct, Hula Painted Frog Found Once Again in Israeli Nature Reserve. Rare find is akin to the Dead Sea Scrolls of nature conservation. In: haaretz.com. 17. November 2011, abgerufen am 16. Mai 2022.
- ↑ Latonia nigriventer in der Roten Liste gefährdeter Arten der IUCN 2021. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2020. Abgerufen am 16. Mai 2022.
- ↑ a b c Pseudophilautus hypomelas in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2020. Abgerufen am 11. Dezember 2023.
- ↑ Pseudophilautus hypomelas in der Roten Liste gefährdeter Arten der IUCN.
- ↑ Not seen in over 130 years, ‘extinct’ frog rediscovered in Sri Lanka
- ↑ Pseudophilautus stellatus in der Roten Liste gefährdeter Arten der IUCN.
- ↑ Starry frog rediscovered after thought extinct for 160 years (photos)
- ↑ Ambystoma leorae in der Roten Liste gefährdeter Arten der IUCN.
- ↑ Observaciones – Ambystoma leorae. iNaturalist, abgerufen am 13. Januar 2019 (spanisch).
- ↑ a b c d Bolitoglossa jacksoni in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2019. Abgerufen am 15. Januar 2024.
- ↑ a b c Lindsay Renick Mayer: FOUND: Remarkable Salamander Rediscovery Heralds Early Success For Worldwide Quest To Find And Protect Lost Species. In: rewild.org. 30. Oktober 2017, abgerufen am 15. Januar 2024.
- ↑ a b Shreya Dasgupta: Brilliantly colored ‘lost’ salamander rediscovered after 42 years. In: news.mongabay.com. 1. November 2017, abgerufen am 15. Januar 2024.
- ↑ a b c d Jackson’s Climbing Salamander. In: rewild.org. Abgerufen am 15. Januar 2024.
- ↑ a b Jason Bittel: „Goldenes Wunder“ nach 42 Jahren wiederentdeckt. Das mysteriöse Amphibium wurde erst drei Mal gesichtet. In: nationalgeographic.de. 17. November 2017, abgerufen am 15. Januar 2024.
- ↑ Salamanders Lost, Salamanders Found, Salamanders Saved. In: rewild.org. Abgerufen am 15. Januar 2024.
- ↑ a b Chiropterotriton mosaueri in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2014. Abgerufen am 10. Januar 2024.
- ↑ Entosphenus minimus in der Roten Liste gefährdeter Arten der IUCN.
- ↑ a b Robert R. Miller, James D. Williams, Jack E. Williams: Extinctions of North American Fishes During the Past Century. (PDF) Fisheries 14 (6), 1989, S. 22–38, abgerufen am 6. Januar 2019.
- ↑ a b H. R. Akçakaya, David A. Keith, Mark Burgman, Stuart H.M. Butchart, Michael Hoffmann, Helen M.Regan, Ian Harrison, Elizabeth Boakes: Inferring extinctions III: A cost-benefit framework for listing extinct species. In: Biological Conservation. Band 214, Oktober 2017, S. 336–342, doi:10.1016/j.biocon.2017.07.027. Dort mit Verweis auf: Robert R. Miller, James D. Williams, Jack E. Williams: Extinctions of North American Fishes During the past Century. In: Fisheries. Band 14, Nr. 6, 1989, S. 22–38, doi:10.1577/1548-8446(1989)014<0022:EONAFD>2.0.CO;2.
- ↑ a b c d Robert R. Miller, James D. Williams, Jack E. Williams: Extinctions of North American Fishes During the past Century. In: Fisheries. Band 14, Nr. 6, 1989, S. 22–38, doi:10.1577/1548-8446(1989)014<0022:EONAFD>2.0.CO;2.
- ↑ Cyprinodon radiosus in der Roten Liste gefährdeter Arten der IUCN 2013. Eingestellt von: NatureServe, 2011. Abgerufen am 8. Mai 2022.
- ↑ K. Breitfeld, W. E. Engelmann: 43 Ordnung Zahnkärpflingsartige (Cyprinodontiformes). In: Wolf-Eberhard Engelmann (Hrsg.): Zootierhaltung: Tiere in menschlicher Obhut: Fische. 1. Auflage. Harri Deutsch, Frankfurt am Main 2005, ISBN 3-8171-1352-8, S. 477–504, hier S. 486.
- ↑ Carcharhinus hemiodon in der Roten Liste gefährdeter Arten der IUCN.
- ↑ Malaka Rodrigo: ‘Extinct’ shark spotted in Menik Ganga. In: The Sunday Times vom 14. Februar 2016.
- ↑ Notropis amecae in der Roten Liste gefährdeter Arten der IUCN.
- ↑ Zoogoneticus tequila. Goodeid Working Group, abgerufen am 6. Januar 2019.
- ↑ Mexico Fish Ark Project. Chester Zoo, abgerufen am 6. Januar 2019.
- ↑ Gobius tigrellus in der Roten Liste gefährdeter Arten der IUCN.
- ↑ Helen Larson: Review of the gobiid fish genera Eugnathogobius and Pseudogobiopsis (Gobioidei: Gobiidae: Gobionellinae), with descriptions of three new species. The Raffles Bulletin of Zoology 57 (1), 2009, S. 127–181, abgerufen am 6. Januar 2019.
- ↑ Ptychochromoides itasy in der Roten Liste gefährdeter Arten der IUCN.
- ↑ Helen Larson: Mad Fishes 2010. Toronto Zoo, abgerufen am 6. Januar 2019.
- ↑ H. R. Akçakaya, David A. Keith, Mark Burgman, Stuart H.M. Butchart, Michael Hoffmann, Helen M.Regan, Ian Harrison, Elizabeth Boakes: Inferring extinctions III: A cost-benefit framework for listing extinct species. In: Biological Conservation. Band 214, Oktober 2017, S. 336–342, doi:10.1016/j.biocon.2017.07.027. Dort mit Verweis auf: Brian Zimmerman: In search of the Mangarahara cichlid. In: Newsletter of the IUCN SSC/WI Freshwater Fish Specialist Group. 4 (Saving Freshwater Fishes and Habitats), März 2014, S. 17–22 (http://www.iucnffsg.org/wp-content/uploads/2013/05/ FFSG-Newsletter-March-2014-Small.pdf [PDF]).
- ↑ Ptychochromis insolitus in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Ravelomanana, T., Sparks, J.S. & Loiselle, P.V., 2016. Abgerufen am 19. Mai 2022.
- ↑ Rheocles pellegrini in der Roten Liste gefährdeter Arten der IUCN.
- ↑ Salvelinus profundus in der Roten Liste gefährdeter Arten der IUCN.
- ↑ Eawag: Überraschendes aus den Tiefen der Schweizer Seen, 9. Januar 2019.
- ↑ Siphateles bicolor in der Roten Liste gefährdeter Arten der IUCN.
- ↑ Siphateles bicolor isolata
- ↑ Telestes ukliva in der Roten Liste gefährdeter Arten der IUCN.
- ↑ D. Zanella, M. Mrakovčić, P. Mustafić, M. Ćaleta: Recovery of Telestes ukliva, an endemic species from the Cetina River, Croatia (Cypriniformes, Cyprinidae). Journal of Fish Biology 73 (1), 2008, S. 311–316, abgerufen am 13. Januar 2019.
- ↑ a b Rudie H. Kuiter: Hippocampus tristis, a Lazarus species of seahorse (Teleostei: Syngnathidae) from Australia. In: Journal of the Ocean Science Foundation. Band 35, 2020, S. 41–47, doi:10.5281/zenodo.3905279.
- ↑ Hippocampus tristis Lazarus - Seepferdchen. In: meerwasser-lexikon.de. 28. Juli 2020, abgerufen am 5. Dezember 2023.
- ↑ Xylotoles costatus in der Roten Liste gefährdeter Arten der IUCN 2004. Eingestellt von: McGuinness, C.A., 2004. Abgerufen am 22. Mai 2022.
- ↑ a b c d e Dryococelus australis in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: Rudolf, E. & Brock, P., 2017. Abgerufen am 21. Mai 2022.
- ↑ a b c Justin Gerlach, Scott Hoffman Black, Axel Hochkirch, Sarina Jepsen, Mary Seddon, Sacha Spector, Paul Williams: Chapter 4: Terrestrial invertebrate life. In: Ben Collen, Monika Böhm, Rachael Kemp, Jonathan E. M. Baillie (Hrsg.): Spineless: Status and Trends of the World’s Invertebrates. Zoological Society of London, London 2012, ISBN 978-0-900881-68-8, S. 46–57 (https://portals.iucn.org/library/sites/library/files/documents/2012-064.pdf PDF).
- ↑ a b c d Daniel Martín-Vega, Arturo Baz, Verner Michelsen: Back from the dead: Thyreophora cynophila (Panzer, 1798) (Diptera: Piophilidae) ‘globally extinct’ fugitive in Spain. In: Systematic Entomology. Band 35, Nr. 4, Oktober 2010, S. 607–613, doi:10.1111/j.1365-3113.2010.00541.x.
- ↑ Rowan Hooper: Zoologger: Horror fly returns from the dead. In: newscientist.com. 22. September 2010, abgerufen am 22. Mai 2022 (englisch).
- ↑ a b Megachile pluto in der Roten Liste gefährdeter Arten der IUCN 2014. Eingestellt von: Kuhlmann, M., 2013. Abgerufen am 22. Mai 2022.
- ↑ a b Ruby Prosser Scully: World’s biggest bee rediscovered after decades on ‘most wanted’ list. In: newscientist.com. 21. Februar 2019, abgerufen am 22. Mai 2022 (englisch).
- ↑ Clay Bolt: Rediscovering Wallace’s Giant Bee. In: rewild.org. 22. Februar 2019, abgerufen am 22. Mai 2022 (englisch).
- ↑ Daniel Lingenhöhl: Bienengigant nach 38 Jahren wiederentdeckt. Neben Wallaces Riesenbiene wirkt unsere Honigbiene wie ein Zwerg. Doch seit 1981 hatte niemand mehr diesen Giganten gesehen - bis jetzt. In: spektrum.de. 21. Februar 2019, abgerufen am 22. Mai 2022.
- ↑ J.B. Dorey. 2021. Missing for almost 100 years: the rare and potentially threatened bee, Pharohylaeus lactiferus (Hymenoptera, Colletidae). Journal of Hymenoptera Research 81: 165-180; doi:10.3897/jhr.81.59365
- ↑ a b Rhachistia aldabrae in der Roten Liste gefährdeter Arten der IUCN 2018. Eingestellt von: Gerlach, J., 2017. Abgerufen am 22. Mai 2022.
- ↑ John W. Wilson, Richard B. Primack: Conservation Biology in Sub-Saharan Africa. Open Book Publishers, Cambridge, UK 2019, ISBN 978-1-78374-751-1, Chapter 6: Our Warming World, S. 167–202, hier S. 182 f., Fig 6.5, doi:10.11647/OBP.0177.08 (Lizenz: Creative Commons Attribution 4.0 International license (CC BY 4.0)).
- ↑ John W. Wilson, Richard B. Primack: Conservation Biology in Sub-Saharan Africa. Open Book Publishers, Cambridge, UK 2019, ISBN 978-1-78374-751-1, Chapter 6: Our Warming World, S. 167–202, hier S. 182 f., doi:10.11647/OBP.0177.08 (Lizenz: Creative Commons Attribution 4.0 International license (CC BY 4.0)).
- ↑ Leptoxis compacta in der Roten Liste gefährdeter Arten der IUCN 2000. Eingestellt von: Bogan, A.E. (Mollusc Specialist Group), 2000. Abgerufen am 22. Mai 2022.
- ↑ Nathan V. Whelan, Paul D. Johnson, Phil M. Harris: Rediscovery of Leptoxis compacta (Anthony, 1854) (Gastropoda: Cerithioidea: Pleuroceridae). In: PLoS ONE. Band 7, Nr. 8, 2012, 42499, doi:10.1371/journal.pone.0042499 (Vollständige Artikel-Nr.: e42499).
- ↑ a b Littoraria flammea in der Roten Liste gefährdeter Arten der IUCN 1996. Eingestellt von: Bouchet, P., 1996. Abgerufen am 6. Dezember 2023.
- ↑ a b c d e f g h i j k l m n James T. Carlton: Marine Invertebrate Neoextinctions: An Update and Call for Inventories of Globally Missing Species. In: Diversity. Band 15, 6 (Special Issue: Marine Nearshore Biodiversity), 2023, S. 782 (12 pp.), doi:10.3390/d15060782.
- ↑ a b c James T. Carlton, Jonathan B. Geller, Marjorie L. Reaka-Kudla, Elliott A. Norse: Historical Extinctions in the Sea. In: Annual Review of Ecology and Systematics. Band 30, 1999, S. 515–538, doi:10.1146/annurev.ecolsys.30.1.515.
- ↑ Collisella edmitchelli in der Roten Liste gefährdeter Arten der IUCN 1996. Eingestellt von: Bouchet, P., 1996. Abgerufen am 6. Dezember 2023.
- ↑ James T. Carlton: Neoextinctions of Marine Invertebrates. In: American Zoologist. Band 33, Nr. 6, 1993, S. 499–509, doi:10.1093/icb/33.6.499, JSTOR:883715.
- ↑ a b c Omphalotropis plicosa in der Roten Liste gefährdeter Arten der IUCN 1996. Eingestellt von: Griffiths, O., 1996. Abgerufen am 6. Dezember 2023.
- ↑ a b F. B. V. Florens, C. Baider: Relocation of Omphalotropis plicosa (Pfeiffer, 1852), a Mauritian endemic landsnail believed extinct. In: Journal of Molluscan Studies. Band 73, Nr. 2, 2007, S. 205–206, doi:10.1093/mollus/eym004.
- ↑ a b c Rachael Kemp, Howard Peters, Louise Allcock, Kent Carpenter, David Obura, Beth Polidoro, Nadia Richman: Chapter 3: Marine invertebrate life. In: Ben Collen, Monika Böhm, Rachael Kemp, Jonathan E. M. Baillie (Hrsg.): Spineless: Status and Trends of the World’s Invertebrates. Zoological Society of London, London 2012, ISBN 978-0-900881-68-8, S. 34–44 (https://portals.iucn.org/library/sites/library/files/documents/2012-064.pdf PDF).
- ↑ Lisa-ann Gershwin, Wolfgang Zeidler, Peter J. F. Davie: Medusae (Cnidaria) of Moreton Bay, Queensland, Australia. In: Memoirs of the Queensland Museum. Band 54, Nr. 3, 30. Dezember 2010, ISSN 0079-8835, S. 47–108 (In: P. J. F. Davie, J. A. Phillips (Hrsg.): Proceedings of the Thirteenth International Marine Biological Workshop, the Marine Fauna and Flora of Moreton Bay, Queensland.).
- ↑ Diana O. Fisher, Simon P. Blomberg: Correlates of rediscovery and the detectability of extinction in mammals. Rediscovery bias in mammals. In: Proceedings of the Royal Society B: Biological Sciences. Band 278, Nr. 1708, April 2011, S. 1090–1097, doi:10.1098/rspb.2010.1579 (Online publiziert am 29. September 2010). Dort mit Verweis auf: David A. Keith, Mark A. Burgman: The Lazarus effect: can the dynamics of extinct species lists tell us anything about the status of biodiversity? In: Biological Conservation. Band 117, Nr. 1, Mai 2004, S. 41–48, doi:10.1016/S0006-3207(03)00261-1.
- ↑ David A. Keith, Mark A. Burgman: The Lazarus effect: can the dynamics of extinct species lists tell us anything about the status of biodiversity? In: Biological Conservation. Band 117, Nr. 1, Mai 2004, S. 41–48, hier S. 45, Table 2 ("Reasons for additions and deletions to lists of extinct Australian species of vascular plants."), doi:10.1016/S0006-3207(03)00261-1.
- ↑ a b Medusagyne oppositifolia in der Roten Liste gefährdeter Arten der IUCN 2011. Eingestellt von: Matatiken, D., Huber, M.J. & Ismail, S., 2007. Abgerufen am 5. November 2023.
- ↑ a b John W. Wilson, Richard B. Primack: Conservation Biology in Sub-Saharan Africa. Open Book Publishers, Cambridge, UK 2019, ISBN 978-1-78374-751-1, Chapter 2: Introduction to Sub-Saharan Africa, S. 23–60, hier S. 28, doi:10.11647/OBP.0177.08 (Lizenz: Creative Commons Attribution 4.0 International license (CC BY 4.0)).
- ↑ Bulbostylis neglecta in der Roten Liste gefährdeter Arten der IUCN 2016. Eingestellt von: Lambdon, P.W. & Ellick, S., 2015. Abgerufen am 6. November 2023.
- ↑ a b H. R. Akçakaya, David A. Keith, Mark Burgman, Stuart H.M. Butchart, Michael Hoffmann, Helen M.Regan, Ian Harrison, Elizabeth Boakes: Inferring extinctions III: A cost-benefit framework for listing extinct species. In: Biological Conservation. Band 214, Oktober 2017, S. 336–342, doi:10.1016/j.biocon.2017.07.027. Dort mit Verweis auf: J. H. Leigh, R. Boden, J. D. Briggs: Extinct and Endangered Plants. World Wildlife Fund MacMillan, Melbourne 1984.
- ↑ H. R. Akçakaya, David A. Keith, Mark Burgman, Stuart H.M. Butchart, Michael Hoffmann, Helen M.Regan, Ian Harrison, Elizabeth Boakes: Inferring extinctions III: A cost-benefit framework for listing extinct species. In: Biological Conservation. Band 214, Oktober 2017, S. 336–342, doi:10.1016/j.biocon.2017.07.027. Dort mit Verweis auf: Robin Moore: In Search of Lost Frogs: The Quest to Find the world’s Rarest Amphibians. Bloomsbury Natural History, 2014, ISBN 978-1-4081-8633-6, S. 256.
- ↑ a b Threatened Species Listing Statement: Davies' wax flower, Phebalium daviesii Hook.f 1859. (PDF (4 Seiten)) In: nre.tas.gov.au. Oktober 2001, abgerufen am 10. Dezember 2023.
- ↑ a b c d e f Stephen S. Nyandoro, Joan J. E. Munissi, Msim Kombo, Clarence A. Mgina, Fangfang Pan, Amra Gruhonjic, Paul Fitzpatrick, Yu Lu, Bin Wang, Kari Rissanen, Máté Erdélyi: Flavonoids from Erythrina schliebenii. In: Journal of Natural Products. Band 80, Nr. 2, 23. Januar 2017, S. 377–383, doi:10.1021/acs.jnatprod.6b00839.
- ↑ a b c d Erythrina schliebenii in der Roten Liste gefährdeter Arten der IUCN 2012. Eingestellt von: Hilton-Taylor, C. & Maunder, M., 2011. Abgerufen am 13. Dezember 2023.
- ↑ a b c John W. Wilson, Richard B. Primack: Conservation Biology in Sub-Saharan Africa. Open Book Publishers, Cambridge, UK 2019, ISBN 978-1-78374-751-1, 8. Extinction Is Forever, S. 257–296, hier S. 260 f., doi:10.11647/OBP.0177.08 (Lizenz: Creative Commons Attribution 4.0 International license (CC BY 4.0)).
- ↑ a b c d e f g h i j G. Philip Clarke, Neil D. Burgess, Frank M. Mbago, Cosmas Mligo, Barbara Mackinder, Roy E. Gereau: Two ‘Extinct’ Trees Rediscovered Near Kilwa, Tanzania. In: Journal of East African Natural History. Band 100, Nr. 1&2, 2011, S. 133–140, doi:10.2982/028.100.0109.
- ↑ a b c d e f g h i Two twice ‘extinct’ trees rediscovered in coastal Tanzania. Scientists have confirmed the rediscovery of two tree species that were feared to have become extinct twice, according to a report published in the Journal of East African Natural History. The finds were made in highly threatened fragments of dry forest in coastal Tanzania. In: wwf.panda.org. 12. März 2012, abgerufen am 29. Januar 2024.
- ↑ Josh Luke Davis: Coral Tree. In: lostandfoundnature.com. Abgerufen am 16. Dezember 2023.
- ↑ a b c d Karomia gigas in der Roten Liste gefährdeter Arten der IUCN 2022. Eingestellt von: Fandey H.M. & Shaw, K., 2021. Abgerufen am 29. Januar 2024.
- ↑ Vergleiche: J.S. Boatwright: A rare new species of Polhillia (Genisteae, Fabaceae). In: South African Journal of Botany. Band 78, Nr. 1, Januar 2010, S. 142–145, doi:10.1016/j.sajb.2009.07.006.
- ↑ Ismail Ebrahim (Custodians of Rare and Endangered Wildflowers): Polhillia ignota Boatwr. In: pza.sanbi.org. November 2016, abgerufen am 16. Dezember 2023.
- ↑ a b c I. Ebrahim, N.A. Helme, D. Raimondo, D. van der Colff: Polhillia ignota Boatwr. National Assessment. In: redlist.sanbi.org (Red List of South African Plants version 2020.1). 2016, abgerufen am 16. Dezember 2023.
- ↑ J.S. Boatwright: A rare new species of Polhillia (Genisteae, Fabaceae). In: South African Journal of Botany. Band 78, Nr. 1, Januar 2010, S. 142–145, doi:10.1016/j.sajb.2009.07.006.
- ↑ a b c d D. Van der Colff, S. Kumschick, W. Foden, D. Raimondo, C. Botella, L. von Staden, J. R. U. Wilson: Drivers, predictors, and probabilities of plant extinctions in South Africa. In: Biodiversity and Conservation. Band 32, November 2023, S. 4313–4336, hier S. 4330, Fig. 6, doi:10.1007/s10531-023-02696-7 (Lizenz: Creative Commons Attribution 4.0 International License).
- ↑ D. Van der Colff, S. Kumschick, W. Foden, D. Raimondo, C. Botella, L. von Staden, J. R. U. Wilson: Drivers, predictors, and probabilities of plant extinctions in South Africa. In: Biodiversity and Conservation. Band 32, November 2023, S. 4313–4336, hier S. 4316, doi:10.1007/s10531-023-02696-7 (Lizenz: Creative Commons Attribution 4.0 International License).
- ↑ D. Van der Colff, S. Kumschick, W. Foden, D. Raimondo, C. Botella, L. von Staden, J. R. U. Wilson: Drivers, predictors, and probabilities of plant extinctions in South Africa. In: Biodiversity and Conservation. Band 32, November 2023, S. 4313–4336, hier S. 4327, doi:10.1007/s10531-023-02696-7 (Lizenz: Creative Commons Attribution 4.0 International License).
- ↑ Hypsela sessiliflora - Environment NSW. (PDF (2 Seiten)) NSW SCIENTIFIC COMMITTEE: Preliminary Determination: The Scientific Committee, established by the Threatened Species Conservation Act 1995 (the Act), has made a Preliminary Determination to support a proposal to remove Hypsela sessiliflora F. Wimmer from the Schedules of the Act by omitting reference to this species from Part 1 of Schedule 1 (Endangered species). The omission of species from the Schedules is provided for by Part 2 of the Act. In: environment.nsw.gov.au (NWS Environment and Heritage). 19. Februar 2016, abgerufen am 22. Januar 2024.
- ↑ a b c d e Thiago Serrano de Almeida Penedo, Miguel d’Ávila de Moraes, Rafael Augusto Xavier Borges, Daniel Maurenza, Diogo Marcilio Judice, Gustavo Martinelli: Considerations on extinct species of Brazilian flora. In: Rodriguésia. Band 66, Nr. 3, 2015, S. 711–715, doi:10.1590/2175-7860201566304 (Lizenz: Creative Commons Attribution 4.0 International (CC BY 4.0)).
- ↑ Homalolepis floribunda in der Roten Liste gefährdeter Arten der IUCN 2020. Eingestellt von: Crispim, G., Fernandez, E. & Devecchi, M.F., 2019. Abgerufen am 2. Februar 2024.
- ↑ a b c d Thuja sutchuenensis in der Roten Liste gefährdeter Arten der IUCN 2013. Eingestellt von: Yang, Y., Li, N., Christian, T. & Luscombe, D, 2010. Abgerufen am 5. Dezember 2023.
- ↑ a b c Xiang Qiaoping, A. Fajon, Li Zhenyu, Fu Likuo, Liu Zhengyu: Thuja sutchuenensis: a rediscovered species of the Cupressaceae. In: Botanical Journal of the Linnean Society. Band 139, Nr. 3, Juli 2002, S. 305–310, doi:10.1046/j.1095-8339.2002.00055.x.
- ↑ a b Jiangqun Jin, Quanshui Guo, Suying Han, Li Zhu, Yanqin Liu, Yuhan Chen: In vitro propagation of 'Lazarus' species Thuja sutchenensis Franch. In: Propagation of Ornamental Plants. Band 18, Nr. 3, 2018, ISSN 1311-9109, S. 77–86.
- ↑ Anogramma ascensionis in der Roten Liste gefährdeter Arten der IUCN 2010. Eingestellt von: Lambdon, P.W., Stroud, S., Gray, A., Niissalo, M., Renshaw, O. & Sarasan, V., 2010. Abgerufen am 5. November 2023.
- ↑ R. Aguraiuja, K. R. Wood: Diellia mannii (D. C. Eaton) Robins. (Aspleniaceae) Rediscovered in Hawai'i. In: American Fern Journal. Band 93, Nr. 3, 2003, S. 154–156, doi:10.1640/0002-8444(2003)093[0154:SN]2.0.CO;2.
- ↑ Asplenium dielmannii in der Roten Liste gefährdeter Arten der IUCN 2015. Eingestellt von: Kishida, W., 2015. Abgerufen am 11. Dezember 2023.
Anmerkungen
- ↑ Der Amerikanische Bison (Bison bison) war zur Zeit der Ankunft der weißen Siedler in Nordamerika mit einem geschätzten Bestand von über 60 Millionen Tieren die individuenreichste wildlebende Säugetierart Nordamerikas und wurde innerhalb von weniger als zwei Jahrhunderten nahezu ausgerottet (geschätzter Bestand 1885: in der US-amerikanischen Wildbahn 85 Exemplare, in der kanadischen Wildbahn 550 Exemplare, im Yellowstone-Nationalpark 200 Exemplare, in zoologischen Gärten 256 Exemplare). Als entscheidender Beweggrund für die an die Ausrottung reichende gezielte Dezimierung des Bisons in den USA wird angeführt, dass die sich gegen die Herrschaft der weißen Siedler auflehnenden Prärie-Indianer, die von den Bisons existenziell abhängig waren, ihrer Lebensgrundlage beraubt werden sollten. Als der Schutz des Bisons im Jahr 1901 gesetzlich geregelt wurde, lebten in den USA bereits die letzten Reste der Bisons in Reservaten und die Reste der Prärie-Indianderstämme in Indianerreservationen. Als ein zweiter wichtiger Beweggrund wird angeführt, dass die Entwicklung der Prärielandwirtschaft durch die Bisonherden gestört wurde, insbesondere während ihrer Massenwanderungen. (Quellen: Evžen Kůs, Václav Pfleger: Seltene und bedrohte Tiere: Die große farbige Enzyklopädie. Gondrom, Bindlach 2001, ISBN 3-8112-1830-1, hier S. 74. Brian Bergman: Macleans: Bison Back from Brink of Extinction. In: thecanadianencyclopedia.ca. 23. März 2004, abgerufen am 2. Februar 2024 (Update vom 15. Dezember 2013; Ursprüngliche Veröffentlichung im Maclean’s am 16. Februar 2004.). Bill Freedman: Environmental Science. a Canadian perspective. Dalhousie University Libraries Digital Editions, Halifax (Nova Scotia) 27. August 2018, S. 726–764, hier S. 744 f. (englisch, digitaleditions.library.dal.ca [PDF; abgerufen am 30. Januar 2024] Copyright: Dalhousie University; Lizenz: Creative Commons Attribution-NonCommercial 4.0 International License).).
- ↑ Bis wann zurückreichend das Aussterben einer Art im Rahmen des Konzepts der neoextinctions als in historischer Zeit geschehen betrachtet wird, kann in der Literatur zwischen den Tiergruppen und Autoren schwanken. Eine Unterteilung besteht darin, dass ein Aussterben in den letzten 400 Jahren als historisch anzusehen ist. Für die Gruppe der Vögel wurde auch das Jahr 1776 als Grenze verwendet mit dem Argument, dass aus der Zeit vor 1776 nur wenige verlässliche Berichte und Museumsexemplare existieren und Fälle für das Aussterben einer Art in dieser Zeit sehr selten dokumentiert wurden (Quelle: James T. Carlton, Jonathan B. Geller, Marjorie L. Reaka-Kudla, Elliott A. Norse: Historical Extinctions in the Sea. In: Annual Review of Ecology and Systematics. Band 30, 1999, S. 515–538, doi:10.1146/annurev.ecolsys.30.1.515.).
Auf dieser Seite verwendete Medien
Autor/Urheber: Jean-Pierre Hugot, Lizenz: CC BY 2.5
Young male Laotian rock rat, Laonastes aenigmamus (Diatomyidae, Rodentia).
The original PLOS ONE image has been modified by cropping.
(c) IUCN Red List of Threatened Species, species assessors and the authors of the spatial data., CC BY-SA 3.0
Parma Wallaby (Macropus parma) range
Autor/Urheber: Kevmin, Lizenz: CC BY-SA 4.0
A 7.2cm long Metasequoia occidentalis foliage spray. Klondike Mountain Formation, Republic, Ferry County, Washington, USA, Eocene, Ypresian, 49 million years old. Stonerose Interpretive Center Collection #
(c) IUCN Red List of Threatened Species, species assessors and the authors of the spatial data., CC BY-SA 3.0
geographic distribution of Discoglossus nigriventer
Autor/Urheber: Ansgar Walk, Lizenz: CC BY-SA 2.5
Wood Buffalo (Bison bison athabascae) in Wood Buffalo National Park, Canada
Autor/Urheber: Mysid in der Wikipedia auf Englisch, Lizenz: CC BY-SA 3.0
A en:population bottleneck. Drawn by en:User:TedE, vectorized by en:User:Mysid.
Autor/Urheber: A proietti, Lizenz: CC BY-SA 3.0
Geographical distribution of Laonastes aenigmamus according to Museum specimens.
Autor/Urheber: Grauesel, Lizenz: CC BY-SA 3.0
Hula Valley in Northern Israel seen from the Golan Heights
Blick von den Golanhöhen auf die Huleebene (Nordisrael)
Autor/Urheber: Cephas, Lizenz: CC BY-SA 3.0
Original distribution of plains bison (Bison bison bison) and wood bison (Bison bison athabascae) in North America, based on available zooarchaeological, paleontological, oral and written historical accounts. Holocene bison (Bison occidentalis) is an earlier form at the origin of B. b. bison and B. b. athabascae.
Autor/Urheber: Gilbert Alvarado Barboza y Randall Jiménez., Lizenz: CC BY-SA 4.0
Not extinct.Craugastor Escoces it's on mountains of Costa Rica.
Autor/Urheber: Cephas, Lizenz: CC BY-SA 4.0
Range map of Kinglet Calyptura (Calyptura cristata)
Autor/Urheber: Source: IUCN, 2019, CC BY 4.0., Lizenz: CC BY 4.0
Original description, according to the source, p. 328: "Figure 10.1 Habitat loss and degradation, much of which are driven by agriculture, are the most important threats to Africa’s wildlife, followed by overharvesting, invasive species and disease, and pollution. Groups of species often face similar threats: mammals and birds are more likely to be threatened by habitat loss, while fish and molluscs are more likely to be threatened by pollution. Percentages add up to more than 100% because many species face multiple threats. The influence of climate change is under-estimated because its impact on most species still need to be assessed. Source: IUCN, 2019, CC BY 4.0. ". Context in the source, page 328: "Habitat loss (and its associated degradation) is currently the most important threat facing Africa’s wildlife (Figure 10.1). When an ecosystem is destroyed or degraded, its ability to sustain wildlife is compromised, and the individuals that depend on that ecosystem for survival either need to adapt or move elsewhere, or they will die.".
Autor/Urheber: Alex Popovkin, Bahia, Brazil, Lizenz: CC BY 2.0
Simaba floribunda A.St.-Hil.
Autor/Urheber: Allthingsnative, Lizenz: CC BY-SA 3.0
Phebalium daviesii in the Australian National Botanic Garden, Canberra
Autor/Urheber: Naturalis Biodiversity Center, Lizenz: CC BY-SA 4.0
Megachile pluto (adult, dorsal view) : Preserved specimen number RMNH.INS.108876 from Naturalis Biodiversity Center - Zoology and Geology catalogues (nl) collected in Kampong Pasir Putih Halmahera on 1991-02-28 by Desmier de Chenon, R.
(c) Aviceda in der Wikipedia auf Englisch, CC BY 3.0
New Zealand Storm-Petrel (Oceanites maorianus)
Autor/Urheber: Junnn11, Lizenz: CC BY-SA 4.0
Ventral diagrammatic reconstruction of Schinderhannes bartelsi, a devonian radiodont (stem-Arthropoda: Dinocaridida: Radiodonta: Hurdiidae/Peytoiidae). Frontal appendage on the left side ommited in order to reveal lateral sclerite.
Autor/Urheber: Ewan ar Born, Lizenz: CC BY-SA 3.0
Topographic map in French of Aldabra island, Seychelles
Autor/Urheber: Oilshale, Lizenz: CC BY-SA 4.0
Der Quastenflosser †Holophagus penicillatus (Undina penicillata) Münster 1834 aus dem Jura von Painten, Deutschland. Coll. Oilshale.
Oestrelata magentae = Pterodroma magentae
Autor/Urheber: Cephas, Lizenz: CC BY-SA 4.0
Range map of Cherry-throated Tanager (Nemosia rourei)
Autor/Urheber: Xijun Ni, Qiang Li, Thomas A. Stidham, Lüzhou Li, Xiaoyu Lu, Jin Meng, Lizenz: CC BY 4.0
Original description: "Figure 3: Dentition of Gurbanodelta kara gen. et sp. nov. (A–E) Right M2, IVPP V 22801. (F–J) Right M2, IVPP V 22802, holotype. (K–O) Right M3, IVPP V 22803. (P–T) Right m1, IVPP V 22804. From left to right, the images are in occlusal, mesial, distal, buccal and lingual views, respectively. Scale bar indicates 1 mm." Context in the above mentioned original source: "Holotype: Institute of Vertebrate Paleontology and Paleoanthropology (IVPP), V 22802 (Fig. 3F–J), a right M2."
Autor/Urheber: Bodofzt, Lizenz: CC BY-SA 4.0
Abystoma leorae is a critically endangered salamander from the Sierra Nevada in Mexico. This photo was taken on shallow, icy waters near a small waterfall by the trail to the summit of Mount Tláloc, in Ixtapaluca, State of Mexico.
Autor/Urheber: Tirin (www.takver.com), Lizenz: CC BY-SA 3.0
George is a taxidermied male Leadbeater's Possum (Gymnobelideus leadbeateri) that Friends of Leadbeater's Possum uses for it's educational work concerning this threatened species. George was found dead but intact on the side of a logging road about 2011 in the Victorian Central Highlands. It is assumed that George's home in the mountain ash (Eucalyptus Regnans) forests was a victim of logging, and as his home was being carted away he fell off the logging truck.
(c) Cuora in der Wikipedia auf Englisch, CC BY-SA 3.0
Cuora yunnanensis Female by Ting Zhou / Torsten Blanck
Autor/Urheber: Wikipedia User, Lizenz: CC BY-SA 4.0
Mountain Pygmy Possum - Zoos Victoria
Autor/Urheber: Granitethighs, Lizenz: CC BY-SA 3.0
Lord Howe Island phasmid
Autor/Urheber: Royal Botanic Gardens, Kew, Lizenz: CC BY 4.0
Spécimen d'herbier de Ilex sapiiformis, collecté au Brésil, conservé par les Jardins botaniques royaux de Kew.
Autor/Urheber: Furfur, Lizenz: CC BY-SA 4.0
Verbreitungsgebiet des Sumatra-Nashorns (2016).
Solenodon cubanus, drawing/lithograph by J.D.L. Franz Wagner
Title: Abhandlungen der Königlichen Akademie der Wissenschaften zu Berlin
Identifier: abhandlungenderk1863deut (find matches)
Subjects: Science
Contributing Library: Smithsonian Libraries
Digitizing Sponsor: Smithsonian Libraries
View Book Page: Book Viewer
About This Book: Catalog Entry
View All Images: All Images From Book
Click here to view book online to see this illustration in context in a browseable online version of this book.
Autor/Urheber: Tschubby, Lizenz: CC BY-SA 3.0
Gemeinden von La Gomera
(c) IUCN Red List of Threatened Species, species assessors and the authors of the spatial data., CC BY-SA 3.0
Ichthyophis hypocyaneus range
Autor/Urheber: Ascension Island Government Conservation Department, Lizenz: CC BY-SA 3.0
A photograph of the parsley fern (Anogramma ascensionis) provided by Olivia Renshaw of the Ascension Island Government Conservation Department
Autor/Urheber: Anaxibia, Lizenz: CC BY-SA 3.0
Verspreiding van die twee Latimeria-spesies
Autor/Urheber: unknown, Lizenz: Copyrighted free use
Verbreitung des Nordinseltakahes (Porphyrio mantelli)
Distribution of Catagonus wagneri
Aerial view of Ball’s Pyramid, Lord Howe Island Group, NSW, Australia
(c) Cuora in der Wikipedia auf Englisch, CC BY-SA 3.0
Cuora yunnanensis male by Ting Zhou / Torsten Blanck
Autor/Urheber: Conselleria de Medi Ambient i Mobilitat, Govern des Illes Balears, Lizenz: CC BY-SA 3.0
Majorcan midwife toad
Copsychus cebuensis
Autor/Urheber: Cephas, Lizenz: CC BY-SA 4.0
Range map of Cone-billed Tanager (Conothraupis mesoleuca)
(c) IUCN Red List of Threatened Species, species assessors and the authors of the spatial data., CC BY-SA 3.0
Juan Fernández Fur Seal (Arctocephalus philippii) range
Autor/Urheber: After Ceballos et al., 2015, CC BY 4.0. (Ceballos, G., P.R. Ehrlich, A.D. Barnosky, et al. 2015. Accelerated modern human-induced species losses: Entering the sixth mass extinction. Science Advances 1: e1400253. https://doi.org/10.1126/sciadv.1400253), Lizenz: CC BY 4.0
Original description, according to the source, p. 260: "Figure 8.2 Percentage of Sub-Saharan Africa invertebrates, plants, reptiles, and mammals that have gone Extinct, Extinct in the Wild, and likely Extinct since the year 1500. Dashed line represents the natural rate of extinctions expected without human influences. After Ceballos et al., 2015, CC BY 4.0." Context in the source, page 159f: "If extinction and speciation are natural processes, an obvious question follows: “Why should we care about the loss of biodiversity?” The answer concerns not individual species extinctions as much as the increasing rate of these extinctions (Figure 8.2). While a species can be wiped off Earth over a relatively short period of time, speciation typically occurs slowly as the genetic makeup of a population shifts over thousands of years. Unfortunately, we are currently losing species 1,000 times faster than natural background extinction rates (for mammals estimated to be 1.8 extinctions per 10,000 species per 100 years, Barnosky et al., 2011), and future rates may be 10,000 times higher that background rates (de Vos et al., 2015). Because over 99% of current species extinctions have been linked to human activity rather than natural processes (Pimm et al., 2014), observations on past extinctions and subsequent speciation may not apply to the present. Moreover, unlike before, humans now share the planet with the species we are wiping out. These losses mean that we are also losing the benefits we gain from nature (Chapter 4) at unprecedented rates."
Autor/Urheber: Aeroid, Lizenz: CC BY-SA 4.0
IUCN Kategorien Rote Liste
Cebu Flowerpecker (Dicaeum quadricolor)
Autor/Urheber: Alalonso, Lizenz: CC BY-SA 3.0
Distribución del sapillo balear (Alytes muletensis)
Autor/Urheber: Salix, Lizenz: CC BY-SA 4.0
Cuscomys oblativa. Artist view. Pencil drawing, 2015.
Autor/Urheber: nmoorhatch, Lizenz: CC BY 4.0
Marsh Caecilian (Ichthyophis hypocyaneus)
Autor/Urheber: Mx. Granger, Lizenz: CC0
Haloragodendron lucasii at the Australian Botanic Garden Mount Annan.
A modern and historical range map of the Javan Rhinoceros (Rhinoceros sondaicus)
(c) Karte: NordNordWest, Lizenz: Creative Commons by-sa-3.0 de
Positionskarte von Sri Lanka
Autor/Urheber: Ninjatacoshell, Lizenz: CC BY-SA 3.0
The range of Polhillia ignota, according to [1]. The dotted line indicates a potential extension of the range of this species.
Autor/Urheber: Alberto Fernandez Fernandez, Lizenz: CC BY-SA 3.0
- Preserved specimen of chalumnae (Also known as Coelacanth [1]) in the Natural History Museum, Vienna, Austria.
- Believed to have been extinct for 70 million years, this specimen was caught the 18 October of 1974, next to Salimani/Selimani (Grande Comore, Comoros Islands) 11°48′40.7″S 43°16′3.3″E / 11.811306°S 43.267583°E
- Length: 170 cm - Weight: 60 kg
- Obtained by stiching 3 HiRes images and removing the background with image post-processing.
(c) IUCN Red List of Threatened Species, species assessors and the authors of the spatial data., CC BY-SA 3.0
Omilteme Cottontail (Sylvilagus insonus) range
(c) IUCN Red List of Threatened Species, species assessors and the authors of the spatial data., CC BY-SA 3.0
Leadbeater's Possum (Gymnobelideus leadbeateri) range
Autor/Urheber: Source: IUCN, 2019. Map by Johnny Wilson, Lizenz: CC BY 4.0
Original description, according to the source, p. 268: "Figure 8.5 The locations of Sub-Saharan Africa’s wildlife extinctions (including Extinct and Extinct in the Wild species) since 1500. Note how the largest number of extinctions involve species with restricted distributions, particularly those that occurred on islands. The scimitar-horned oryx is an example of mainland species that went extinct despite its large original range. Source: IUCN, 2019. Map by Johnny Wilson, CC BY 4.0. ". Context in the source, page 268: "Following the demise of many of the Cape Floristic Province’s large animals, humans have driven African species to extinction at an increasing pace. Today, at least 84 Sub-Saharan African species have been confirmed Extinct (Figure 8.5), nine species are Extinct in the Wild, and as many as 202 species are considered possibly Extinct (IUCN, 2019).".
Fossil preparation in a laboratory at the Thomas Condon Paleontology Center. The center is part of the John Day Fossil Beds National Monument near Dayville in the U.S. state of Oregon.
Amaurocichla bocagii (now Motacilla bocagei)
Autor/Urheber: Txllxt TxllxT, Lizenz: CC BY-SA 4.0
London - Cromwell Road - Natural History Museum 1881 by Alfred Waterhouse - Dodo
Thyreophora cynophila (original name : Musca cynophila)
Autor/Urheber: Photo by Catherina Onezia/Seychelles Islands Foundation, Lizenz: CC BY 4.0
Original description: "Figure 6.5 The Seychelles’ Aldabra banded snail was once thought to be one of the world’s first species pushed to extinction by climate change. Luckily, a small isolated population has been discovered, offering conservation biologists a second chance to ensure this species’ survival. Photograph by Catherina Onezia/Seychelles Islands Foundation, CC BY 4.0." Context in the above mentioned source: "Across many diverse ecosystems, a great number of species are threatened by climate change because of their poor dispersal abilities. Because they lack appropriate dispersal mechanisms, species, such as slow maturing plants (Foden et al., 2007), mosses, and flightless insects may simply not be able to keep up with changing climatic conditions. The impacts of climate change on Africa’s dispersal-limited species can already be seen. For example, the once abundant Aldabra banded snail (Rhachistia aldabrae, CR) is today so rare that this Lazarus species (Figure 6.5) was once believed to be extinct due to climate change (Battarbee, 2014)."
Atelopus ignescens
Autor/Urheber: Richard Crossley, Lizenz: CC BY-SA 3.0
Bermuda Petrel From The Crossley ID Guide Eastern Birds
Autor/Urheber: Mario1952, Lizenz: CC BY-SA 4.0
Global 200 region of Eastern Africa Coastal Forests
(c) Uzi Paz Pikiwiki Israel, CC BY 2.5
Latonia nigriventer
Autor/Urheber: A. J. T. Johnsingh, WWF-India and NCF, Lizenz: CC BY-SA 3.0
Pygmy hog in the Pygmy Hog Research and Breeding Centre in Assam, Guwahati, Assam
Autor/Urheber: Andreas Kay, Lizenz: CC BY-SA 4.0
Atelopus coynei. Species of amphibian rediscovered by Andreas Kay in Carchi province, Ecuador
Skull of Porcula salvania
Autor/Urheber: Sunzi safari, Lizenz: CC BY-SA 3.0
Urweltmammutbaum , Metasequoia glyptostroboides
Autor/Urheber: Magalhães, Lizenz: CC BY-SA 3.0
Locator map of Cebu Island, Philippines
Location map of the Atlantic Forest biome — in Brazil, Argentina, and Uruguay.
- The yellow line encloses Atlantic Forest — as delineated by the WWF.
- "I, Miguelrangeljr, made it using NASA Blue Marble imagery and Corel Draw X4."
Autor/Urheber: Mirko Thiessen, Lizenz: CC BY-SA 3.0
Distribution of the Guadalupe Fur Seal, Arctocephalus townsendi (dark blue: breeding colonies on Guadalupe Island; light blue: non-breeding individuals on Isla Cedros and Channel Islands)
Autor/Urheber: Claudio Martino, Lizenz: CC BY-SA 4.0
Stuffed Indonesian coelacanth in the pavilions of Indonesia during Expo 2015 in Milan, Italy
Autor/Urheber: Gmmv1980, Lizenz: CC BY-SA 4.0
Catagonus wagneri en el Parque Nacional Teniente Enciso, Boquerón, Paraguay.
© N. Tamura, CC BY-SA 3.0
Schinderhannes
Autor/Urheber: Carlos Bartolomé, Lizenz: CC BY 3.0
Gallotia simonyi distribution map.
Autor/Urheber: Koshy Koshy from Faridabad, Haryana, India, Lizenz: CC BY 2.0
Finn's is also called the Yellow Weaver for obvious reasons. They are found in the valleys of Ganga and Brahmaputra in India and Nepal. The nest of the Finn's Weaver is different from all others in that they are built on Semul trees after removing the existing leaves.
Autor/Urheber: Stitchingbushwalker, Lizenz: CC BY-SA 4.0
Isotoma fluviatilis - Swamp Isotome in the Pilliga - habit and flowers
Autor/Urheber: Abalg with File:Megachile pluto.jpg and File:1911 Britannica - Bee - Apis mellifica.png, Lizenz: CC BY-SA 4.0
Morphological comparison between a female Megachile pluto and a worker Apis mellifera. The scale is respected thanks to Messer's photograph and measurements. (Source : Messer A.C (1984) Chalicodoma pluto: the world's largest bee rediscovered living communally in termite nests (Hymenoptera: Megachilidae). Journal of the Kansas Entomological Society, 165-168.).
Autor/Urheber: Gould, 1846, Lizenz: CC0
Lottia scabra (Gould, 1846)
(c) IUCN Red List of Threatened Species, species assessors and the authors of the spatial data., CC BY-SA 3.0
Geographic distribution of Cyclura collei
Extinct Tecopa pupfish (Cyprinodon nevadensis calidae).
Autor/Urheber: Anglo-Araneophilus, unter Verwendung von Daten aus Brett R. Scheffers, Ding Li Yong, J. Berton C. Harris, Xingli Giam & Navjot S. Sodhi: "The World's Rediscovered Species: Back from the Brink?", PLoS ONE, 6, (7), 2011, e22531, DOI: 10.1371/journal.pone.0022531, hier 4. Seite, Fig. 1., Lizenz: CC BY-SA 3.0
Anzahl der Jahre, in denen jede Art verschollen war, bevor sie wiederentdeckt wurde. Datenquelle ist: Brett R. Scheffers, Ding Li Yong, J. Berton C. Harris, Xingli Giam & Navjot S. Sodhi: "The World's Rediscovered Species: Back from the Brink?", PLoS ONE, 6, (7), 2011, e22531, DOI: 10.1371/journal.pone.0022531, hier 4. Seite, Fig. 1 ("Number of years each species went missing before being rediscovered.", mit der Erklärung: "The number of years each species went missing before being rediscovered plotted for all amphibian, bird, and mammal species as well as total species (all species combined). Years missing = year rediscovered - year last seen. Black vertical bars indicate mean years missing. Years missing are binned by 10 year increments. doi:10.1371/journal.pone.0022531.g001") Kontext in der zitierten Quelle: "We recorded 351 species rediscoveries (Table S1, 104 amphibians, 144 birds, and 103 mammals) over the past 122 years (Ploceus megarhynchus (yellow weaver) was the first documented rediscovery, reported in 1889), amounting to approximately 3 species per year. Species went unseen on average for 61 years before being rediscovered (range of 3–331 years) (Figure 1)."
Autor/Urheber: After IUCN, 2017, CC BY 4.0. (IUCN. 2017. Guidelines for using the IUCN Red List categories and criteria, v. 13 (Gland: IUCN). http://nc.iucnredlist.org/redlist/content/attachment_files/RedListGuidelines.pdf), Lizenz: CC BY 4.0
Original description, according to the source, p. 272: "Figure 8.7 Flow diagram illustrating the structure of the IUCN categories of conservation status. An evaluated species can be considered at lower risk of extinction, at high risk of extinction (i.e. threatened), or extinct. A species for which not enough data are available for evaluation is considered Data Deficient (DD). After IUCN, 2017, CC BY 4.0." Context in the source, page 271f: "An important task for conservation biologists is to identify and prioritise those species in greatest danger of extinction. Accomplishing this task requires biologists to collect and review all the information we have on each species. To facilitate this major undertaking, the IUCN has formalised the evaluation and reporting of threatened species assessments using an internationally accepted standard of conservation categories to reflect a taxon’s risk of extinction. These nine categories (Figure 8.7), known as Red List Assessments (IUCN, 2017), are: Extinct (EX). These species are no longer known to exist. As of mid-2019, the IUCN has listed 84 Sub-Saharan African species as Extinct. Extinct in the Wild (EW). These species exist only in cultivation, in captivity, or other human-managed situations. As of mid-2019, the IUCN has listed nine Sub-Saharan African species as Extinct in the Wild. Critically Endangered (CR). These species have an extremely high risk of going extinct in the wild. As of mid-2019, the IUCN has listed 880 Sub-Saharan African species as Critically Endangered. Also included in this category are the 202 Sub-Saharan African species that the IUCN considered possibly Extinct. Endangered (EN). These species have a very high risk of extinction in the wild. As of mid-2019, the IUCN has listed 1,600 Sub-Saharan African species as Endangered. Vulnerable (VU). These species have a moderately high risk of extinction in the wild. As of mid-2019, the IUCN has listed 2,153 Sub-Saharan African species as Vulnerable. Near Threatened (NT). These species are close to qualifying for a threatened category but are not currently considered threatened. As of mid-2019, the IUCN has listed 1,034 Sub-Saharan African species as Near Threatened. Data Deficient (DD). Inadequate information exists to determine the risk of extinction for these species. As of mid-2019, the IUCN has listed 2,441 Sub-Saharan African species as Data Deficient. Least Concern (LC). These species are not considered Near Threatened or threatened. (Widespread and abundant species are included in this category.) As of mid-2019, the IUCN has listed 11,776 Sub-Saharan African species as Least Concern. Not Evaluated (NE). Species that have not yet been evaluated. Most species fall in this category."
Autor/Urheber: Miguelrangeljr, Lizenz: CC BY-SA 3.0
Male golden capuchin (Sapajus flavius) in São Paulo Zoo.
Autor/Urheber: Bjoertvedt, Lizenz: CC BY-SA 3.0
Ptychochromis insolitus, a native of Madagascar, in London Zoo.
Note: File-name is misleading. No such thing as "Prychochromis mangarahara", but Ptychochromis insolitus, which is the species on the photo, was known as Ptychochromis sp. nov. 'Mangarahara' until officially described (from a comment on w:Ptychochromis insolitus)
Autor/Urheber: User:MatthiasKabel, Lizenz: CC BY-SA 2.5
Macropus parma with juvenile in pouch. Zoo Salzburg
(c) IUCN Red List of Threatened Species, species assessors and the authors of the spatial data., CC BY-SA 3.0
Sir David's Long-beaked Echidna (Zaglossus attenboroughi) range
Autor/Urheber: Haplochromis, Lizenz: CC BY-SA 4.0
Blond Capuchin (Cebus flavius) range
Autor/Urheber: unknown, Lizenz: Copyrighted free use
Autor/Urheber: DiverDave, Lizenz: CC BY-SA 3.0
Lumholtz's tree kangaroo (Dendrolagus lumholtzii) at David Fleay Wildlife Park, Burleigh Heads, Queensland.
(c) IUCN Red List of Threatened Species, species assessors and the authors of the spatial data., CC BY-SA 3.0
Cuban Solenodon (Solenodon cubanus) range
Autor/Urheber: L.J. Mendis Wickramasinghe, Lizenz: CC BY 4.0
Pseudophilautus hypomelas" from the Peak Wilderness, Central Hills of Sri Lanka. Source: Wickramasinghe, L. J. M., D. R. Vidanapathirana, M. D. G. Rajeev, and N. Wickramasinghe. 2013. Rediscovery of Pseudophilautus hypomelas (Günther, 1876) (Amphibia: Anura: Rhacophoridae) from the Peak Wilderness, Sri Lanka, a species thought to be extinct! Journal of Threatened Taxa 5:5181–5193. doi: 10.11609/JoTT.o3547.5181-93
Autor/Urheber: Die Autorenschaft wurde nicht in einer maschinell lesbaren Form angegeben. Es wird Mbz1 als Autor angenommen (basierend auf den Rechteinhaber-Angaben)., Lizenz: CC BY-SA 3.0
Jellyfish tree with fruits
Autor/Urheber: Nobu Tamura email:nobu.tamura@yahoo.com http://spinops.blogspot.com/, Lizenz: CC BY-SA 4.0
Life reconstruction of Lazarussuchus inexpectatus
(c) WikipedianProlific aus der englischsprachigen Wikipedia, CC BY-SA 3.0
Rhinozeros-Größenverhältnisse:
- Panzernashorn, über 1,8 m
- Breitmaulnashorn, über 1,8 m
- Spitzmaulnashorn, über 1,5 m
- Java-Nashorn, 1,5 m
- Sumatra-Nashorn, 1,4 m
Autor/Urheber: RealGatba, Lizenz: CC BY-SA 4.0
Fossil hunters look for trilobites and other fossils in Penn Dixie.
Autor/Urheber: (c) Brian du Preez, some rights reserved (CC BY-SA), Lizenz: CC BY-SA 4.0
Photo of Polhillia ignota uploaded from iNaturalist.
(c) IUCN Red List of Threatened Species, species assessors and the authors of the spatial data., CC BY-SA 3.0
Mountain Pygmy Possum (Burramys parvus) range
Autor/Urheber: Naturalis , Lizenz: CC0
Zaglossus attenboroughi Flannery & Groves, 1998 2432572562
Autor/Urheber: Anglo-Araneophilus, unter Verwendung von Daten aus Erwin 1996 Douglas H. Erwin, "Understanding biotic recoveries: extinction, survival and preservation during the end-Permian mass extinction", In: D. Jablonski, D. H. Erwin & J. Lipps (Hrsg.): "Evolutionary Paleobiology", S. 398–418, Chicago: University of Chicago Press, ISBN: 9780226389110, hier S. 405, Table 15.1), Lizenz: CC BY-SA 3.0
Darstellung des (hier in grauer Farbe hervorgehobenen) Lazarus-Effekts (im Sinne von Wignall & Benton 1999, siehe unten zitiert) am schematischen Beispiel der Diversitätsänderungen eines Taxons (im Rang einer Klasse) durch das Massenaussterben an der Perm-Trias-Grenze. Diese Darstellung ist in ihren genauen Werten nicht wissenschaftlich für ein Taxon überprüft worden, sondern lediglich schematisch zu verstehen. Grundlage für diese Darstellung waren ähnliche Darstellungen zu den Diversitätsänderungen der Gastropoden bis zum Ende des Massenaussterbens an der Perm-Trias-Grenze in folgenden Quellen: 1.: Douglas H. Erwin, "Understanding biotic recoveries: extinction, survival and preservation during the end-Permian mass extinction", In: D. Jablonski, D. H. Erwin & J. Lipps (Hrsg.): "Evolutionary Paleobiology", S. 398–418, Chicago: University of Chicago Press, 1996, ISBN: 9780226389110, hier S. 405, Fig. 15.3 (Global generic gastropod diversity from the Wordian through Anisian. The left-hand scale and the lines show total diversity (solid line), the number of Lazarus genera (dottet line), and apparent diversity (total diversity minus Lazarus taxa; Dashed line). [...]"), Table 15.1 ("Diversity history of gastropod genera from the mid-Permian (Wordian) through the Middle Triassic (Anisian)"); 2.: P. B. Wignall & M. J. Benton, "Lazarus taxa and fossil abundance at times of biotic crisis", Journal of the Geological Society, 156, (3), 1999, S. 453–456, DOI: https://doi.org/10.1144/gsjgs.156.3.0453, hier S. 454, Fig. 2 ("Diversity changes of gastropod genera through the end Permian mass extinction (from Erwin 1996), where the lower line shows the recorded number and upper line includes Lazarus taxa, compared with fluctuations in the number of shallow marine formations yielding benthic fossils in the Midian to Anisian interval. The importance of the Lazarus effect (depicted as the space between recorded and total number of genera) shows no correlation with the abundance of fossiliferous strata. [...] The Permian-Triassic boundary occurs between the Chanxingian and Griesbachian Stages.")
Autor/Urheber:
Rinina25 & Twice25, Lizenz: CC BY-SA 2.5
fossil resembling Wollemia nobilis)
Autor/Urheber: Nick Athanas, Lizenz: CC BY-SA 2.0
Male Cone-billed Tanager from an oxbow lake next to the Rio Claro, São José do Rio Claro, Mato Grosso, Brazil.
Autor/Urheber: Tonypaph, Lizenz: CC BY-SA 4.0
Puntung กระซู่ชนิดย่อย D. s. harrissoni กำลังแช่ปลักในสถานเพาะเลี้ยง กระซู่ตัวนี้จับได้ในรัฐซาบาห์ ในปีพ.ศ. 2554 เพื่อเข้าโครงการอนุรักษ์
Autor/Urheber: Vega asensio, Lizenz: CC BY-SA 3.0
Gallotia Simonyi. Female. Hierro giant lizard. Scientific illustration. Pen.
Description according to the original source as cited: "Geologic Resources Division: Adapid Primate: "Ekgmowechashala zancanelli" is a small lemur-like adapid primate that lived during the Oligocene. It is shown in a hackberry tree. Fossils of "Ekgmowechashala" have been found at John Day Fossil Beds National Monument, Oregon."
Autor/Urheber: Stitchingbushwalker, Lizenz: CC BY-SA 4.0
Isotoma fluviatilis avh records 21Oct21
Autor/Urheber: Evelyn L. Jensen, Stephen J. Gaughran, Nicole A. Fusco, Nikos Poulakakis, Washington Tapia, Christian Sevilla, Jeffreys Málaga, Carol Mariani, James P. Gibbs & Adalgisa Caccone, Lizenz: CC BY 4.0
Map of the Galapagos Archipelago, indicating the approximate locations on Fernandina Island where the Chelonoidis phantasticus individuals were found in 1906 and 2019.
Island names are in capital letters, species names are in italics. Tortoise icons indicate the morphology of the species, either domed (gray), saddleback (white), or semi-saddleback (indicated with both icons present). Map tiles by Stamen Design, under CC BY 3.0. Data by OpenStreetMap, under ODbL. Image of Fernanda by Lucas Bustamante © Galapagos Conservancy, image of the historical specimen Kathryn Whitney © California Academy of Sciences.Autor/Urheber: Emőke Dénes, Lizenz: CC BY-SA 4.0
Taxidermied female and male ivory-billed woodpecker (Campephilus principalis) at the Natural History Museum in London, England.
Autor/Urheber: Milivoje Krvavac, Lizenz: CC BY-SA 4.0
Kandyan Dwarf Toad (Adenomus kandianus). Species of amphibian.
Autor/Urheber: Carlos Bartolomé, Lizenz: CC BY-SA 4.0
Gallotia auaritae distribution map.
Lagarto gigante de la Gomera. Fotografía tomada en el centro de recuperación del lagarto gigante de Valle Gran Rey (La Gomera)
(c) Domenico-de-ga, CC BY-SA 3.0
Politische Karte von Sao Tome und Principe (Provinz Sao Tome hervorgehoben)
Autor/Urheber: Yale Peabody Museum, Lizenz: CC BY-SA 4.0
VP.001090: Cteniogenys antiquus
Illustration in the book Fresh-Waters Fishes of Europe. A History of their Genera, Species, Structure, Habits and Distribution by Harry Govier Seeley (1839-1909)
Autor/Urheber: Jony Cooper, Lizenz: CC BY-SA 4.0
Atelopus balios in Awashima marine park
Autor/Urheber: Cephas, Lizenz: CC BY-SA 3.0
Distribution of public herds of plains bison (Bison bison bison) and of free-ranging or captive breeding wood bison (Bison bison athabascae) in North America as of 2003.
Autor/Urheber: Pfeiffer, 1852, Lizenz: CC0
Omphalotropis plicosa Pfeiffer, 1852
Autor/Urheber: Dr. Blofeld, Lizenz: CC BY-SA 4.0
Utbredelseskart for principetrost (Turdus xanthorhynchus), lys grønn = sikker utbredelse, grønn = mulig utbredelse
Autor/Urheber: Pevenseytom, Lizenz: CC BY-SA 4.0
Female Mangarahara cichlid in the aquarium of Thomas Williams, an aquarist involved in the breeding programme for this species which is now very likely to be extinct in the wild.
Autor/Urheber: Gray, 1839, Lizenz: CC0
Littoraria melanostoma (Gray, 1839)
Tab.XY.
/);: R..A. FkOipm deL
Autor/Urheber: Source: OpenStax, 2019, Lizenz: CC BY 4.0
Original description, according to the source, p. 258: "Figure 8.1 There have been five past mass extinction events—periods when natural events changed Earth’s environment so dramatically that between 60–95% of species were wiped away forever—over Earth’s geological history. So far, the most dramatic extinction event occurred at the end of the Permian period, about 250 million years ago, and thought to be the result of widespread volcanic activity and climate change. The most recent mass extinction, at the end of the Cretaceous period about 65 million years ago and thought to be the result of a massive asteroid impact, saw the disappearance of non-avian dinosaurs. Source: OpenStax, 2019, CC BY 4.0. There have been five past mass extinction events—periods when natural events changed Earth’s environment so dramatically that between 60–95% of species were wiped away forever—over Earth’s geological history. So far, the most dramatic extinction event occurred at the end of the Permian period, about 250 million years ago, and thought to be the result of widespread volcanic activity and climate change. The most recent mass extinction, at the end of the Cretaceous period about 65 million years ago and thought to be the result of a massive asteroid impact, saw the disappearance of non-avian dinosaurs. Source: OpenStax, 2019, CC BY 4.0.". Context in the source, page 258: "While many extinction events have been rather limited in scope and, hence, caused only one or a few extinctions at a time, there have been instances where perturbations were so impactful that they drove very large numbers of species to extinction over a short period of time. There have been five such past mass extinction events—periods marked by the sudden and dramatic loss of a large percentage of species (Figure 8.1). But these mass extinctions have also been followed by periods that favoured increased rates of speciation, during which new species evolved to fill the niches left empty by the extinctions.".
Autor/Urheber: Die Autorenschaft wurde nicht in einer maschinell lesbaren Form angegeben. Es wird MPF als Autor angenommen (basierend auf den Rechteinhaber-Angaben)., Lizenz: CC BY 2.5
Metasequoia glyptostroboides fallen foliage: the foliage falls in whole shoots (not individual leaves), a process known as cladoptosis
La Cumbre volcano, Fernandina Island, Galapagos. Photographed from the International Space Station.
The timing of extinctions follows the "march of man" (after Martin, 1989) ; source : Martin P. S. (1989). Prehistoric overkill: A global model. In Quaternary extinctions: A prehistoric revolution (ed. P.S. Martin and R.G. Klein). Tucson, AZ: Univ. Arizona Press. pp. 354–404. ISBN 0-8165-1100-4.
Female and male takahē standing in the grass; female on the left, male on the right eating grass